奈必洛尔对非对称性二甲基精氨酸诱导损伤人脐静脉内皮细胞的保护作用研究
2018-10-12,,,
,, ,
血管内皮功能不全在心血管疾病的发生发展中起重要作用,有效预防内皮功能受损可延缓乃至逆转相关病变进程。一氧化氮(nitric oxide,NO)是目前所知最有效的内源性血管舒张因子,能有效舒张血管,调节血压。体内NO由L-精氨酸在一氧化氮合酶(nitric oxide synthase,NOS)催化下产生。内源性NOS竞争性抑制剂非对称性二甲基精氨酸(asymmetric dimethylarginine,ADMA)与血管内皮功能失调密切相关,是内皮功能失调新的危险因子[1]。ADMA竞争性抑制NOS活性,减少NO生成可能是其致血管内皮功能失调的主要机制。
奈必洛尔(Nebivolol)是一种新型抗高血压药,选择性阻断β1受体,并具有NO依赖性血管舒张作用。前期实验发现奈必洛尔可改善自发性高血压大鼠主动脉内皮损伤情况,其作用可能与减少ADMA生成有关[2]。但奈比洛尔是否可以直接对抗ADMA引起的细胞损伤还未有实验证实。本实验观察奈必洛尔对ADMA损伤人脐静脉内皮细胞(HUVECs)的拮抗作用。现报道如下。
1 材料与方法
1.1 材料 人脐静脉内皮细胞株(HUVEC)由北京大学医学院肿瘤研究所提供(来源于美国ATCC细胞库)。ADMA购自Sigma公司;NO、NOS测定试剂盒均为南京建成生物工程研究所产品;内皮型一氧化氮合酶(eNOS)引物购自北京奥科生物技术有限公司;RT-PCR试剂盒购自TaKaRa公司。
1.2 细胞培养 HUVEC解冻复苏后,无菌条件下移入细胞培养瓶中,加入含10%胎牛血清的DMEM培养基(青霉素、链霉素各100 U/mL),置二氧化碳(CO2)培养箱中37 ℃静置培养。待细胞80%融合时,换成含1%小牛血清的DMEM培养液继续培养24 h,使细胞达到同步化,然后分别加入不同的药物处理。1.3 实验分组 空白对照组:用含1%小牛血清的DMEM培养液孵育细胞24 h;ADMA组:用含16 μmol/L ADMA的培养液孵育细胞24 h;不同剂量奈比洛尔组:分别加入终浓度为5 μmol/L、10 μmol/L、20 μmol/L的奈比洛尔孵育细胞1 h后, 加入16 μmol/L ADMA继续孵育细胞24 h;阿替洛尔组:加入终浓度20 μmol/L的阿替洛尔与孵育细胞1 h后,加入16 μmol/L ADMA继续孵育细胞24 h。离心收集细胞和培养液。
1.4 细胞上清液NO含量、NOS活性测定 不同因素处理细胞后,0.25%胰酶消化、收集细胞悬液,低速离心收集细胞上清液。细胞上清液中NO含量和NOS活性检测按试剂盒说明进行。
1.5 RT-PCR检测eNOSmRNA表达 按照Qiagen 公司RNeasy Mini Kit 试剂盒说明书提取细胞总RNA。将提取的RNA样品经1.5%琼脂糖凝胶电泳后,取1 μL RNA 样品稀释50倍,用于定量实验。eNOS引物(上游:5′-AGGAGGCCTTCCGAGGCTGG-3′,下游:5′-GGTGGCCCTCGTGGACTTGC-3′, 260bp),甘油醛-3-磷酸脱氢酶(GAPDH)引物(上游:5′-TCCTGCACCACCAACTGCTTAG-3′,下游:5′-GATGACCTTGCCCACAGCCTTG-3′,307bp)。PCR反应条件如下:94 ℃预变性2 min,进入循环,94 ℃30 s,57 ℃退火45 s,72 ℃延伸2 min,行30个循环,72 ℃延伸5 min。取电泳级琼脂糖溶于0.5×TBE电泳缓冲液中,制成含1.5%的琼脂糖凝胶。加入溴化乙啶,使终浓度为0.5 μg/mL。取eNOS和GAPDH的PCR产物各5 μL,同6×上样缓冲液按5∶1混匀,加入样品孔中,100 V电压,电泳约60 min。将琼脂糖凝胶通过天能凝胶成像系统进行扫描并分析,计算出各组织中的eNOS与内参照GAPDH灰度的相对比值(%)。
检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 奈比洛尔对ADMA损伤的HUVECs上清液NO、NOS活性的影响 与空白对照组比较,ADMA组作用24 h后,HUVECs上清液NO含量和NOS活性下降(P<0.05)。奈比洛尔孵育后,可剂量依赖性增加上清液NO浓度和NOS活性。阿替洛尔对ADMA损伤的HUVECs上清液NO含量和NOS活性无显著影响。详见表1。
2.2 奈比洛尔对ADMA损伤的HUVECs eNOS mRNA表达的影响 与空白对照组比较,ADMA(16 μmol/L)孵育24 h后,HUVECs eNOS mRNA表达下调(P<0.05),奈比洛尔可改善ADMA引起的HUVECse NOS mRNA表达下降(P<0.05),阿替洛尔对此无明显影响。详见图1。

表1 奈必洛尔对ADMA诱导损伤HUVECs上清液NO含量和NOS活性的影响(±s)
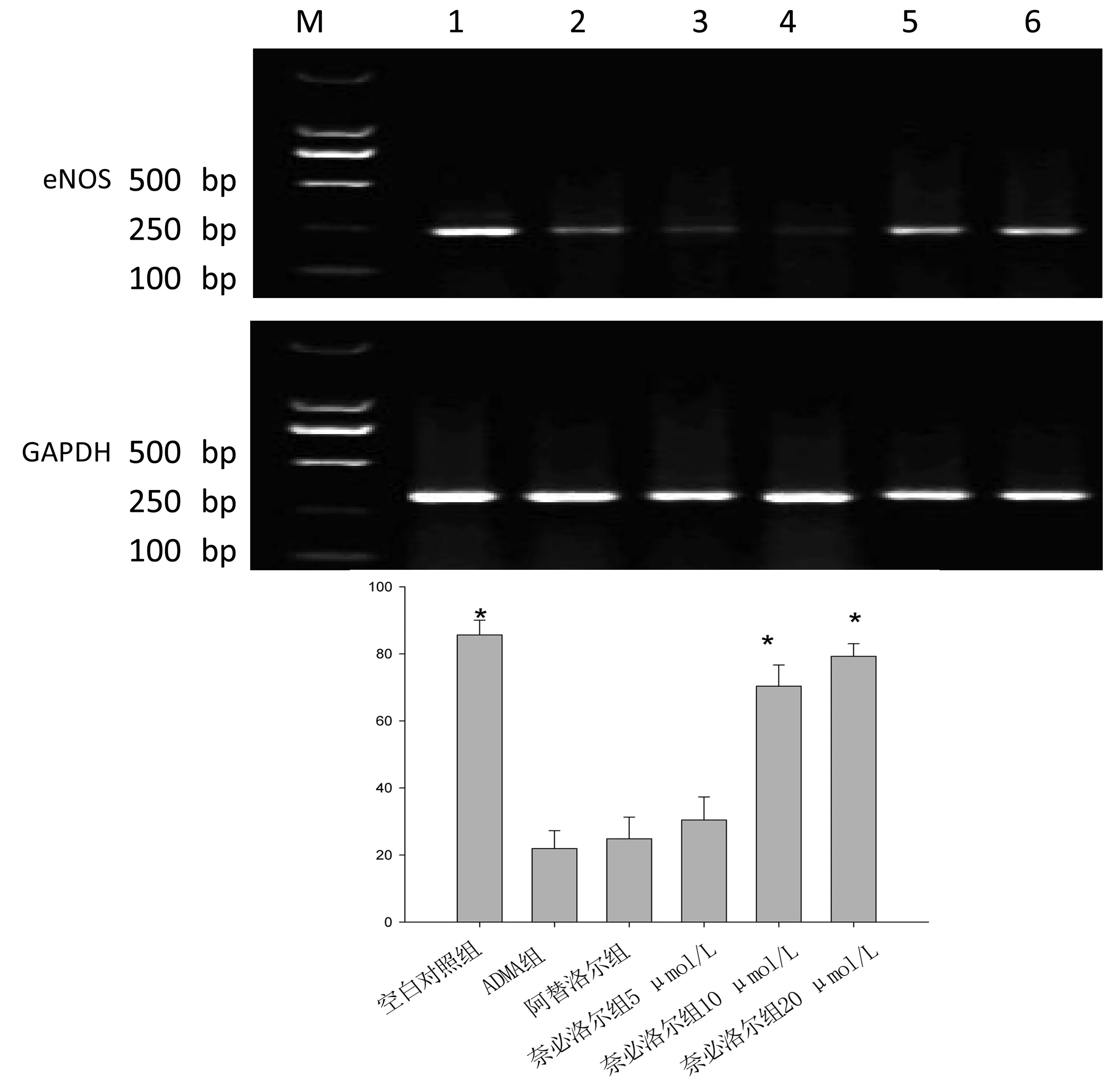
M:Marker;1:空白对照组;2:ADMA组;3:阿替洛尔组;4:奈必洛尔组5 μmol/L;5:奈必洛尔组10 μmol/L;6:奈必洛尔组20 μmol/L。与ADMA 组比较,*P<0.05。
图1奈必洛尔对ADMA诱导损伤HUVECs eNOSmRNA表达的影响
3 讨 论
血管内皮功能障碍的成因复杂,NO的生成量减少是其原因之一。ADMA作为一种内源性NOS 抑制剂,结构与L-精氨酸相似,竞争结合NOS,抑制其活性,从而减少NO生成[3]。血浆中过高的ADMA水平导致血管舒张功能降低,增加内皮细胞黏附性,促进动脉内膜增厚,已被列为一种新的心血管疾病危险因素。研究证实,体内病理生理作用相关的ADMA浓度(3 μmol/L~16 μmol/L),就可明显抑制体外NOS的活性,减少NO的生成[4]。另外,体外实验表明,ADMA可损伤内皮细胞,其作用在16 μmol/L最显著。因此,本研究在细胞培养实验中选用了浓度为16 μmol/L的ADMA损伤HUVECs。结果显示,ADMA 16 μmol/L可显著降低HUVECs上清液NO水平和NOS活性,下调细胞eNOS mRNA表达。ADMA 导致内皮功能紊乱的可能机制:①ADMA 导致NOS 活性解偶联,不能催化L-精氨酸的双电子氧化生成NO;②ADMA 在NOS 的活性部位起竞争性抑制作用。证实ADMA是新的心血管疾病预测因子。
作为一种新型的选择性β1受体阻断剂,奈必洛尔已在国外应用于临床,1997年首先在德国上市,1998年又在英国上市,2007年美国食品和药物管理局允许应用于轻中度高血压的治疗。而在我国,奈必洛尔还未真正应用于临床。本课题组对奈必洛尔进行了一些基础研究,研究发现奈必洛尔可通过改善自发性高血压大鼠(SHR)主动脉血管反应性[5],减少SHR主动脉ADMA的生成,增加动脉NO、eNOS蛋白表达[2]。这说明奈必洛尔可通过减少ADMA生成发挥血管保护作用。奈必洛尔可抑制ADMA的缩血管作用[6],推测奈必洛尔可以对抗ADMA诱导的HUVECs损伤。本研究结果显示,奈必洛尔浓度依赖性拮抗ADMA致HUVECs损伤,增加上清液NO水平和NOS活性,上调eNOSmRNA表达。
综上所述,奈必洛尔可有效对抗ADMA诱导的心血管损伤。但奈必洛尔对抗ADMA损伤的可能机制需要进一步研究。
