microRNA-200b下调DNMT3A的表达对SD大鼠心肌纤维化抑制作用的机制研究
2018-10-11秦润禾倪世豪丁季飞石开虎
秦润禾,陶 辉,倪世豪,代 晨,丁季飞,施 鹏,石开虎
(1. 安徽医科大学第二附属医院心胸外科,安徽 合肥 230601;2. 安徽医科大学心血管病研究中心,安徽 合肥 230601)
心肌纤维化是多种因素引起的心肌细胞间质出现异常胶原纤维的沉积,是多种心脏疾病发生、发展的重要危险因素及病理基础[1]。心肌成纤维细胞(cardiomyocyte fibroblasts,CFs) 是纤维化时细胞外基质重要的来源细胞,当CFs被激活增殖,细胞外基质合成分泌增加,进一步促进了纤维化。因此,抑制CFs活化增殖成为抑制心肌纤维化的关键点[2]。近年来的大量研究证实,miRNA广泛参与各类心血管疾病的发生、发展,如心室肥大、心肌纤维化、心肌梗死、心律不齐等[3]。miRNA是一类长为22~23个核苷酸的内源性非编码小RNA,通过与靶蛋白mRNA 3′端非编码区的不完全互补结合,抑制mRNA转录后靶蛋白的表达[4]。DNA甲基化是指生物体在DNA甲基转移酶的催化作用下,将甲基转移到特定碱基上的过程,由此可造成生物体发生胚胎分化、基因失活、器官衰老等现象。DNA甲基化会导致某些区域DNA构象变化,从而影响了蛋白质与DNA的相互作用。其中,DNA甲基化转移酶3A(DNA methyltransferase 3A,DNMT3A)作为DNA甲基化酶之一,在本课题组前期研究中已显示其参与心肌纤维化的发生、发展[5-6]。有研究指出,DNA甲基化与miRNA之间存在重要的调控联系。另有研究显示,miR-200b可靶向调控DNMT3A,影响非小细胞肺癌的发生、发展[7]。本研究拟通过体内及体外实验:一方面,构建SD大鼠心肌纤维化模型,检测miR-200b、DNMT3A,以及反映心肌纤维化的标志性蛋白I型胶原前胶原(collagen type I alpha 1,Col1A1)和α-平滑肌肌动蛋白( α-smooth muscle actin,α-SMA);另一方面,体外培养CFs,通过干扰miR-200b的表达,检测CFs中DNMT3A的表达及反映心肌纤维化的标志性蛋白Col1A1 和α-SMA的改变情况,旨在探讨DNMT3A影响心肌纤维化的过程是否亦受到miR-200b的靶向调控,为探寻新型治疗和干预心肌纤维化的有效途径提供理论依据。
1 材料与方法
1.1材料
1.1.1实验动物 SD大鼠60只,♂,体质量(140~160) g;SD♂乳鼠80只,出生6~7 d,体质量(20~22) g,均购自安徽医科大学实验动物中心,动物合格证号:SCXK(皖)2017-001。
1.1.2试剂 盐酸异丙肾上腺素(isoproterenol,ISO)注射液(中国西南药业股份有限公司);DMEM培养基(美国赛默飞公司);胎牛血清(英国Gibco公司);胰蛋白酶(美国WISENT公司);LipofectamineTM2000、TRIzol(美国Invitrogen公司);miR-200b促进剂、抑制剂转染试剂(上海吉玛公司);抗Col1A1、α-SMA、DNMT3A、β-actin抗体(北京博奥森生物技术有限公司);MTT相关试剂(上海剑钝生物科技有限公司)。
1.1.3仪器 Multiskan FC酶标仪、细胞培养箱、PCR仪(美国Thermo Fisher Scientific公司);高速冷冻离心机(德国Eppendorf公司);Western blot显影及相关设备(美国Bio-Rad公司);超净工作台(苏州泰安空气技术公司);HAD-K5600超微量分光光度计(北京恒奥德科技有限公司)。
1.2方法
1.2.1SD大鼠心肌纤维化模型的建立 60只SD♂大鼠适应性喂养1周后,开始实验。大鼠随机分为2组:ISO组30只,取0.5% ISO,按每天6 mg·kg-1的剂量腹腔注射1周,构建大鼠心肌纤维化模型;正常组(30只)腹腔注射同等剂量0.9%生理盐水1周作为对照。于实验末2 d开始禁食、禁水12 h后,大鼠称重,处死大鼠,并取5 mm3心脏标本进行石蜡包埋,再将蜡块连续切片10张,HE和Masson染色法检测其病理学改变;qRT-PCR检测各组miR-200b表达;Western blot法测定α-SMA、Col1A1、DNMT3A的表达量。
1.2.2SD乳鼠原代CFs的分离与培养 取出生6~7 d的新生乳鼠,烧杯装载入超净台,另备75%乙醇。先用高压蒸汽灭菌的镊子以颈部脱臼法处死乳鼠,后在乙醇中浸泡1 min左右。用碘伏消毒胸腹部,无菌眼科剪先横后纵呈倒T字型剪开胸腔,取心尖部位,并快速置于含双抗预冷的PBS溶液润洗3~5次。剔除周围多余结缔及脂肪组织,将心脏放置于无菌平皿上,剪成约1 mm3大小,向皿中加入少许胰酶,在37℃培养箱中消化,共消化6~8次,每次约5 min。每次消化后取上清液,并加入等量的含10%胎牛血清的DMEM培养基,缓缓混匀,以终止胰酶消化。用200目细胞筛过滤含细胞的混合液,最后将过滤后的细胞悬液150×g离心5 min。离心后收集沉淀,加入适量PBS再次重复离心3次。用上述CFs培养基将细胞沉淀重悬,接种于细胞培养瓶中培养。培养约90 min后,将未贴壁的细胞悬液吸弃,此时已经贴壁的是CFs,通过倒置显微镜观察加以确认。加5 mL培养基,放入培养箱,继续培养至细胞融合至80%~85%时传代,连续传至4代后的细胞用于后续实验。
1.2.3瞬时转染miR-200b促进剂、抑制剂 培养原代CFs至对数生长期,加入胰酶消化并吹匀细胞悬液。然后,按每孔2 mL把细胞接种至6孔板内并分组。放入37.5℃、5% CO2细胞培养箱中,继续培养至细胞融合度达到70%~80%用于转染。吸取10 μL的miR-200b促进剂及抑制剂分别缓缓注入已加有10 μL LipofectamineTM2000的Opti-MEM(1 mL)中,用移液枪上下吹匀多次,室温下静置30 min,形成microRNA和Lipofectamine复合物。将6孔板取出,吸弃原培养基,用PBS清洗细胞2次,再将复合物混合液注入事先已分组的6孔板中。然后把6孔板放进细胞培养箱中,2 h后倒掉混合液,加入含双抗的DMEM培养基,继续培养24~96 h后,用于进一步实验。
1.2.4转染细胞RNA的提取和qRT-PCR检测CFs中miR-200b的表达 取出转染48 h后含CFs的6孔板,按TRIzol法提取细胞RNA,紫外分光光度法检测细胞RNA的浓度和纯度,选用反映RNA纯度的A260/A280数值为1.8~2.0的样品用于实验。采用GenePharma HairpinitTMmicroRNA RT-PCR Quantitation Kit v1406试剂盒,并参考使用说明书检测miR-200b。先将样品RNA逆转录成cDNA。反应条件如下:25℃、30 min,42℃、30 min,85℃、5 min。然后按试剂盒说明书加样,通过qRT-PCR检测不同转染组中miR-200b表达。反应条件:95℃、10 min为预变性阶段;95℃、12 s,62℃、40 s,并循环40次为扩增阶段;95℃、15 s,60℃、1 min,95℃、15 s为熔解曲线阶段。以U6作为内参,2-ΔΔCT法计算miR-200b的相对表达量以验证转染是否成功。
1.2.5qRT-PCR检测Col1A1、α-SMA、DNMT3A 取出转染48 h后含CFs的6孔板,按TRIzol法提取细胞RNA,方法同“1.2.4”。按TaKaRa试剂盒说明书,将样品RNA逆转录成cDNA,再通过qRT-PCR检测3种目的基因。反应条件:50℃、2 min,95℃、10 min为预变性阶段;95℃、20 s,60℃、30 s,72℃、30 s,共40个循环为扩增阶段;95℃、15 s,60℃、1 min,95℃、15 s为熔解曲线阶段。以β-actin作为内参,2-ΔΔCT法计算mRNA的相对表达量。引物序列见Tab 1。

Tab 1 Primer sequence
1.2.6Western blot法检测转染细胞中目的蛋白表达 取出转染48 h后含CFs的6孔板,用蛋白裂解液提取转染后CFs的总蛋白,检测蛋白浓度,分组标记,加入样品缓冲液99℃加热2 min。凝胶上样,每孔加入20~40 μg蛋白。电泳,转膜,用5%牛奶封闭膜2 h,TBST洗涤6 min×4次,加入稀释的Col1A1、α-SMA和 DNMT3A 一抗,4℃孵育过夜,TBST漂洗4次,加入相应二抗37℃摇床孵育1~3 h,再用TBST漂洗4次,而后采用ECL法,以β-actin为内参检测目的蛋白的相对表达量。
1.2.7MTT比色法检测CFs的增殖 取不同转染的细胞,计数调整细胞浓度至1×108·L-1,分别接种在96孔板中,每孔100 μL,设5个复孔。96孔板放入细胞培养箱中分别培养24、48、72、96 h,不同时间点的96孔板分别取出,每孔加入10 μL 5 g·L-1的MTT溶液,继续培养4~6 h后终止。小心吸弃孔中培养液,加入150 μL DMSO,摇床上低速振荡10 min,使结晶产物溶解充分后,使用酶联免疫检测仪检测490 nm处各孔的吸光度值。

2 结果
2.1ISO皮下注射导致SD大鼠心肌纤维化心脏样本的病理学改变Fig 1心脏组织的HE和Masson染色结果显示,与正常组比较,ISO组SD大鼠HE染色片中心肌细胞间质增加,且排列紊乱,心肌细胞呈现肥大状态,并能发现成纤维细胞有所增生,Masson染色可见心肌组织间胶原纤维增多。

Fig 1 HE and Masson staining
2.2SD大鼠心脏样本中miR-200b表达的变化Fig 2的qRT-PCR结果显示,相较于正常组,ISO组心脏标本提取的总RNA中miRNA-200b表达水平明显下降,差异有统计学意义(P<0.05)。

Fig 2 Level of miR-200b in SD rat myocardium by
*P<0.05vsNC group
2.3ISO组和对照组SD大鼠心脏样本中α-SMA、Col1A1、DNMT3A表达变化Fig 3的Western blot结果显示,ISO组中α-SMA、Col1A1、DNMT3A蛋白表达水平相较于正常组明显升高(P<0.05)。

Fig 3 Expression of α-SMA, Col1A1 and DNMT3A in SD rat myocardium by Western blot n=6)
*P<0.05vsNC group
2.4瞬时转染miR-200b抑制剂和促进剂对miR-200b表达的影响瞬时转染CFs miR-200b抑制剂、促进剂及其空白对照组48 h后,Fig 4的qRT-PCR结果显示,转染miR-200b促进剂组中,CFs中miR-200b表达量明显升高(P<0.01),miR-200b抑制剂组中miR-200b表达量减少(P<0.01),表明转染成功。

Fig 4 Change of miR-200b in CFs 48 h
1: Negative group; 2: Blank group; 3: miR-200b mimics group; 4: miR-200b inhibitors group.**P<0.01vsblank group;##P<0.01vsnegative group.
2.5miR-200b对CFs中Col1A1、α-SMA、DNMT3AmRNA表达的影响瞬时转染48 h后,Fig 5的qRT-PCR结果显示,miR-200b促进剂实验组中Col1A1、α-SMA和 DNMT3A的表达下降(P<0.01);而miR-200b抑制剂组中Col1A1、α-SMA和 DNMT3A的表达上升(P<0.01)。

Fig 5 Alteration of gene expression in CFs 48 h
1: Negative group; 2: Blank group; 3: miR-200b mimics group; 4: miR-200b inhibitors group.**P<0.01vsblank group;##P<0.01vsnegative group.
2.6miR-200b对CFs中Col1A1、α-SMA和DNMT3A蛋白表达的影响Fig 6结果显示,miR-200b抑制剂转染之后,DNMT3A、α-SMA和Col1A1蛋白表达均较阴性对照组和空白对照组明显升高(P<0.01)。而促进剂组中DNMT3A、α-SMA和Col1A1蛋白表达量均较阴性对照组和空白对照组明显降低(P<0.05)。
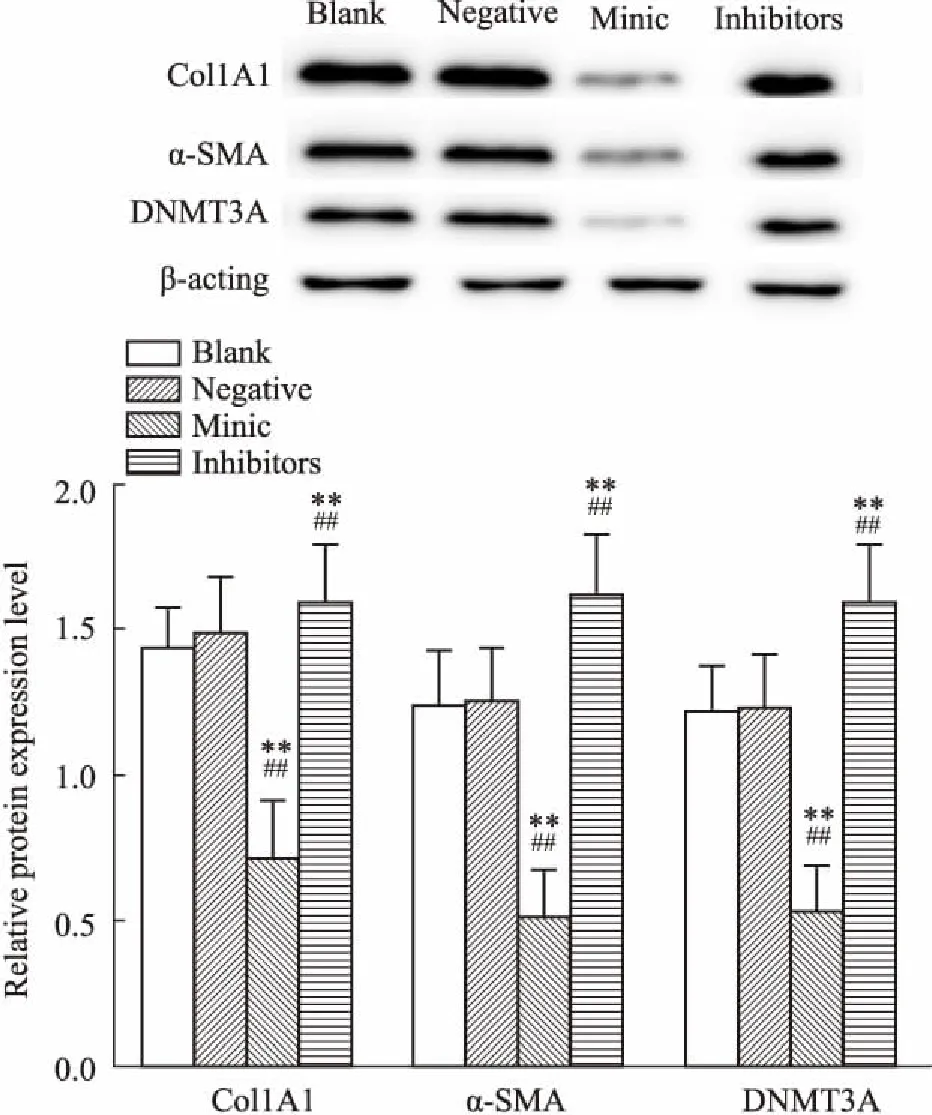
Fig 6 Levels of Col1A1, α-SMA and DNMT3A in transfected CFs by Western blot n=6)
**P<0.01vsblank group;##P<0.01vsnegative group
2.7miR-200b对CFs增殖的影响如Fig 7所示,在转染CFs 24、48、72、96 h后,与阴性对照组和空白对照组比较,miR-200b促进剂组的CFs增殖水平明显降低(P<0.01),而miR-200b抑制剂组中CFs增殖水平明显上升(P<0.01)。

Fig 7 Change of proliferation of CFs 24, 48, 72, 96 h after transfection in all groups n=6)
1: Negative group; 2: Blank group; 3: miR-200b mimics group; 4: miR-200b inhibitors group.**P<0.01vsblank group;##P<0.01vsnegative group.
3 讨论
心肌纤维化是指正常的心脏心肌组织结构中出现了以CFs增殖、细胞外基质沉积过量为主要病理表现的疾病。目前研究表明,心肌纤维化与心律失常(如房颤)、心功能不全、心肌肥厚等疾病有关[8-9]。近年有研究显示,DNA片段的甲基化是可以促进纤维细胞分化为成纤维细胞和胶原沉积[10-11]。而之前另有研究显示,DNMT3A作为DNA片段的甲基化催化酶家族中的重要一员,其表达程度的激活与抑制,对心肌纤维化发挥着关键作用[5-6]。
近年来,大量研究报道miR-200b参与多种疾病发生、发展过程[12-13],但关于miR-200b在心肌纤维化中的研究却并不多见。有研究表明,同样作为miR-200家族中的一员miR-141可参与影响心肌纤维化的发生、发展[14]。因此,本课题进一步研究 DNMT3A与miR-200b在心肌纤维化发生发展中的分子机制。
本实验分别通过建立心肌纤维化动物模型,以及向CFS转染miR-200b的促进剂和抑制剂来证实之前提出的假设。在体实验结果表明,与对照组比较,模型组HE和Masson染色心肌组织呈现明显的胶原沉积; qRT-PCR显示;模型组相对于对照组miR-200b表达水平降低,Western blot检测表明,模型组α-SMA、Col1A1、DNMT3A的水平明显高于对照组。体外实验结果表明,与正常对照组和阴性对照组比较,促进剂组DNMT3A、Col1A1、α-SMA mRNA表达下降,而在抑制剂组上升;Western blot结果显示,促进剂组中DNMT3A、Col1A1、α-SMA蛋白表达降低,而在抑制剂组表达上升;MTT结果表明,miR-200b可抑制CFs生长。故本课题组推测心肌纤维化的产生可能与miR-200b对 DNMT3A调控有关。
综上所述,miR-200b可能是通过抑制DNMT3A,对CFs甲基化产生影响,控制CFS的活化,降低心肌纤维化水平。而DNMT3A可能是心肌纤维化的表观遗传学治疗靶点之一,同时也为预防和研究心肌纤维化产生提供新的思路。
