姜黄素通过Wnt2/β-catenin通路逆转食管癌Eca-109/VCR细胞多药耐药性研究
2018-10-11任海玉孙剑经牛树荣张林西
任海玉,孙剑经,李 多,牛树荣,刘 华,罗 强,张林西
(河北北方学院1. 研究生学院、2. 附属第一医院消化内科、3. 生命科学研究中心,河北 张家口 075000)
我国食管癌患者就医时多处于疾病的中晚期,患者的总体5年生存率<20%[1]。化疗是中晚期食管癌的主要有效治疗措施之一。临床研究发现,在化疗过程中,部分患者会对化疗药物产生多药耐药性(multi-drug resistance,MDR),MDR严重影响了临床治疗效果和患者预后[2]。因此,寻找安全有效的MDR逆转药物,并探讨其作用机制具有重要的临床意义。
姜黄素(curcumin,Cur)是一种植物多酚,主要来源于姜黄属植物的根茎中,是中药姜黄的主要活性成分。实验表明,Cur对肺癌、卵巢癌等多种肿瘤MDR具有逆转作用[3-4]。但Cur逆转MDR的作用机制仍不清楚。Wnt/β-catenin信号通路与肿瘤的发生、增殖、侵袭、转移及预后不良有关,其中Wnt2尤其与消化道肿瘤密切相关,但Wnt2/β-catenin信号通路与食管癌MDR逆转作用是否有关鲜有报道。本研究拟以耐长春新碱(vincristine,VCR)的食管癌Eca-109/VCR细胞株为研究对象,采用qPCR、Western blot、流式细胞术等方法,探讨Cur对食管癌MDR的逆转作用及其可能的机制。
1 材料与方法
1.1材料
1.1.1细胞株 人食管癌耐药细胞株(Eca-109/VCR)购自南京凯基生物科技发展有限公司。
1.1.2试剂 Cur购自美国Cayman公司;VCR、RPMI 1640不完全培养液,购自南京凯基生物科技发展有限公司;胎牛血清购自美国Gibco公司;Annexin Ⅴ-FITC/PI双染试剂盒购自美国BD公司;P-gp ELISA试剂盒购自武汉基因美科技有限公司;总RNA提取及反转录试剂盒、实时荧光定量PCR试剂盒,购自天根生化科技(北京)有限公司;引物由宝生物工程(大连)有限公司合成;CCK-8试剂盒、化学发光试剂、细胞裂解液,均购自上海碧云天生物技术有限公司;兔抗人Wnt2、β-catenin、基质金属蛋白酶2(matrix metalloprotein 2,MMP-2 )、高迁移率族蛋白B1(high mobility group protein B1,HMGB1)的多克隆抗体,购自北京博奥森生物技术有限公司。
1.1.3仪器 BB16HF二氧化碳培养箱(美国Thermo公司);Stat Fax-210全自动酶联免疫酶标仪(美国Awareness公司);FACS AriaⅡ流式细胞仪(美国 BD 公司);ABI PRISM 7300型实时荧光定量PCR仪(美国ABI公司);Amersham Imager 600超灵敏多功能成像仪(美国GE公司)。
1.2方法
1.2.1细胞培养 Eca-109/VCR细胞使用含10%胎牛血清的培养液,并将细胞置于37℃、5% CO2饱和湿度的培养箱中培养,每天更换培养液,每2~3 d传代1次。培养液中加入2.0 mg·L-1VCR维持细胞耐药性,实验前撤药培养1周,并选取对数生长期细胞进行后续实验。实验设对照组、Cur单药组(Cur组)、VCR单药组(VCR组)、Cur与VCR联合用药组(Cur+VCR组)。
1.2.2Cur对Eca-109/VCR的增殖抑制率检测 取对数生长期的Eca-109/VCR细胞制成单细胞细胞悬液,并将浓度调整为1×108·L-1,接种于96孔板,每孔200 μL,贴壁培养24 h后,分别加入终浓度为10、20、40、80、160 μmol·L-1的Cur,阴性对照组加入含0 μmol·L-1Cur的培养液,空白对照组为不含细胞和药物的培养液,每个浓度均设3个复孔,培养24 h。向每孔加入20 μL CCK-8液后,继续培养4 h,通过全自动酶联免疫酶标仪检测波长为490 nm处的吸光度(A)值,各组分别取平均值,计算细胞生长抑制率:抑制率=[1-(处理组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)]×100%。选取抑制率<10%的Cur最大浓度(20 μmol·L-1)作为逆转剂量,用于后续实验。
1.2.3Cur对Eca-109/VCR细胞的逆转效应检测 将对数生长期的Eca-109/VCR细胞制备成浓度为5×107·L-1的细胞悬液,每孔200 μL,接种于96孔板,培养24 h,贴壁后弃掉旧培养液。阴性对照组加入不含药物的培养液,空白对照组为不含细胞和药物的阴性培养液。VCR单药组分别加入终浓度为1.0、2.0、4.0、8.0 mg·L-1的VCR,Cur + VCR组分别加入20 μmol·L-1Cur与1.0、2.0、4.0、8.0 mg·L-1的VCR,每组设3个复孔,继续培养24 h后,每孔加入CCK-8液20 μL,继续培养4 h,然后用酶标仪测定490 nm处的吸光度(A)值。计算细胞抑制率:抑制率/%=[1-(处理组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)]×100%。计算半数抑制浓度(IC50)及逆转倍数(reversal fold,RF):RF=耐药细胞IC50/逆转细胞IC50。
1.2.4流式细胞术检测细胞凋亡 将对数生长期的Eca-109/VCR细胞制成浓度为1×108·L-1的细胞悬液,并接种于4个50 mL的培养瓶中,使用不含胎牛血清的培养液培养12 h,待细胞贴壁后加药,Cur组加入20 μmol·L-1Cur,VCR组加入2.0 mg·L-1VCR,Cur + VCR组加入20 μmol·L-1Cur与2.0 mg·L-1VCR。作用24 h后,消化离心,收集细胞,按照Annexin Ⅴ-FITC/PI 细胞凋亡检测试剂盒说明书的操作流程处理细胞,并在1 h内使用流式细胞仪分析细胞的凋亡百分率。
1.2.5ELISA检测P-gp蛋白表达 将对数生长期的Eca-109/VCR细胞制成单细胞悬液,并调整其浓度为1×108·L-1,接种于细胞培养瓶贴壁培养。待细胞贴壁生长后,分别用20 μmol·L-1Cur、2.0 mg·L-1VCR单独或联合作用24 h。24 h后收集细胞,用PBS稀释细胞悬液,使细胞浓度达到1×109·L-1左右,反复冻融,使细胞破坏并释放出细胞内成分。2 000~3 000 r·min-1离心20 min,收集上清。按照ELISA试剂盒说明书的操作步骤,制作标准曲线并测定P-gp的含量。
1.2.6qPCR检测Wnt2、β-catenin mRNA的表达 取对数生长期的Eca-109/VCR细胞。实验组分别加入20 μmol·L-1Cur、2.0 mg·L-1VCR、20 μmol·L-1Cur联合2.0 mg·L-1VCR,对照组加入不含任何药物的培养液,作用24 h后,分别收集各组细胞,提取总RNA,重复3次,选取A260 nm/A280 nm比值在1.8~2.0的RNA标本,按照FastQuant cDNA第一链合成试剂盒提供的操作步骤进行反转录,合成cDNA。以此cDNA为模板,采用SYBR GreenⅠ两步法进行PCR扩增,并检测Wnt2、β-catenin mRNA的表达水平,以β-actin为内参照。Wnt2上游引物序列为5’-GCCGAGTGGACAGCAGAATG-3’,下游引物序列为5’-AAACAAAGGCAGATTCCCGACTA-3’,扩增产物片段为127 bp;β-catenin上游引物序列为5’-GAATGTCTGAGGACAAGCCACAAG-3’,下游引物序列为5’-TGGGCACCAATATCAAGTCCAA-3’,扩增产物片段为127 bp;β-actin上游引物序列为5’-TGGCACCCGCACAATGAA-3’,下游引物序列为5’-CTAAGTCATAGTCCGCCTAGAAGCA-3’,扩增产物片段为186 bp。采集、分析各组Wnt2、β-catenin mRNA的相对表达量,以2-ΔΔCt值表示。设对照组的相对表达量为100%,分别计算各实验组Wnt2、β-catenin mRNA的相对表达率。
1.2.7Western blot检测Wnt2、β-catenin、MMP-2、HMGB1蛋白的表达 取对数生长期的Eca-109/VCR细胞,接种于细胞培养瓶中,贴壁培养。实验组分别加入20 μmol·L-1Cur、2.0 mg·L-1VCR、20 μmol·L-1Cur联合2.0 mg·L-1VCR。作用24 h后,提取各组Eca-109/VCR细胞总蛋白,各组取等量蛋白提取液,分别加入聚丙烯酰胺凝胶中进行电泳分离,湿法转膜至PVDF膜上,用质量浓度为50 g·L-1的脱脂奶粉封闭1 h后,加入抗Wnt2、β-catenin、MMP-2、HMGB1(1 ∶500)一抗,4℃孵育过夜,洗膜后,加入相应二抗(1 ∶10 000)室温反应2 h,再次洗膜,加入ECL化学发光液,使用Amersham Imager 600超灵敏多功能成像仪检测蛋白条带,实验以β-actin校正作相对量分析,实验重复3次,取平均值。

2 结果
2.1Cur对Eca-109/VCR细胞增殖抑制率的影响如Fig 1所示,Cur(10、20、40、80、160 μmol·L-1)作用于Eca-109/VCR细胞24 h后,细胞增殖抑制率随着Cur的浓度增加而明显升高,呈剂量依赖性,且当Cur≤20 μmol·L-1时,细胞增殖抑制率均小于10%,故选取对食管癌细胞株Eca-109/VCR抑制率<10%的最大姜黄素浓度,即20 μmol·L-1的Cur,作为逆转剂量用于后续实验。
2.2Cur、VCR单药或联合作用对Eca-109/VCR细胞耐药性的逆转作用如 Fig 2所示,不同浓度VCR单药或与Cur(20 μmol·L-1)联合作用24 h后,各Cur+VCR组对Eca-109/VCR细胞的增殖抑制率较相应VCR组明显升高(P<0.01),说明20 μmol·L-1Cur能明显增加不同浓度VCR对Eca-109/VCR的抑制作用,且浓度为20 μmol·L-1Cur与2.0 mg·L-1VCR联合作用后,对细胞的抑制作用增加幅度最大,达40.39%。此外,VCR组与Cur+VCR组的IC50分别为5.13、1.47 mg·L-1,逆转倍数为3.49。

Fig 1 The inhibitory rate of Eca-109/VCRcell line treated with curcumin for 24
*P<0.05vs0 μmol·L-1

Fig 2 The reversal effect of curcuminon Eca-109/VCR cell
**P<0.01vsthe same concentration of VCR
2.3Cur、VCR单药或联合作用对细胞凋亡率的影响如Fig 3所示,Cur(20 μmol·L-1)和VCR(2.0 mg·L-1)单药或联合作用24 h后,对照组、Cur组和VCR组的细胞凋亡率分别为(1.37±0.30) % 、(8.50±0.84)%、(9.87±0.89)%,而Cur+VCR组的细胞凋亡率为 (18.46 ± 2.38)%,可见联合组的细胞凋亡率明显高于两单药组及对照组(P<0.05)。
2.4Cur、VCR单药或联合作用对P-gp蛋白表达的影响如Fig 4所示,Cur+VCR组的P-gp蛋白含量明显低于VCR组及对照组,差异有统计学意义(P<0.05)。
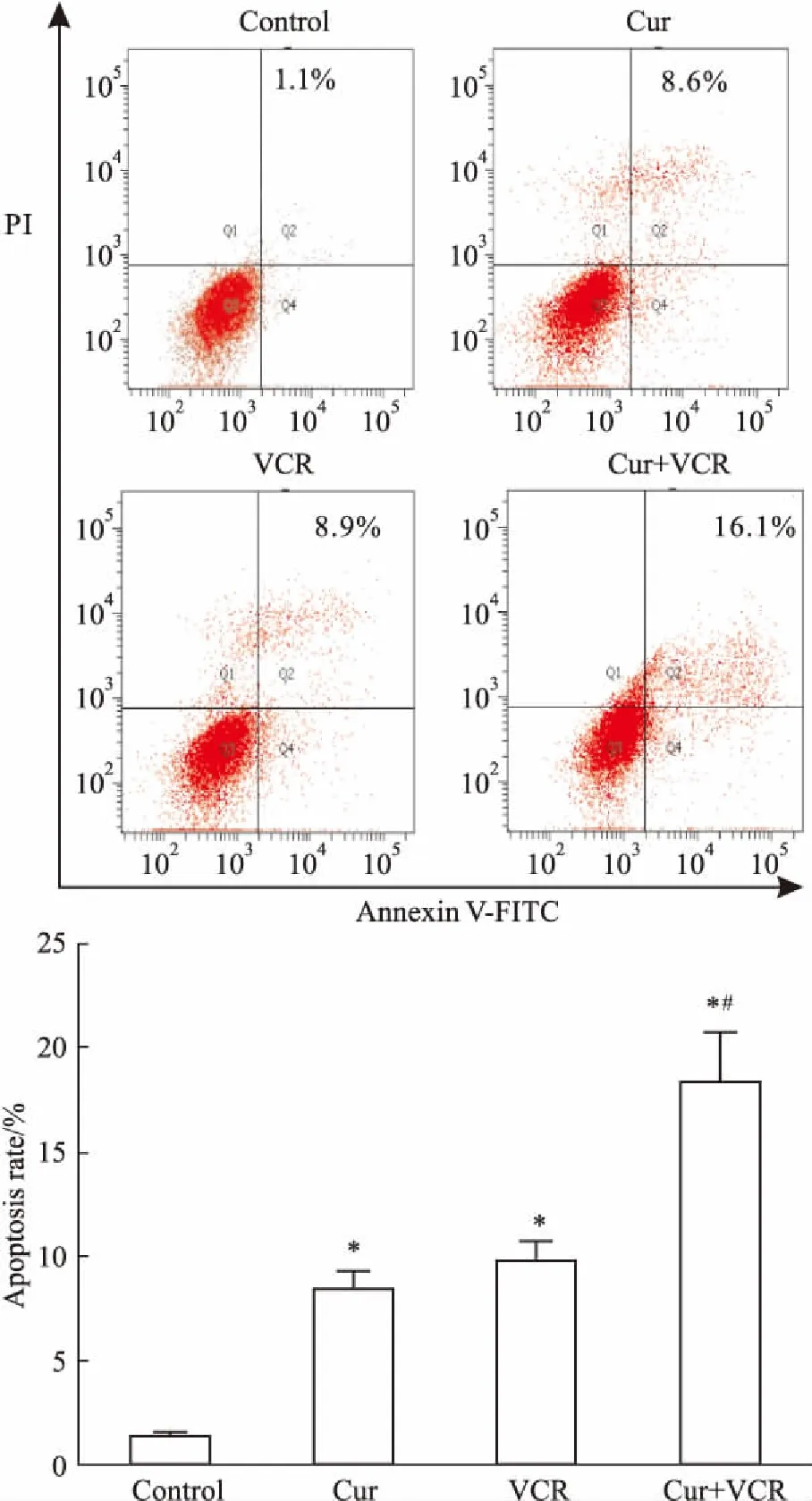
Fig 3 The apoptosis rate of Eca-109/VCR cell line treatedby single Cur,VCR or their combination for 24
*P<0.05vscontrol;#P<0.05vsthe same concentration of VCR

Fig 4 Effects on protein expression of P-gp in Eca-109/VCRcells treated with Cur and VCR aloneor their combination for 24
*P<0.05vscontrol;#P<0.05vsthe same concentration of VCR
2.5Cur、VCR单药或联合作用对Wnt2、β-cateninmRNA表达的影响如Fig 5所示,与对照组相比,各用药组Wnt2、β-catenin mRNA的表达均降低(P<0.05),且Cur+VCR组Wnt2、β-catenin mRNA的表达均较VCR组明显降低(P<0.05)。
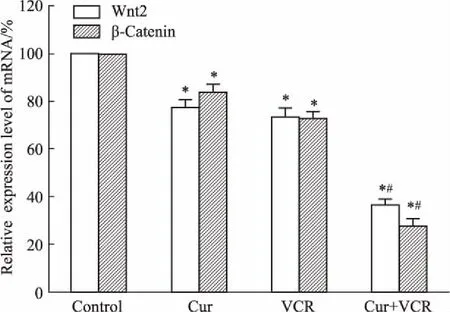
Fig 5 The relative expression level of Wnt2 and β-cateninmRNA in Eca-109/VCR cells treated with Cur andVCR alone or their combination for 24
*P<0.05vscontrol;#P<0.05vsthe same concentration of VCR
2.6Cur、VCR单药或联合作用对Wnt2、β-catenin、MMP-2、HMGB1蛋白表达的影响如Fig 6所示,Cur(20 μmol·L-1)和VCR(2.0 mg·L-1)单药或联合作用24 h后,与对照组相比,除Cur组Wnt2蛋白表达差异无统计学意义外,其余各用药组Wnt2、β-catenin、MMP-2、HMGB1蛋白表达均降低(P<0.05),且Cur+VCR组Wnt2、β-catenin、MMP-2、HMGB1蛋白的表达均较VCR单药组明显降低(P<0.01)。
3 讨论
我国食管癌具有高发病率、高死亡率、预后较差等特点。在临床食管癌化疗过程中产生的多药耐药现象,严重地影响了中晚期食管癌患者的治疗效果[5]。肿瘤多药耐药形成的机制比较复杂,包括转运蛋白介导的多药耐药、酶系统介导的多药耐药、凋亡基因介导的多药耐药等。90%以上肿瘤患者的死亡原因都与不同程度的化疗耐药密切相关。因此,寻找高效、低毒副作用的多药耐药逆转药物,并探讨其可能的逆转机制已成为近年来的研究热点。
Cur是姜黄中的一种天然、低毒、价廉的酚类色素,研究表明,其可通过不同途径逆转肿瘤的耐药性[6-7]。本研究发现,Cur对食管癌耐长春新碱Eca-109/VCR细胞具有明显的生长抑制作用,其细胞增殖抑制率随着Cur浓度增加而明显升高,且小剂量Cur(20 μmol·L-1)与VCR(2.0 mg·L-1)联合作用24 h后,对Eca-109/VCR细胞MDR的逆转倍数为3.49。此外,Cur与VCR联合作用24 h,P-gp蛋白的表达较VCR组明显降低,细胞凋亡率较VCR组明显升高。结果提示,小剂量Cur可能通过下调P-gp的表达,逆转Eca-109/VCR细胞的耐药性,提高其对VCR的敏感性。
*P<0.05vscontrol;##P<0.01vsthe same concentration of VCR
Wnt2基因是Wnt家族成员之一。Wnt信号通路与多种肿瘤的发生、发展及多药耐药性密切相关[8-11]。Wnt2 mRNA在人胎肺、胎肾及胎盘中均有表达,但在正常成人的胃肠道没有表达。Wnt2通常激活经典的Wnt/β-catenin信号通路,Wnt2存在时,与卷曲蛋白1(FZD1)结合后,使得由 Axin、GSK-3β、APC组成的分解复合体解聚,影响β-catenin的正常降解,导致其在胞质中不断积累,最终进入胞核,激活Wnt/β-catenin信号通路。Wnt/β-catenin信号通路的下游靶基因分为间接靶基因与直接靶基因。后者因启动子区大多含有DNA顺式作用元件5′-A/TA/TCAAAG-3′,可与β-catenin/TCF复合体结合并进行基因转录,而MDR1就是一个直接靶基因。通过降低Wnt/β-catenin信号通路活性后,可下调MDR1/P-gp的表达,逆转乳腺癌耐药细胞的多药耐药性[12]。本研究发现,小剂量Cur与VCR联合作用后,在基因水平及蛋白水平均可明显下调Wnt2与β-catenin的表达,同时,P-gp的表达也明显降低,提示小剂量Cur可以通过下调Wnt2与β-catenin基因及蛋白的表达,降低Wnt/β-catenin信号通路活性,进而逆转Eca-109/VCR细胞的多药耐药性。
MMP-2是一种明胶酶,属于金属基质蛋白酶家族,主要降解明胶及Ⅳ型胶原。研究表明[13],MMP-2与食管癌侵袭和转移有关。HMGB1是高迁移率族蛋白(high mobility group box chromosomal protein,HMG)家族的重要成员,参与调节DNA复制、转录、重组、修复等多种功能,可通过介导细胞因子及趋化因子的表达,促进恶性肿瘤的发生发展[14-15]。目前,MMP-2、HMGB1基因表达与食管癌MDR是否相关少见报道。本研究中,小剂量Cur联合VCR作用于Eca-109/VCR细胞24 h后,可明显下调MMP-2、HMGB1蛋白表达水平。提示小剂量Cur增强Eca-109/VCR细胞对化疗药的敏感性,逆转MDR的作用,还可能与下调MMP-2、HMGB1有关。
综上所述,Cur能够逆转Eca-109/VCR细胞的多药耐药性,其机制可能是通过下调Wnt2和β-catenin基因的表达,抑制Wnt2/β-catenin信号通路活性,以及降低MMP-2、HMGB1蛋白的表达实现的。Cur可能是一种能够提高癌细胞对化疗药的敏感性,并逆转其耐药性的较好的辅助化疗药物,有望解决化疗过程中肿瘤细胞耐药的难题。
(致谢:本实验在河北北方学院生命科学研究中心完成,感谢孙黎、兰金苹、张晓丽老师给予实验的指导和帮助!)
