8例结节性硬化症伴肾错构瘤病例报告并文献复习
2018-10-10李开令李冬梅白进良
李开令 李冬梅 白进良
结节性硬化症(tuberous sclerosis complex,TSC),又称Bourneville病,是一种极少见的常染色体显性遗传病。新生儿发病率为1/10 000~1/6 000,成人发病率约为 1/8 000,无明显性别差异[1]。TSC典型的发病过程为正常组织中的良性病变生长,常累及多个器官,导致肾、脑、皮肤、心脏、肝脏及肺等的损害。肾损害主要以肾错构瘤(renal angiomyolipomas, RAML)最为常见,80%左右的TSC患者会表现出RAML[2],即TSC-RAML。本文回顾分析了2014年1月至2017年6月兰州大学第一医院泌尿外科收治的8例TSC-RAML患者的临床资料,同时结合文献对TSC-RAML的发病机理及诊疗进展进行了复习。
对象与方法
一、一般资料
患者共8例,男3例,女5例,年龄18~44岁。8例中4例患者因腰部疼痛不适就诊,2例因体检发现肾脏占位就诊,1例因左RAML切除术后右肾复发就诊,1例患者因肿瘤破裂出血腹痛急诊。8例患者均有累及肾脏病变(6例合并双肾多发AML,其中1例同时合并肝AML;另外2例只累及单肾),均有部分指(趾)甲纤维瘤,6例患者有面部丘疹状暗红色血管纤维瘤,4例有癫痫病史,2例患者合并双肺肺气肿伴肺大泡、气胸、胸腔积液,1例合并心脏室间隔脂肪瘤。8例患者智力均正常,无明确的家族遗传史,均满足2012年国际TSC会议制定的诊断标准。
二、影像学检查
8例患者均行腹部超声及增强CT检查。超声检查:病变肾脏体积增大,实质性占位,表现为大小不等强回声光团,内部回声欠均匀,边界尚清楚;部分肿瘤因继发出血或坏死,肿瘤内成分比例不同而导致图像呈现出混杂回声,边界也不甚清楚。CT:肾实质见多个大小不等的实质性占位,内见脂质密度影,不均匀强化,肿瘤直径6.0~25.0 cm(4例双RAML瘤体的最大直径分别为8.1、7.5、10.2和16.0 cm;1例妊娠女性肿瘤直径为6.5 cm;1例孤肾患者RAML直径为7.2 cm;另2例RAML最大直径分别为6.2、7.8 cm)。1例患者可见双RAML破裂并右肾区血肿形成(血肿最大直径16.0 cm),并见肝内多个大小不等的类圆形低密度影,内含脂肪密度,较大者位于肝S8,大小约2.0 cm×1.4 cm(图1)。1例患者胸部CT双肺见多发结节状、团片状高密度影;双肺弥漫囊状透亮影、气胸及渗出性改变(图2)。1例发现心脏室间隔存在脂肪瘤(图3),但患者心脏功能及肺功能正常。有5例患者行头颅CT或MRI,均发现侧脑室室管膜下多发结节影,考虑结节性硬化(图4)。
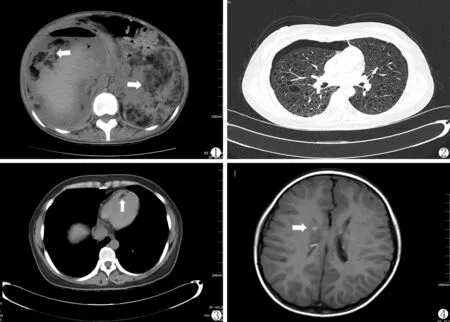
图1 肝多发AML并RAML破裂
图2 双肺肺气肿伴肺大泡形成并右侧气胸
图3 心脏室间隔脂肪瘤
图4 双侧侧脑室室管膜下多发结节影
结 果
因腰部疼痛不适就诊的4例患者中3例为双RAML(2例行双肾肿瘤剜除术;1例因右肾肿瘤直径大且存在假性动脉瘤,行右肾切除+左肾肿瘤剜除术);另1例为妊娠2个月的女性患者,与患者及家属沟通后终止妊娠,密切观察患者病情变化情况。2例体检发现肾脏占位就诊的患者,均行肾部分切除术。1例因双RAML破裂并失血性贫血就诊的患者,实验室检查:红细胞2.36×1012/L,血红蛋白74 g/L,急诊予以补液、止血和输血等支持治疗。1例患者因误诊为单纯RAML行单侧肾切除术3年后复发而就诊,评估肾功能正常后给予依维莫司药物治疗。
随访2~44个月,5例行手术治疗的患者均出现不同程度的肿瘤复发及残存肿瘤体积增大;1例双RAML破裂出血的患者再次出现肿瘤增大破裂出血,后保守治疗无效而死亡;1例妊娠女性已终止妊娠,肿瘤直径由6.5 cm增长到7.0 cm左右,肾功能正常;1例孤肾复发的患者给予依维莫司药物治疗后,肿瘤未见明显增大。
讨 论
一、TSC的发病机制
TSC一般是常染色体显性遗传病,但其中约70%的患者是因散发性基因突变而发病。TSC1或TSC2基因功能缺失突变是导致TSC的根本原因。TSC1基因位于染色体9q34.3,由23个外显子组成,其中第1、2外显子为非编码区,第3~23外显子为编码区,总长度为50 kb,编码相对分子质量为130 000,由1 164个氨基酸组成的AML蛋白(hamartin)[3]。TSC2位于16p13.3, 由41个编码外显子和1个非编码先导外显子组成,总长度为45 kb,编码相对分子质量约为198 000,由1 807个氨基酸组成的马铃薯球蛋白(tuberin)[4]。这两种蛋白可以在细胞质中构成TSC1-TSC2复合物,TSC1和TSC2以及各自的蛋白产物(TSC1、TSC2或hamartin和tuberin)是哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)信号通路的关键调节因子。mTORC1信号通路是调控细胞生长、代谢及细胞自噬的关键信号通路。正常情况下,TSC1和TSC2一起构成的二聚体复合物TSC1/TSC2,是小GTP酶Rheb(Ras homolog enriched in brain)的抑制剂,而Rheb是mTOR活化所必需的激活蛋白,因此TSC1/TSC2在正常情况下抑制mTOR的功能。mTOR是一种丝/苏氨酸蛋白激酶,在细胞生长、增殖、分化及细胞周期调控等多个方面起重要作用。如TSC1或TSC2发生基因突变而失活,致使TSC1/TSC2复合物无法形成,进而解除了对Rheb的抑制作用,使得mTOR被激活[5],从而导致蛋白质合成加快和细胞异常增殖而出现AML。
二、TSC的诊断
2012年国际TSC共识会议更新和完善了1998年制定的TSC诊断标准,但仍然将标志性的临床表现作为诊断TSC的主要依据。另外,随着基因检测技术的不断完善和发展,目前基因检测技术已成为诊断TSC的金标准[6]。
1.基因诊断:基因检测如果发现TSC1或TSC2基因的致病性突变即可确诊TSC。致病性突变是指可以明确影响TSC1或TSC2蛋白表达的突变或某些不影响TSC1或TSC2蛋白表达,但已经确认可以导致TSC的突变(如某些错义突变)。应用目前的分子诊断方法最高约能在90%的TSC患者中发现TSC1或TSC2突变,TSC2 的突变较 TSC1的突变更为常见,突变率约为3∶1[6]。临床工作中约有 10%~25%的 TSC 患者并不存在相关基因的致病突变,故基因检测结果正常并不能排除TSC诊断。近年来,基因检测技术日益成熟完善,TSC基因检测的灵敏性与特异性进一步提高。本文8例患者根据临床症状均可确诊,因此并未进一步行基因检测。
2.临床诊断:TSC的临床诊断标准:具有2个主要特征或1个主要特征和2个次要特征者即可确诊;具备1个主要特征或 2个(或以上)次要特征者为疑似患者。诊断的临床特征[7],主要临床特征有:①脱色斑(数目>3个,直径至少为5 mm);②指甲纤维瘤;③血管纤维瘤(数目>3个)或纤维头静脉斑;④多发视网膜AML;⑤鲨鱼斑;⑥室管膜下结节;⑦皮质结节;⑧肺淋巴血管肌瘤病;⑨心脏横纹肌瘤;⑩室管膜巨细胞星形细胞瘤;血管肌瘤(>2个)。次要临床特征包括:①皮损;②口内纤维瘤(≥2);③牙齿釉质凹陷(>3);④多发肾囊肿;⑤视网膜无色性斑块;⑥非RAML。
3.TSC-RAML的诊断:TSC累及肾脏可引起的病理改变主要包括RAML、嗜酸性粒细胞腺瘤、肾细胞癌和多囊肾等。其中以RAML最为常见,约80%的TSC患者会出现RAML,即TSC-RAML。早期可无明显特殊临床表现,发展到晚期患者可能出现血尿、腹部包块、腹痛、尿路感染、慢性肾功能不全、高血压及轻微出血等;严重时会出现急性RAML破裂出血,引起肾周或后腹膜血肿、失血性休克、急性肾功能衰竭等,甚至威胁患者生命[8]。TSC-RAML的临床表现复杂多变且高度异质性,临床上易漏诊、误诊,尤其需与单纯性RAML、肾恶性肿瘤相鉴别。TSC-RAML的诊断主要依靠影像学检查,B超检查价格低廉、无创,可实时动态观察病灶,对 TSC-RAML的检出率较高,可用于初期筛选及随访检查。CT对脂肪组织辨识力较高,可充分显示病灶的大小及与周围组织关系,目前普遍作为TSC-RAML最重要的影像学检查[9],可为进一步完善术前评估及术后对病患的随访提供客观资料。MRI诊断 TSC-RAML具有较高的特异性和灵敏性,能对CT及B超无法确诊的乏脂肪性AML做出准确判断[10]。在MRI中脂肪成分在T1WI高信号,T2WI低信号,目前平扫MRI已作为诊断TSC-RAML的首选影像学检查。
三、TSC-AML的治疗
临床确诊TSC-RAML后,需根据患者的病情特点制定个体化治疗方案,旨在最大限度地保留肾单位,缓解患者的症状,预防和治疗RAML破裂出血,从而达到延长此类病患寿命的目的。目前主要治疗手段有主动监测、药物治疗、动脉栓塞及手术治疗。
1.主动监测:TSC-RAML患者中有一部分低危人群,临床负担较轻,长时间处于无或只有轻微的TSC系统症状期,病灶直径<4 cm、肾功能正常、无明显其他伴随症状,对于这一类患者观察等待是一种合理的处理方式。最近的研究还表明,对于散发、无明显症状、生长速度缓慢的肿瘤,即使肿瘤直径≥4 cm,仍可以采取主动监测的方式[11]。但TSC-RAML有双侧发病倾向,生长快,侵袭性强,且上皮样AML具有潜在恶性可能性,发展过程难以预测,仍需密切监测肿瘤的爆发性增长及恶性潜能[12]。观察等待也是肿瘤直径<3 cm、无明显不适症状的未成年患者的首选方式[13]。
2.药物治疗:依维莫司是目前国际上唯一通过的治疗TSC-RAML的mTOR抑制剂。证据来自于两项3期临床试验。其中一项双盲、安慰剂对照的3期临床试验 EXIST-1有效评估了依维莫司治疗TSC室管膜下巨细胞星形细胞瘤的安全性及有效性[14]。实验共纳入了来自全球24个中心的117例患者,按2∶1的比例随机分配口服依维莫司4.5 mg/(m2·d)(血药浓度为5~15 ng/ml)或安慰剂。117例患者中有44例在基线时至少有一处RAML(最大直径≥1 cm),其中30例接受依维莫司治疗,14例接受安慰剂。将所有目标病灶总体积相比于基线水平下降≥50%定义为治疗有反应。结果显示,相较于安慰剂组,依维莫司治疗组明显提高了RAML的反应率(53.3% vs 0%)。另一项随机、双盲、安慰剂对照的国际多中心3期临床试验EXIST-2 前瞻性地评估了依维莫司(10 mg/d)的疗效[15]。实验共纳入了118例TSC-RAML或 肺淋巴血管肌瘤病-RAML患者,RAML病灶最大直径均≥3 cm。初始截止时间(2011年6月30日)的研究结果显示,相对于安慰剂组,依维莫司治疗组明显提高了RAML的反应率(42% vs 0%,P<0.000 1),且依维莫司明显延长了RAML体积进展的中位时间(12个月vs 11.4个月;HR:0.08,95%CI:0.02~0.37,P<0.000 1)。遵循实验的阳性结果,在实验的推广阶段,所有仍在研究组中的患者给予了开放标签的依维莫司治疗。至2014年1月1日,有112例患者至少接受了1个疗程的依维莫司治疗。中位治疗时间达到39.8个月。RAML的反应率达到56.3%(95%CI:46.6%~65.6%)。在治疗的第96周,RAML总体积相比于基线水平缩小≥30%的达到80.6%,缩减≥50%的达63.3%[16]。
鉴于肿瘤大小与出血风险之间的相关性,长期使用mTOR抑制剂可减少RAML肿瘤大小,减少继发其他并发症,保存功能性肾组织,特别是在高危患者中。在治疗期间应继续对肿瘤生长、血压和肾功能进行监测,最初每6~8周监测1次,直到稳定,然后每3~4个月1次。如果患者出现急性或慢性肾功能衰竭,蛋白尿迅速增加或预期手术,应停止药物治疗,然后积极监测。在EXIST-2试验中患者选用依维莫司进行为期3年的治疗,通过试验仍未完全研究出依维莫司在体内作用的半衰期。mTOR抑制剂治疗TSC-RAML患者的最佳治疗策略有待进一步研究。 对TSC-RAML的治疗,推荐口服依维莫司10 mg/d,每3~6个月复查CT或MRI,评估及监测病情[17]。
3.动脉栓塞:约50%~60% 的TSC相关RAML瘤体直径>4 cm 者可出现瘤体自发破裂出血,甚至突发腹膜后大出血,导致失血性休克甚至死亡[18]。成年TSC患者死亡的首位原因是TSC相关肾脏病变。Ewalt 等[19]经导管栓塞治疗了16例TCS-RAML患者(RAML直径4~21 cm),随访结果显示,16例患者共接受18次治疗栓塞了27个肿瘤。术中无并发症。栓塞后11例发生综合征,13例患者在治疗后3个月瘤体较前明显缩小,治疗后3~9年的7例患者肿瘤未见再生长,栓塞后无肾功能衰竭或出血。对于有症状或RAML体积较大的患者,可行导管栓塞治疗以预防出血和肾脏损伤。该疗法具有创伤小、可重复、尽可能多地保留肾单位等优点。选择性肾动脉栓塞在2012年被国际TSC委员会提出作为TCS-RAML破裂出血的首选术式,也是目前控制TCS-RAML活动性出血和预防瘤体破裂出血的首选治疗方法[20]。
4.手术治疗:因TSC常累及全身系统且不易根治,TSC-RAML 倾向于双侧肾脏多发性起病,手术后病变易复发,发生肾功能不全、终末期肾功能衰竭及慢性肾病的风险极高。故手术应最大程度地保留患肾肾单位,减轻术后肾脏功能的损伤,降低术后肾功能衰竭、慢性肾病的发生率,多选取AML剜除术、部分肾切除术。更应注意的是,对于TSC-RAML患者应竭力避免单侧肾切除术,需根据患者临床表现、肿瘤大小、数目、破裂出血与否、肾功能以及恶变可能性等综合因素慎重决定是否施行手术及具体手术方式。但对于巨大RAML或合并血管畸形,有破裂出血的高风险,药物治疗或多次肾动脉栓塞治疗效果欠佳者,需手术治疗。瘤体生长过快合并其他并发症,具备手术指征时,也需考虑手术治疗。细针穿刺或开放手术取活检,确诊为恶性肾肿瘤或者恶性平滑肌脂肪瘤应立即手术切除[21]。对于双侧肾脏病变最终导致的肾功能衰竭的患者肾移植是最终的选择,肾移植后的患者肾脏一般不会再次并发AML[13]。
综上所述,当出现临床症状时,瘤体已经较大(患者瘤体直径均>6 cm),此时不仅并发症较多,且治疗效果不理想,预后复发概率也明显升高,因此,应推广基因检测以便于早期临床确诊TSC-RAML。TSC-RAML为常染色体显性遗传病,若父母双方或者家族亲属中有患该病的,则必须在胎儿出生前行产前基因筛查。早期基因筛查可为临床诊断提供数据支持,除了可以确诊患儿,进行生育指导外,还可以降低患儿的出生率[22]。TSC-RAML患者多以肾占位就诊,B超提示占位呈强回声光团(考虑AML)。对于此类患者应进一步行增强CT和 MRI检查,若发现肾脏多发的高度混杂密度影合并肺内淋巴管平滑肌增生症、颅内室管膜下小节、室管膜下巨细胞星形细胞瘤等特征性表现[23],以及具有2个主要特征和1个次要特征者即可确诊;对于不能通过临床特征确诊的患者,需进一步行TSC基因检测以确诊,以此建立一个完整的临床诊疗路径。通过早期确诊疾病,对于瘤体<4 cm且无临床症状的患者,可嘱短期服用依维莫司治疗,并定期复查;瘤体>4 cm者,无论有无症状皆应给予预防性治疗(肾肿瘤剜除术、选择性肾动脉栓塞术或患肾切除术)[8]。因此,诊断TSC-RAML应将基因筛查和临床症状结合起来,提高诊断效率,从而减少患者病残率。
TSC-RAML是一种极其罕见的疾病,在努力提高诊断效率的同时,应根据此类患者的个体化差异制定合理的治疗方案,争取最大限度地保留肾单位,提高患者的预后及生活质量。
