PTEN诱导膀胱癌BIU-87细胞凋亡机制研究
2018-10-10郭永连周四维周海洪李国灏余家俊
郭永连 周四维 周海洪 李国灏 余家俊
组织细胞的生长和发育依赖于组织内细胞生存和死亡的有序调控,信号分子磷酸化水平的变化是调控各种信号通路活化状态的重要方式。恶性肿瘤的生长优势源于细胞内凋亡信号的弱化和生存信号的失控性放大。作为第一个被发现的具有双重特异性磷酸酶活性的抑癌基因蛋白,PTEN的功能变化对肿瘤细胞的信号调节及生物学行为具有重要的影响[1-2]。研究发现,膀胱癌标本及细胞株中有PTEN的突变及表达降低[3], PTEN的表达水平与尿路上皮癌的临床分期和病理分级密切相关[4]。本研究利用脂质体介导法将野生型PTEN基因(WT-PTEN)与两种突变型PTEN基因,即G129E-PTEN(无脂质磷酸酶活性而保留蛋白磷酸酶活性)和C124A-PTEN(丧失磷酸酶活性)分别导入人膀胱癌细胞株BIU-87中,观察细胞内焦点黏附激酶(focal adhesion kinase, FAK)、蛋白激酶B(protein kinase B, PKB/Akt)磷酸化水平的变化及其对膀胱癌细胞株BIU-87凋亡及细胞周期的影响,初步探讨PTEN对膀胱尿路上皮癌细胞恶性生物学行为的影响及机制。
材料与方法
一、材料与试剂
人膀胱癌细胞BIU-87(购自武汉大学典型生物保藏中心);小牛血清和RPMI 1640培养液(购自美国Hyclone公司);兔抗PTEN多克隆抗体(购自美国Labvision公司);一抗兔抗人β-actin、二抗HRP标记羊抗兔、羊抗鼠IgG、化学发光(ECL)底物(购自Santa Cruz公司);鼠抗磷酸化FAK(Tyr-397)单克隆抗体、兔抗磷酸化Akt(Ser-473)多克隆抗体(购自美国CST公司);携带野生型PTEN、G129E-PTEN和C124A-PTEN的GFP表达质粒pGZ21&xZ(pGZ21&xZ为5 400 bp,PTEN为1 300 bp)(美国Kenneth M. Yamada教授惠赠[5])。
二、实验方法
1.细胞培养与转染:BIU-87细胞培养于含10%小牛血清的RPMI 1640培养液中(青霉素100 IU/ml,链霉素100 mg/L),于37 ℃、5% CO2温箱中培养。采用脂质体介导法,将4种质粒分别导入处于对数生长期的BIU-87细胞中,4种转染细胞分别用WT-PT/87、G129E-PT/87、C124A-PT/87 及GFP/87 表示。继续在上述条件下培养,待用。
2.Western blot 检测蛋白表达:细胞转染48 h后,收集细胞,提取细胞总蛋白, Braford法测定蛋白质浓度。取等量(50 μg)细胞总蛋白行SDS-PAGE凝胶恒压电泳,电泳转膜后取相应一抗(兔抗PTEN 1∶200)、鼠抗磷酸化FAK(Tyr-397)、兔抗磷酸化Akt (1∶1 000) 4 ℃温育过夜,漂洗后与相应二抗室温下温育2 h, ECL显影成像,胶片经英国UVP公司GDS8000型凝胶成像分析系统处理数据,计算灰度值。以β-actin蛋白作为内参。
3.细胞凋亡分析:细胞转染48 h后,Annexin V/PI法染色,采用激光共聚焦显微镜技术(Leica,美国BD公司) 观察细胞凋亡形态,并采用FACSort流式细胞仪(美国BD公司)检测细胞凋亡率和细胞周期。
三、统计学方法
数据采用ModFit软件进行分析,采用SPSS 10.1统计软件进行χ2检验、t检验和Pearson’s相关检验。
结 果
一、瞬时转染及PTEN表达的鉴定
转染后48 h,荧光显微镜下观察4种转染细胞,转染效率均达到76%~89%(图1)。Western blot结果显示, 与对照BIU-87细胞相比,WT-PT/87(t=21.34,P<0.01)、G129E-PT/87(t=25.50,P<0.01)和C124A-PT/87(t=23.47,P<0.01)中的PTEN表达增强了210%~260%, 而GFP/87细胞中的PTEN表达无明显变化(图2)。
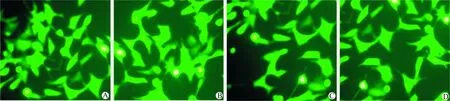
A:GFP/87;B:C124A-PT/87;C:G129E-PT/87;D:WT-PT/87
图1 转染48 h后质粒转染效率
二、PTEN表达对细胞内FAK、Akt蛋白表达及其磷酸化水平的影响
与对照细胞比较,WT-PT/87细胞内磷酸化FAK (p-FAK)和磷酸化Akt(p-Akt)水平分别下降59%(P<0.01)和89%(P<0.01);G129E-PT/87细胞内p-FAK和p-Akt水平分别下降62%(P<0.01)和46%(P<0.05);而C124A-PT/87和GFP/87细胞内FAK和Akt的磷酸化水平无明显降低(图2) 。
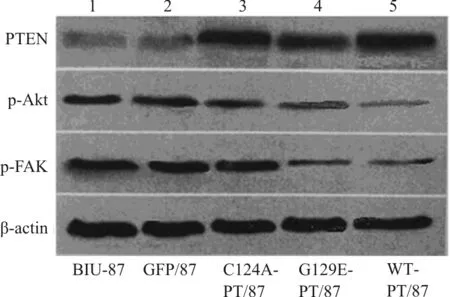
图2 不同组细胞PTEN、p-FAK和p-AKT的表达
三、细胞凋亡分析
共聚集显微镜下转染细胞胞质呈GFP(530 nm)绿色荧光,胞核为PI(560 nm)染色红色,凋亡细胞可见染色体边集、核浓缩、核碎裂等典型的细胞凋亡形态学改变(图3)。流式细胞仪检测结果显示,WT-PT/87与G129E-PT/87细胞凋亡率分别为(18.5±2.1)% (t=17.34,P<0.01)和(10.1±0.5)% (t=14.58,P<0.01),明显高于对照细胞,差异有统计学意义;而C124A-PT/87与 GFP/87细胞凋亡率无明显升高(图4、表1)。各种细胞Akt磷酸化水平与凋亡率变化呈明显负相关(r=-1.145,P<0.01)。
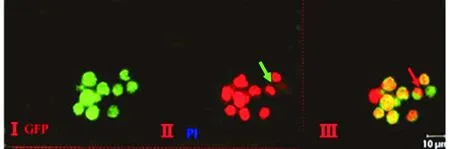
Ⅰ:GFP(530 nm)细胞质呈绿色荧光;Ⅱ:PI(560 nm)细胞核呈红色;Ⅲ:凋亡细胞可见核染色体边集、核浓缩、核碎裂等典型凋亡形态学改变(→所示)
图3 共聚焦显微镜下转染细胞形态学变化
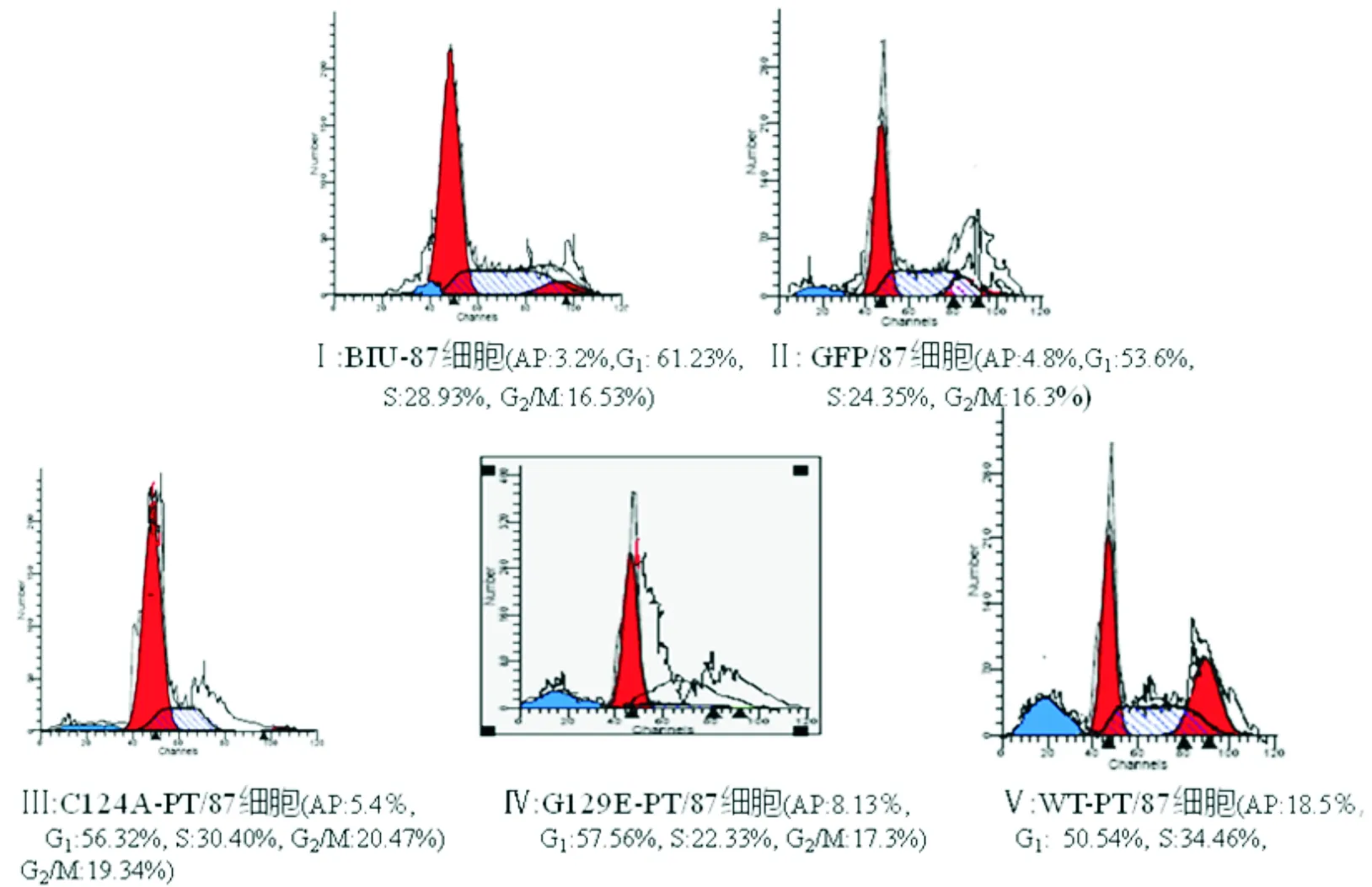
图4 转染及对照细胞凋亡率及细胞周期

表1 转染及对照细胞凋亡率(%)与细胞周期±s)
与BIU-87细胞比较★t=17.34,P<0.01;※t=14.58,P<0.01; 与G129E-PT/87细胞比较#t=10.34,P<0.01
讨 论
PTEN/MMAC1/TEP1是一个抑癌基因,位于染色体10q23.3,具有双重磷酸酶活性:既可作为脂质磷酸酶使磷酸肌醇3,4,5三磷酸(PIP3)的D3位脱磷酸,负性调控PI3K/Akt通路,调控细胞G1期阻滞和细胞凋亡;也可作为蛋白磷酸脂酶,使磷酸酪氨酸、磷酸丝/苏氨酸去磷酸,通过分子信号的级链放大效应抑制MAPK信号通路[1,6]。在多种晚期恶性肿瘤组织(如非小细胞肺癌、子宫内膜癌、乳腺癌、前列腺癌和甲状腺癌)中存在着PTEN基因不同程度的突变或丢失,它是人类肿瘤中突变率最高的基因之一[7]。研究发现, 膀胱癌标本及细胞株中有PTEN的突变及表达降低[3], PTEN表达水平与尿路上皮癌的临床分期和病理分级密切相关[4]。文献报道PTEN的突变或失活可导致细胞内多个信号通路活性的改变,并且导入外源性PTEN可诱导肿瘤细胞发生凋亡,但其具体机制尚未完全明确[8]。
本研究通过检测细胞内两个重要的信号分子FAK和Akt,探讨PTEN对相关信号通路的作用机制。FAK是整合蛋白介导信号通路的关键分子,整合蛋白的簇集引起FAK的自动磷酸化和聚集,与PI3K结合而使其激活,其活化后可结合p130cas、Grb2、PI3K等调控细胞的黏附、迁移和增殖等行为。同时FAK也直接激活Akt,从而激发PI3K/Akt通路[9]。我们将外源性PTEN导入BIU-87细胞中发现,转染WT-PTEN和仅保留蛋白磷酸酶活性的G129E-PTEN后,胞内FAK磷酸化水平下降了59%和62%,这说明至少在BIU-87细胞中PTEN主要通过其蛋白磷酸酶活性使FAK去磷酸化。Akt是PI3K/PIP3通路的关键下游分子,活化的Akt可经多种途径刺激肿瘤细胞逃避凋亡,异常增殖[10],因此,PTEN对PIP3的去磷酸化作用可能会抑制Akt的磷酸化而影响细胞的生物学行为。本实验中,转染WT-PTEN的BIU-87细胞内 p-Akt的表达明显降低,这一结果与国外相关研究报道一致[11]。但我们发现在转染G129E-PTEN的细胞中p-Akt水平也下降了46%,而转染无磷酸酶活性的C124A-PTEN后,其胞内FAK、Akt磷酸化水平均无变化,说明PTEN蛋白磷酸酶活性也对Akt磷酸化有一定的抑制作用。由于缺失脂质磷酸酶活性的PTEN并不能直接调节PI3K/Akt,因此,这一作用可能是通过PTEN使FAK去磷酸化,抑制FAK与PI3K的结合所实现的,这也提示了PTEN调节细胞内信号通路网络的稳定性和复杂性。
细胞凋亡结果显示,WT-PT/87和G129E/87细胞的凋亡率分别上升了(18.5±2.1)%和(10.1±0.5)%,表明PTEN可诱导BIU-87细胞发生凋亡。两种细胞内FAK磷酸化水平无明显差异,Akt磷酸化水平和细胞凋亡率的变化呈明显负相关,提示这种作用很可能是通过其脂质酶活性抑制Akt的磷酸化而实现。
本研究通过将外源性PETN及其突变体导入膀胱尿路上皮癌细胞BIU-87证实,提高PTEN表达水平能促进膀胱肿瘤细胞凋亡,其机制与其脂质酶活性降低Akt磷酸化水平相关,PTEN蛋白磷酸酶活性可能通过调节FAK磷酸化水平参与调节Akt磷酸化。本研究为PTEN用于膀胱癌的生物治疗提供了一定的理论基础,仍需更多的细胞及动物实验以进一步研究和探讨。
