海洋源金属硫蛋白毕赤酵母重组菌株的构建及其表达活性研究
2018-10-10阎光宇孙继鹏易瑞灶苏永全
余 蕾,阎光宇,孙继鹏,易瑞灶,苏永全
金属硫蛋白(metallothionein,MT),化学名金属硫组氨酸三甲基内盐,是一类普遍存在于生物体内的、低分子量(2-7 kD)的、富含半胱氨酸(20%-30%)、不含芳香族氨基酸和组氨酸的一类金属结合蛋白质。MT可被金属、细胞因子、有机化学药物和应激、荷尔蒙等诱导,具有维持生物体内金属含量动态平衡和重金属解毒作用双重机制,且具有清除自由基和抗辐射、提高机体免疫力、增强机体抗应激能力等多种主要的生物学作用[1-3]。因此,MT在食品保健、医学、农业、生物工程、环保等领域得到了广泛的应用。
目前,国内市场上常见的MT多数是从兔肝脏中提纯[4],提取工艺繁复,产量极低,致使MT的价格极其昂贵(纯度在 95% 以上价格为 45 000~50 000 元/g),MT原料来源已成为制约该领域发展的瓶颈之一,从而使其应用和研究受到限制。利用益生菌基因重组技术大规模化生产制备 MT 是解决其来源限制瓶颈的热点研究方向。
毕赤酵母(Pichia pastoris)表达系统具有优良特性,是目前广泛应用的微生物表达系统之一,作为真核生物,其不仅具备原核表达系统的繁殖速度快、操作简单及价格低廉、外源蛋白表达量高等优点,还能够对外源蛋白进行翻译后加工、折叠及修饰,自身分泌的蛋白质少便于分离纯化,更适用于大批量发酵生产。目前,已有多种外源基因在巴斯德毕赤酵母表达系统中成功地重组表达[5-7]。底栖双壳类海洋动物为滤食性生物,对重金属有较强的生物富集能力,其体内MT基因对重金属具有高敏感的应激效应[8-10],且与环境中金属浓度具有一定的相关性。相对于陆地源 MT,海洋源 MT 具有独特的化学结构和特殊的生物活性。本研究采用毕赤酵母 GST115 菌株表达海洋源 MT。毕赤酵母菌株 GST115 利用强效的醇氧化酶1(AOX1)启动子,已成功高效表达了多种外源蛋白,且其与酵母基因组整合的机理决定酵母多拷贝重组子的出现。本研究旨在解决制约MT产业发展原料来源瓶颈,应用基因重组技术,将褶牡蛎(Ostrea plicatula)内脏团中克隆得到的金属硫蛋白基因全长序列 OpMT,插入到表达载体 pPICZαA -SUMO 的相应位点,并转入毕赤酵母菌GS115中,拟构建安全高效分泌表达的重组毕赤酵母菌MT基因工程菌。以期能获得具高安全性、高产量和高活性的高纯海洋源 MT 蛋白,解决 MT 原料来源限制的瓶颈,为以后开发天然、高效海洋源重金属解毒剂提供理论基础。
1 材料与方法
1.1 材料
1.1.1 质粒、菌株和主要试剂 本实验室所用菌株和质粒见表1。主要试剂见表2。

表1 质粒和菌株

表2 主要试剂
1.2 试验方法
1.2.1 融合分泌表达载体pPICZαA-SUMO-OpMT的构建 根据NCBI GeneBank中褶牡蛎金属硫蛋白基因OpMT序列(登录号:KP875559),设计引物(F1:TGG ACC GGA TGT AAT GTG GT /R1:TTG GGT CCT TTG TTA CAC GC),从褶牡蛎内脏团总RNA中扩增得到目的基因序列。连接至克隆载体pMD-19,并转化到E.coli DH5α 中,送至上海生物工程技术公司进行序列测定。酶切(BamHI/SmaI)后连接至pPICZαA-SUMO 表达载体上,并转化到E.coli DH5α细胞,抗生素(100 μg/mL 氨苄青霉素Amp)平板筛选阳性转化子并加以验证。
1.2.2 毕赤酵母重组工程菌构建和筛选利用电转化法将质粒 pPICZαA-SUMO-OpMT转入毕赤酵母菌 GST115中,利用含有不同浓度抗生素(博来霉素)的MD 平板进行初步筛选得到阳性转化子菌株,命名为 GST115/pPICZαA- SUMO-OpMT (图 1)。

图1 重组质粒 pPICZαA- SUMO-OpMT 的构建
筛选得到的重组酵母菌株用 YPD (Yeast Extract Peptone Dextrose Medium) 液体培养基培养至同一生长周期,取 2 mL 菌液依次接种在0, 0.25, 0.50, 1.0, 1.5, 2.0, 3.0, 4.0 mg/mL 博来霉素的 YPD 平板上。在耐受高质量浓度博来霉素的 YPD 平板上筛选阳性高拷贝GST115/pPICZαA- SUMO-OpMT 重组酵母。
Mut+表型的重组菌株一般是由于 SalI 线性化质粒电转化 GS115 后,大多数在 HIS4 位点发生了重组。可以利用MMH 和 MDH平板进行区分检测。因此,进一步对高浓度博来霉素的 YPD 平板上的 GST115//pPICZαA -SUMO- OpMT 重组酵母菌株进行甲醛利用型筛选Mut+型,分别利用含有博来霉素的 MMH 和 MDH 平板筛选。在 MMH 平板上很小或者不长,而在 MDH 平板上能够正常生长的为 Muts 型,其余为 Mut+ 型。同时挑取单菌落进行PCR 扩增鉴定(引物 F2:ATG TCT GAT CCA TGT AAC /R2:TC ATT TCT TAC AGA CAC ATC)。
1.2.3 融合蛋白诱导表达和分离纯化 100 mL GST115/pPICZαA- SUMO-OpMT 于BMGY 菌液扩大培养,培养条件:30 ℃,24 h , 220 r /min 振荡培养至OD600 值为 6.0,再转入 BMMY 培养基中诱导培养,加入0.5% 甲醛诱导,每 24 h 补加1次甲醇,分别在 2, 4, 6, 8 h 分别离心收集发酵液上清,进行 SDS-PAGE 凝胶电泳定性,分离胶 12%,浓缩胶 5%。另一组空白毕赤酵母菌 GS115作为对照。电泳结束后凝胶染色 4-6 h,将脱色后的凝胶保存于去离子水中,用 Bio-Rad 凝胶成像系统拍照。
对发酵液进行His-tag标签亲和纯化。首先平衡镍柱(TBS pH 8.0),上样,设流速为1 mL/min,之后用含有50 mmol/L 咪唑的TBS(pH 8.0)洗涤,最后用含有300 mmol/L 咪唑的TBS(pH 8.0)洗脱目的蛋白。收集洗脱峰值,分别进行目的蛋白定性检测(的SDS-PAGE 凝胶电泳)和定量检测(Bradford method)。
1.2.4 融合蛋白的 Western blotting 鉴定 将重组毕赤酵母工程菌诱导表达2, 4, 6, 8 h 后的发酵液和空白对照组(毕赤酵母菌 GS115)的发酵液,经 TCA 沉淀后进行 SDS-PAGE 凝胶电泳,转膜,加入His 抗体,用 Bio-Rad 凝胶成像系统拍照。
1.2.5 褶牡蛎金属硫蛋白HPLC检测 收集菌液(7 000 r/min 10 min),水浴(80 ℃/5 min), 离心取上清(12 000 r/min 10 min)。进行MT含量测定,采用HPLC方法测定其中-SH含量进行MT间接定量[11]。标样为兔肝MT,图7(A)为色谱条件下得到的兔肝MT标样色谱图,MT保留时间为7.3~7.7 min。
1.2.6 融合蛋白活性检测 配置含有不同浓度CdCl2的 YPD固体培养基平板(0, 50, 100, 200, 500, 700 μmol/L),取100 μL OD600为4.0的毕赤酵母菌重组OpMT工程菌分别均匀涂布于上述平板上,同时以毕赤酵母菌GS115菌株为对照组,30 ℃ 倒置培养12-16 h 观察菌落生长情况。
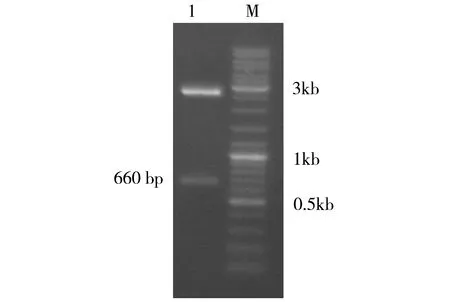
图2 融合表达载体pPICZαA-SUMO-OpMT的酶切鉴定注:为SUMO-OpMT表达载体的酶切图;M:DNA Marker;1:表达质粒双酶切
2 结果与分析
2.1 融合表达载体的构建
PCR 扩增褶牡蛎内脏团总 RNA 得到约为 324 bp的目的基因片段 OpMT 后,与SUMO 基因(约660 bp)一起经酶切连接至融合表达载体 pPICZαA,得到构建重组质粒 pPICZαA-SUMO-OpMT。该质粒的酶切验证见图 2。
2.2 高效分泌表达 OpMT 重组工程菌筛选
目的基因整合进毕赤酵母,His+转化子出现 1%-10% 概率的多拷贝插入,整合了多拷贝表达的重组酵母,有利于高效表达外源蛋白。可利用抗生素(博来霉素)浓度梯度法进行筛选,耐受抗生素(博来霉素)浓度越高,越容易筛选出多拷贝表达的重组酵母菌。设置7个浓度梯度(0.25-4.0 mg/mL)的博来霉素平板筛选,到耐受4.0 mg/mL博来霉素的 GST115/pPICZαA-SUMO-OpMT 重组酵母菌株(见图3),表明本研究筛选得到酵母基因组 DNA 上整合了多拷贝目的基因 MT 表达单元的重组酵母菌。
将筛选得到的重组酵母菌株经PCR扩增(F1:TGG ACC GGA TGT AAT GTG GT /R1:TTG GGT CCT TTG TTA CAC GC)后送至上海生物工程技术公司进行序列测定。

图3 高拷贝重组毕赤酵母菌株的筛选(图中数据为 Zeocin 浓度(mg/mL)
图4 重组酵母工程菌甲醛利用型筛选
通过含博来霉素的 MMH 和 MDH 平板筛选,在MMH 平板上需找到 2 株甲醛利用型(Mut+型)的 GST115/pPICZαA-SUMO-OpMT 重组酵母菌株(图 4)。
2.3 重组蛋白的诱导表达、分离纯化和Western blotting 鉴定
高拷贝甲醛利用型 GST115/pPICZαA-SUMO-OpMT 菌液进行甲醛扩大诱导培养(1 L),培养条件:30 ℃,8 h,0.5% 甲醛,2, 4, 6, 8 h 分别离心(12 000 r/min,4 ℃,30 min)收集发酵液上清,利用 His-tag 标签亲和纯化 SUMO-OpMT 融合蛋白,Bradford method 分析纯化得到融合蛋白结果表明,蛋白纯度在 95% 以上,目的蛋白得率0.436 mg/mL。
将收集得到纯化蛋白进行SDS-PAGE 电泳分析和 Westernblotting (His-Tag 单抗)鉴定(图5)。以未转入表达载体的 GST115毕赤酵母菌培养液为空白对照。分析图 5 (左图和右图)发现在 23 kD(其中 OpMT 编码蛋白为10.5kD)位置分别出现了一条明显的特异性条带,说明多拷贝融合蛋白在宿主菌中得到了表达,且融合蛋白为可溶形式表达,表达量并随着诱导时间延长增加。

图5 GST115/pPICZαA-SUMO-OpMT 的 SDS-PAGE 电泳检测(左)和Western Blotting 鉴定(右)M: 蛋白 Marker; Ø. 未转化(阴性对照); 红色箭头指示目的蛋白
2.4 重组毕赤酵母菌发酵液中OpMT的HPLC检测
以兔肝MT为标样,兔肝MT标品(0.1 mg/mL)和毕赤酵母菌重组工程菌发酵液HPLC结果见图6。兔肝MT目的峰的保留时间为7.3~7.7 min。结果显示,毕赤酵母菌重组工程菌发酵液在7.7 min有峰出现,说明毕赤酵母重组工程菌发酵液中含有目的蛋白,毕赤酵母菌重组工程菌成功表达了目的蛋白OpMT,表达量为0.37 mg/mL。
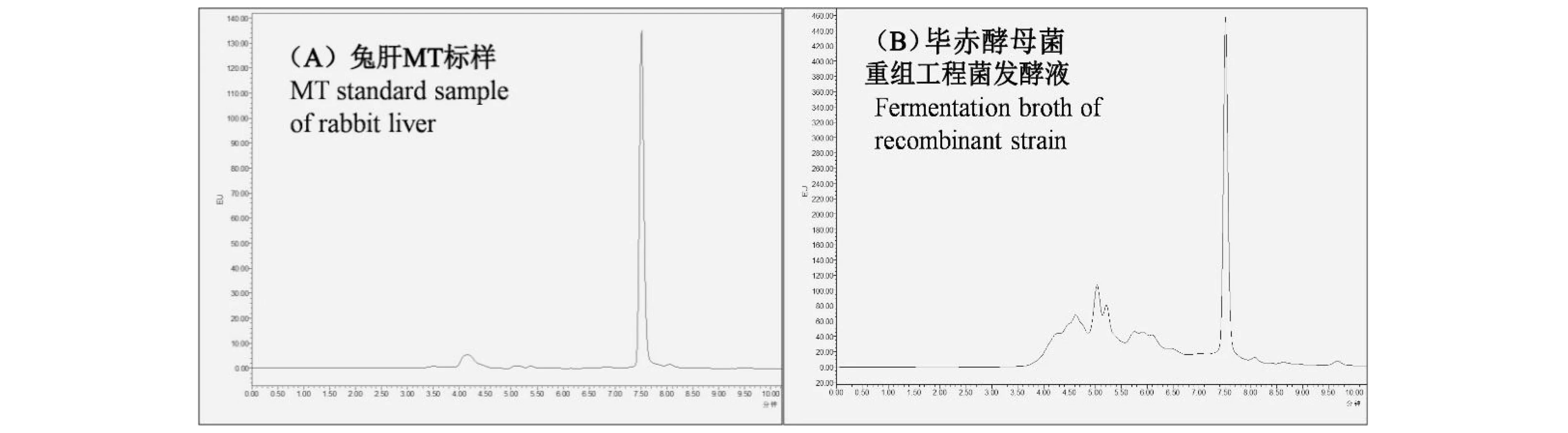
图6 兔肝MT标品(A)和毕赤酵母重组工程菌发酵液(B)HPLC色谱图
2.5 褶牡蛎金属硫蛋白的活性检测
将含有SUMO-OpMT质粒的毕赤酵母菌重组工程菌和不含SUMO-OpMT质粒的毕赤酵母菌空载体分别涂布于含有不同浓度CdCl2的培养基上,37 ℃培养12-16 h后发现(图7),随着CdCl2浓度的增加,平板上菌落数减少。当CdCl2的浓度达到100 μmol/L时,MT重组工程菌在CdCl2的浓度为50 μmol/L的平板上生长良好,在CdCl2的浓度为100 μmol/L的平板上生长较差,在CdCl2的浓度为200 μmol/L的平板上未能检测到,即MT重组工程菌的最大耐受CdCl2的浓度为100 μmol/L,而空载体在CdCl2的浓度为50 μmol/L的平板上生长较差,,在CdCl2的浓度为100 μmol/L的平板上未能检测到菌落。说明含有SUMO-OpMT的重组毕赤酵母菌工程菌对重金属镉的耐受能力增强。

图7 YPD固体培养基上重组工程菌对镉的耐受能力
3 讨 论
利用基因重组和发酵技术制备重组蛋白是目前获取大量外源蛋白的首选。目前,国内外对金属硫蛋白基因工程方面研究大多集中在原核表达系统[11],其应用也多关注于环境治理和修复以及微生物解毒[12-13],对 MT 的工业化应用关注较少,具有工业化生产价值的基因工程菌株报道更是极少。本课题组前期研究利用 E. coli 高效表达了海洋源 MT,但是表达的蛋白仍以包涵体的形式存在。这与邓小亮、He Y等报道一致[14-16]。另外,本课题组前期研究还运用枯草芽孢杆菌作为宿主[17],成功实现 SUMO(small ubiquitin-related modifier)与海洋源 MT 的融合分泌表达,并得到高纯度的、有活性的可溶性目的蛋白,但表达量较低,仍无法满足 MT 的工业化生产要求。
毕赤酵母作为真核宿主菌不仅具有原核生物的优点,有利于低成本大规模生产,同时,可高表达有生物学活性的分泌型功能性外源目的蛋白、极少分泌自身蛋白、不含内毒素、使用安全的优点,成为实验室研究及商业生产重组蛋白的新宠,具有极好的生产应用前景。毕赤表达系统作为生产外源蛋白的重要宿主菌已成功表达多种蛋白(其中一些产物已应用于临床试验,包括酶、膜蛋白、抗原、抗体和调节蛋白等[18-20]),但未见有利用毕赤酵母表达系统实现海洋源 MT 表达的报道。本研究以毕赤酵母 GS115为宿主菌,成功实现 SUMO 与海洋源 MT 在毕赤酵母菌 GS115 中融合分泌表达,并得到高表达的、有活性的可溶性目的蛋白,使海洋源 MT 具有极大的应用于实际工业生产潜能,为天然高效重金属生物解毒剂的成功开发和推广提供理论依据。
当前,毕赤酵母菌株 GST115 成功、高效表达多种外源蛋白多依赖 AOX1 启动基因,而 AOX1 为甲醇依赖型启动子,所以在培养过程中存在一定火灾隐患。因此, GAP、FLD1、PEX8、PGAP 和 YPT1 等不以甲醇为唯一诱导物的启动子具有更大吸引力,也将是本研究下一步研究的重点。
