电转化条件对大肠杆菌TG1转化效率的影响
2018-10-10王阔鹏于凌娇刘倩宏
刘 麒,王阔鹏,于凌娇,刘倩宏
转化是基因重组中的一项重要技术,是决定平末端连接效率及建立高质量基因文库的关键。将携带目的基因的质粒成功导入受体细胞的方法有两种:一种是氯化钙法,另一种是电转化法。电转化法是利用瞬间高压迫使细胞膜产生孔隙使质粒导入细胞,其转化率较高[1]。基因的平末端连接对转化率要求较严格,需要较高的转化率作为支撑。目前,在不同实验室环境的影响下,感受态细胞的制备以及转化条件都有所不同。为提高平末端连接、转化效率,进而建立较高质量的文库,因此本研究通过比较不同电转化条件下大肠杆菌TG1的转化效率,为后续噬菌体展示基因文库的建立奠定基础。
1 试验材料与方法
1.1 试验材料与主要仪器
大肠杆菌菌株TG1本室-80 ℃保存;pDJ01质粒为梅西大学Jasna Rakonjac教授惠赠,-80 ℃保存;大肠杆菌TG1株购自广州碧云天生物有限公司;质粒提取试剂盒购自康为世纪生物有限公司。
LB液体培养液:量取胰蛋白胨2 g,酵母提取物2.0 g,NaCl1.0 g,用去离子水定容补足体积至500 mL。
SOC培养液:在950 mL去离子水中加入胰化蛋白胨20.0 g,酵母提取物5.0 g,NaCl0.5 g,加入10 mL 250 mmol/L KCl溶液,用5 mol/L NaOH调pH至7.0。用去离子水定容1 L,高压蒸汽灭菌20 min,备用。使用前加入5 mL灭菌的2 mol/L MgCl2,高压灭菌后冷却至60 ℃或60 ℃以下,加20 mL除菌的1 mol/L葡萄糖溶液[2]。
LB固体培养基(含20 μg/mL氯霉素):称取胰蛋白胨2 g,酵母提取物2 g,NaCl 1 g,琼脂糖4 g,用去离子水定容补足体积至500 mL。待蒸汽灭菌后,将培养基放置水浴锅中,待温度降至40 ℃左右添加氯霉素以20 μg/mL的终浓度添加于培养基中。
TGL20M离心机、超净工作台、电转仪(Bio-rad)、无菌恒温培养箱(Thermol)。
1.2 试验方法
1.2.1 pDJ01质粒提取 用接种环蘸取一定的菌液在新鲜的LB(含20 μg/mL氯霉素)固体培养基上交错划线,37 ℃ 倒置过夜培养。挑取单菌落接种于5 mL LB(含20 μg/mL氯霉素)液体培养基中37 ℃、 200 rpm/min过夜震荡培养,将菌液离心,利用康为世纪质粒提取盒提取质粒。1%琼脂糖凝胶电泳检测提取质粒浓度。
1.2.2 TG1大肠杆菌生长曲线的绘制 取出-80 ℃保种的TG1大肠杆菌,用接种环蘸取一定的菌液在新鲜的LB固体培养基上交错划线,37 ℃过夜、静置培养。挑取单菌落接种于5 mL LB液体培养液中,37 ℃,170 rpm/min振荡过夜培养,此即为母液。按母液与LB液体培养液1∶100比例,转接新鲜LB液体培养液中,37 ℃,170 rpm/min振荡培养,每隔0.5 h取菌液0.5 mL,直至培养9.5 h,取不同时间点菌液进行菌落计数,具体操作参照文献进行,绘制TG1株大肠杆菌生长曲线图[3-4]。
对经过培养的菌液用LB液体培养液进行10倍稀释,稀释成10-1~10-13,取不同稀释度菌液100 μL涂板计数。试验重复三次。
1.2.3 TG1感受态细胞的制备 取2 mL母液转接到200 mL新鲜的LB液体培养液中,37 ℃、170 rpm/min振荡培养(振荡培养时间及条件根据1.2.2结果确定),冰浴30 min。将冰浴后的菌液分装至预冷的无菌离心管中,4 ℃、5 000 rpm/min离心20 min,操作始终保持在冰浴环境下进行。将上清液吸出后,再用10%无菌甘油水轻轻吹打重悬细胞,重复洗涤2次后分别用10%无菌甘油水重悬细胞沉淀。每管100 μL分装至EP管中, -80 ℃保存备用。
1.2.4 电转化 将2 μL pDJ01质粒加入100 μL感受态细胞中充分混合,电转化条件为电压1 800 V,电容25 μF,电阻200 Ω,0.1 cm电击杯,进行电击。立刻加入500 μ L LB保护受损细胞并转移到离心管中,再加入400 μ L LB充分吹尽菌体加入到离心管中,37 ℃、170 rpm/min振荡培养 45 min,用移液枪吸取100 μL涂于LB固体培养基(20 μg/mL氯霉素),37 ℃恒温箱过夜培养,通过生长的菌落数评价转化效率。
1.2.5 TG1菌株在不同生长阶段对电转化效率的影响 通过1.2.2确定的对数生长期,选取活化后1.5 h、2.0 h、2.5 h、3.0 h、3.5 h的TG1菌液,制备感受态细胞,进行电转化,条件同1.2.4,进行菌落计数检测电转化效率。
1.2.6 感受态细胞浓度对转化率的影响 理论上感受态细胞的浓度越高其转化率越高,但过高的浓度会使菌体过于粘稠,不利于质粒与菌体混合,反而会降低其对质粒的转化率。按1.2.5优化的最佳条件制备感受态细胞后,将其分装在4管50 mL预冷的无菌离心管中,每管约100 μL菌体,分别加入10%无菌甘油水进行1∶1、1∶3、1∶5、1∶7倍稀释,以确定感受态细胞制备最佳稀释浓度。将2 μL pDJ01质粒分别与不同稀释倍数的感受态细胞混合,电转化,其余操作同1.2.4。
1.2.7 转化后复苏时间及复苏液对转化率的影响 对电击后细胞的复苏液的选取及复苏时间进行优化。将2 μL pDJ01质粒与100 μL感受态细胞混合,进行电转化操作同1.2.4,电击后立即加入900 μ L LB液体培养液和SOC培养液,37 ℃、170 rpm/min振荡培养 ,分别在0.75 h、1.5 h、2.0 h、2.5 h四个时间点取样。取不同复苏液及不同复苏时间的菌液样本50 μL进行涂板,恒温箱37 ℃倒置过夜培养,进行菌落计数。其余操作同1.2.4。
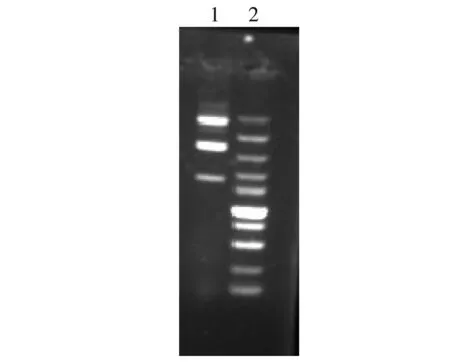
图1 图1. pDJ01质粒提取结果1.提取质粒pDJ01结果;2.10000mark(条带大小从下到上分别为100 bp.250 bp.500 bp.750 bp.1 000 bp.1 500 bp.2 000 bp.3 000 bp.5 000 bp.10 000 bp)
1.2.8 电转化条件对转化率的影响 选用以下三组不同条件进行电转化:电压1 800 V、电容25 μF、电阻200 Ω 、0.1 cm电击杯;电压2 500 V、电容25 μF、电阻200 Ω 、0.1 cm电击杯;电压3 000 V、电容25 μF、电阻200 Ω 、0.2 cm电击杯。电转化后操作与1.2.4相同,培养后进行观察。
1.2.9 质粒浓度改变对转化率的影响 分别取100 ng/mL、50 ng/mL、25 ng/mL不同浓度的pDJ01质粒2 μL与100 μL感受态细胞充分混合,冰浴静置5 min进行电转化,操作与1.2.4相同,根据结果评价质粒浓度改变对转化率的影响。
1.2.10 抗生素浓度对转化率的影响 向LB固体培养基中添加氯霉素使其浓度为10 μg/mL、20 μg/mL、40 μg/mL。利用1.2.8优化的电转化参数对其进行电转化操作后,分别将其涂布于氯霉素浓度分别为10 μg/mL、20 μg/mL、40 μg/mL的LB固体培养基上。其余操作同1.2.4,根据结果评价抗生素对转化效率的影响。
2 结果
2.1 pDJ01质粒提取结果
pDJ01质粒提取结果见图1。pDJ01质粒大小约为1 500 bp,在预期位置发现目的条带,并估算其浓度约为100 ng/μL。
2.2 大肠杆菌TG1生长曲线的绘制
分别取活化后不同时间点TG1菌液,绘制细菌生长曲线,结果见图2。从图中可看出, 1.5 h至5 h TG1处于对数生长期。细菌处于对数生长期时的形态、染色特性、致病性、抗药性等生物特征最为典型,TG1生长曲线的绘制对于后续系列转化条件的优化至关重要。
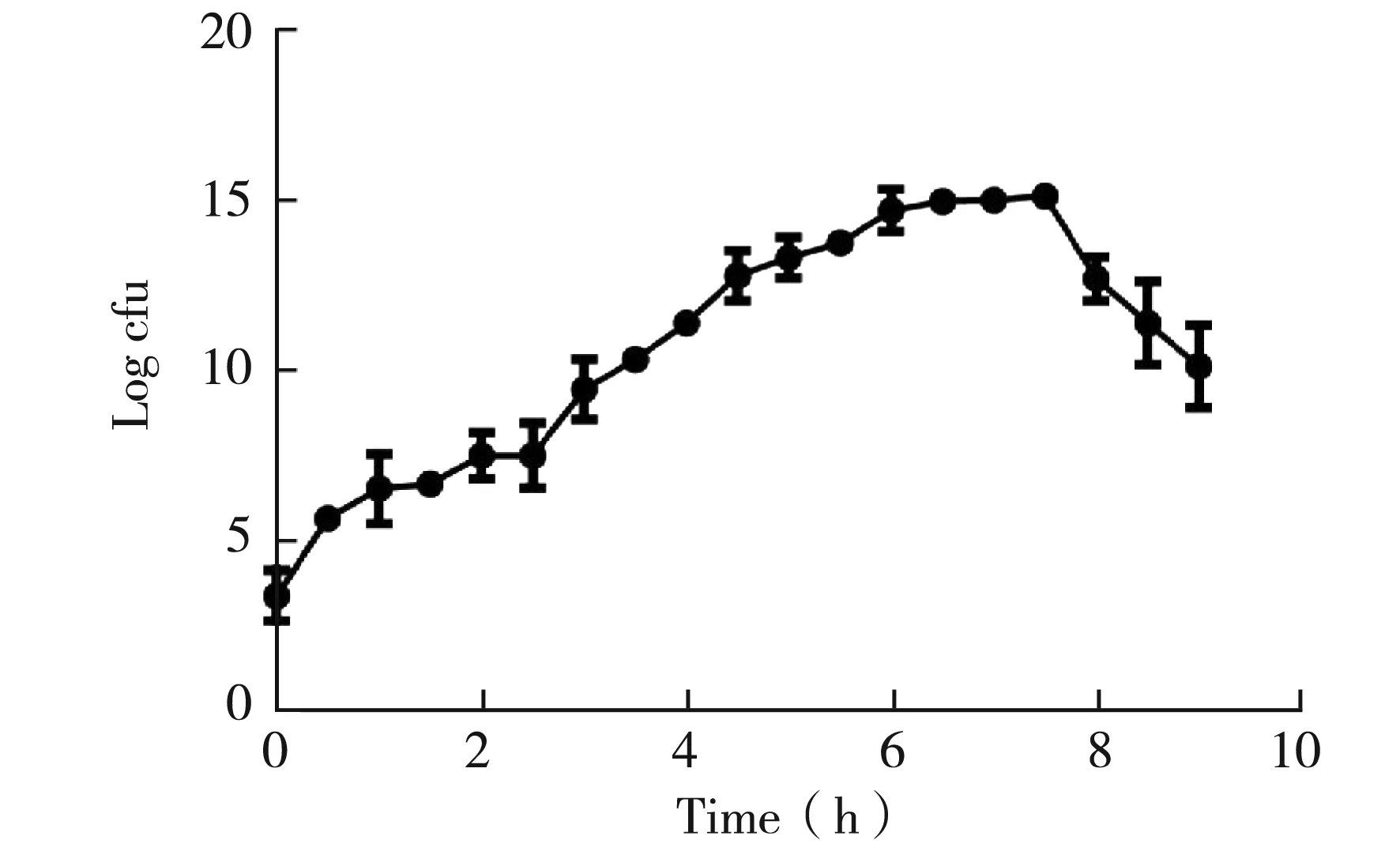
图2 大肠杆菌TG1生长曲线
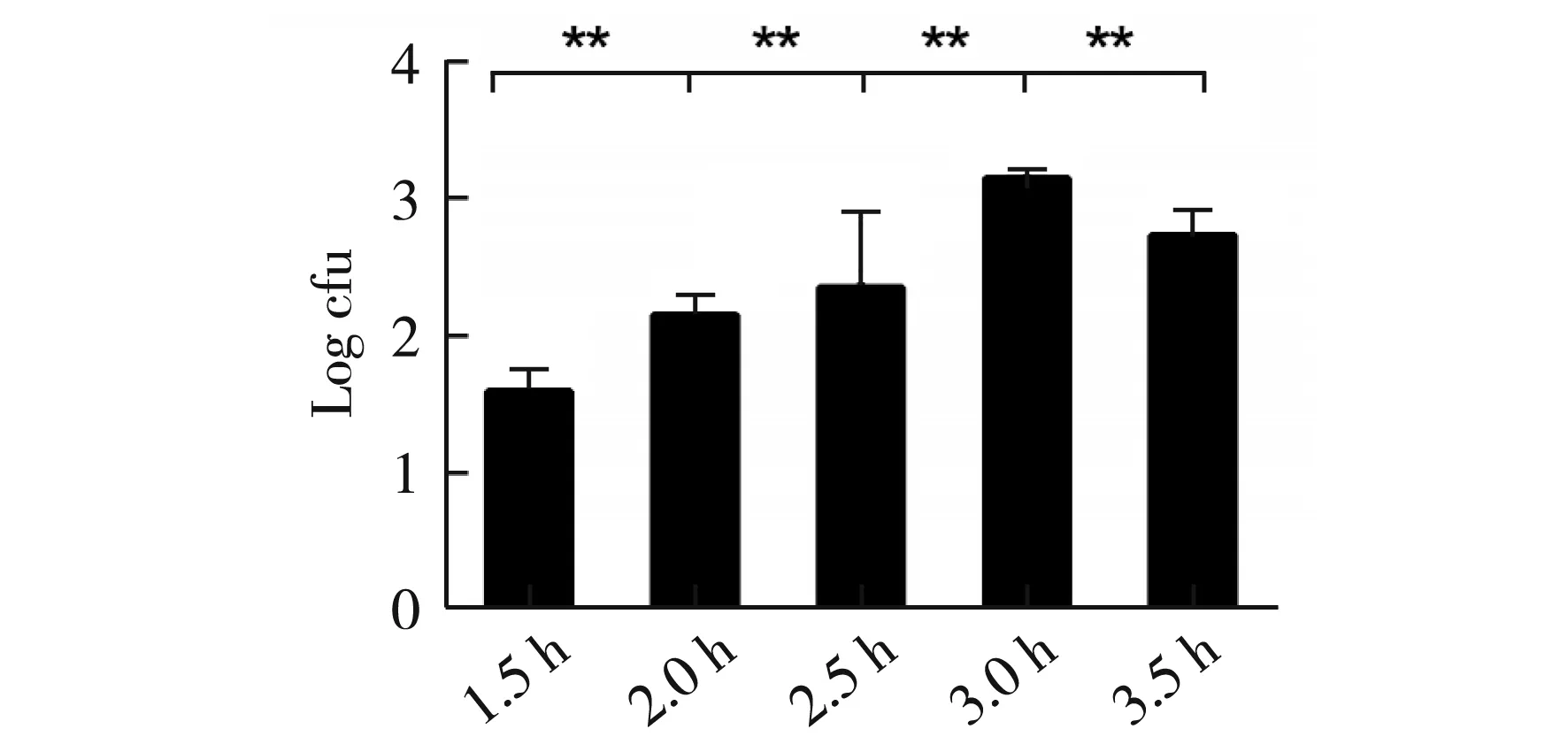
图3 TG1菌株在不同生长阶段对转化率的影响
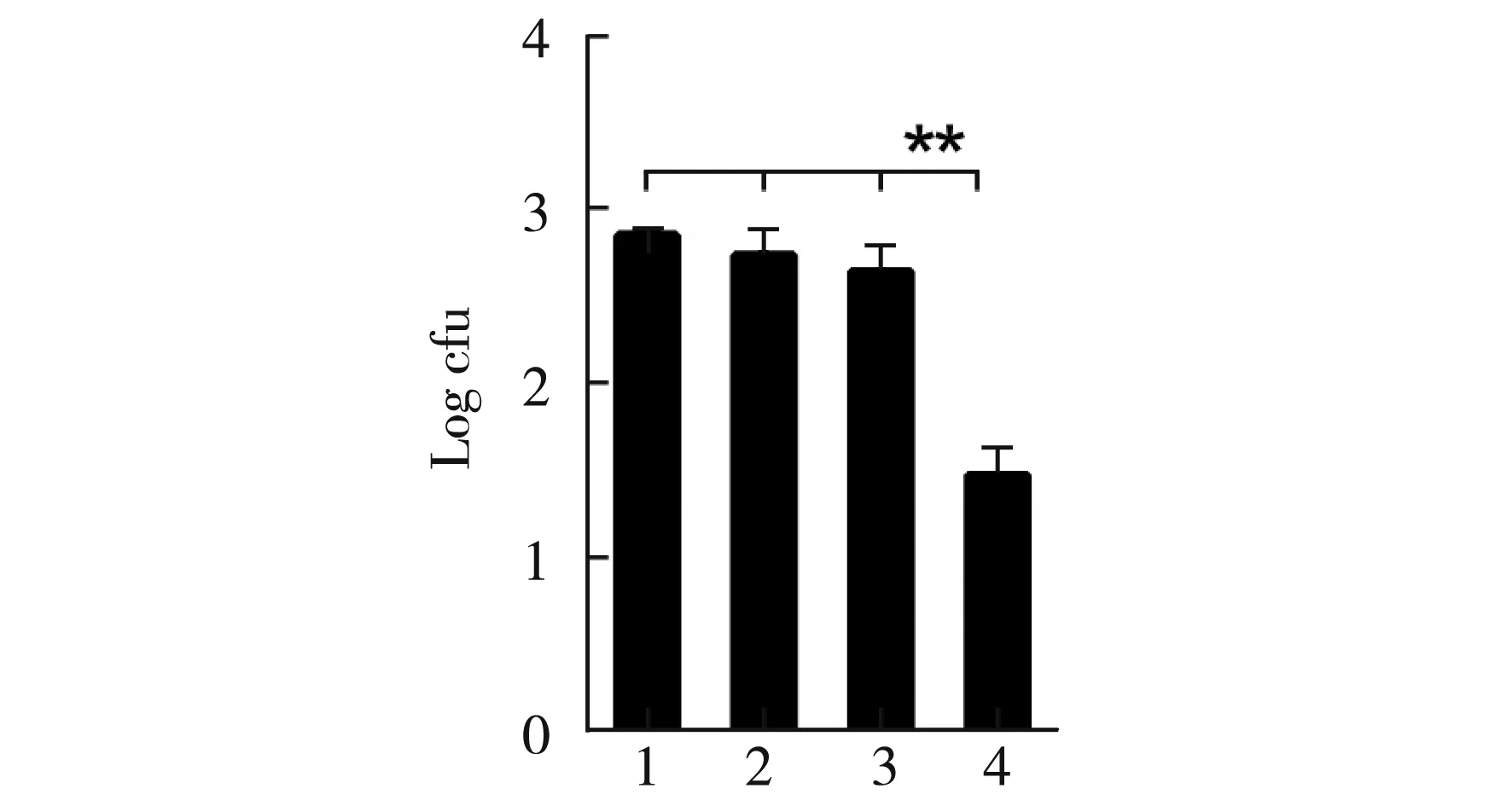
图4 细胞浓度对转化率的影响
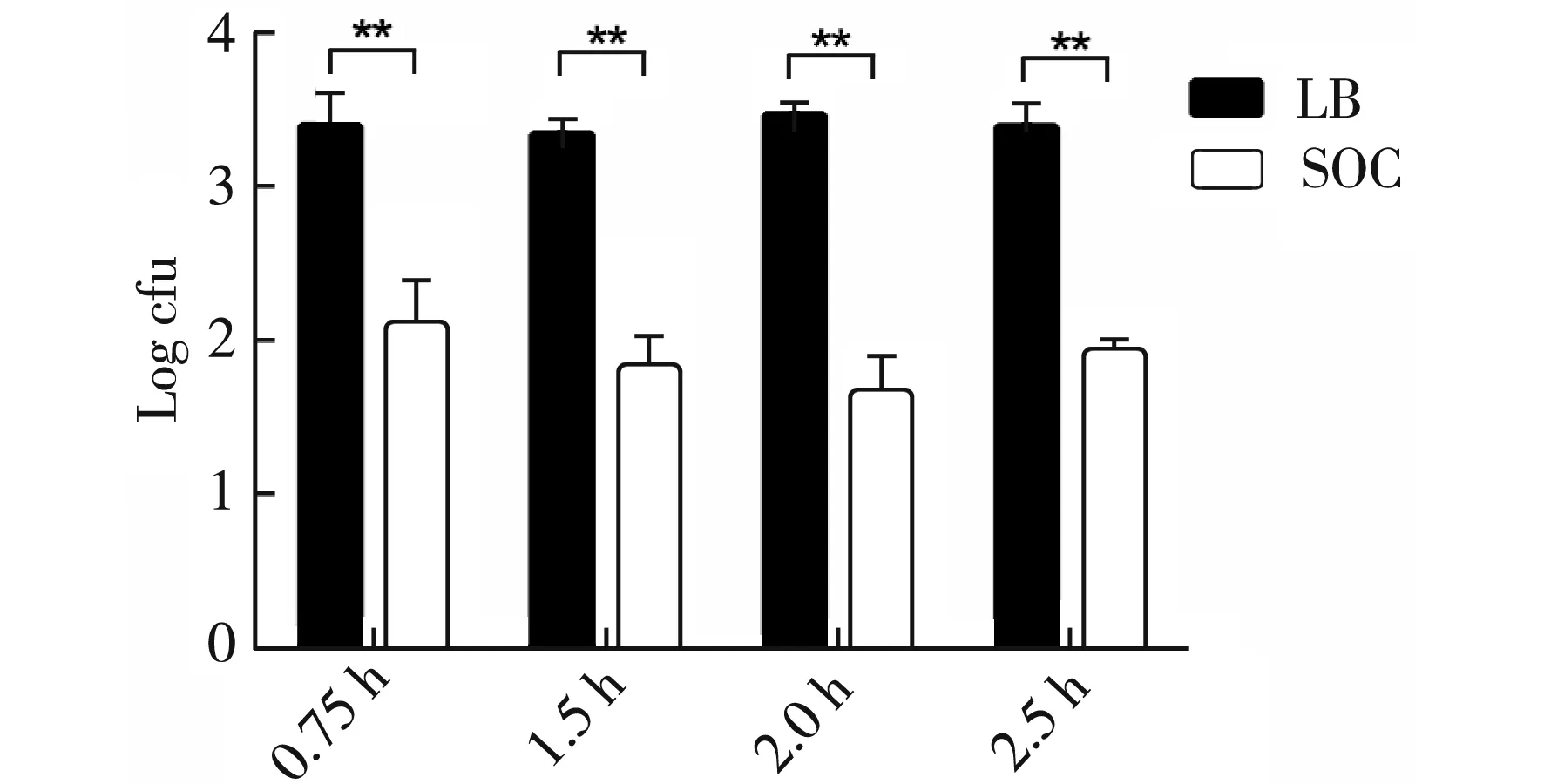
图5 TG1转化时间及复苏液对转化率影响结果
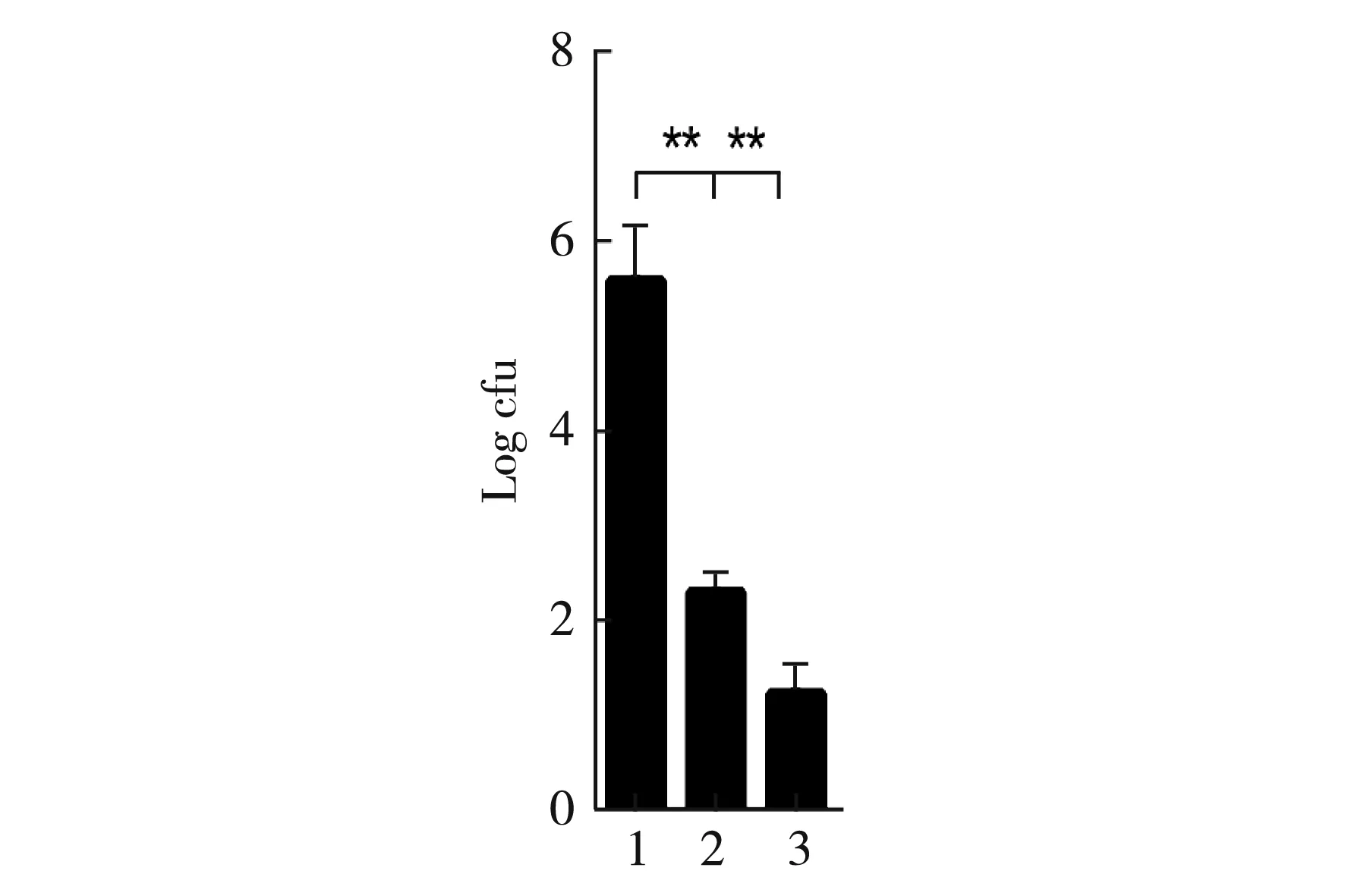
图6 电转化条件对转化率的影响
2.3 TG1菌株在不同生长阶段对电转化率的影响
分别取活化后1.5 h、2.0 h、2.5 h、3.0 h、3.5 h的大肠杆菌TG1菌液制备感受态细胞,电转化,进行菌落计数,结果见图3,经统计学分析,各组间差异极显著(p<0.01),因此在活化后3.0 h时,其电转化效率最高。
2.4 感受态细胞浓度对转化率的影响
取活化后3.0 h菌液制备感受态细胞,以10%无菌甘油水稀释制备好的感受态细胞,电转化后确定不同感受态细胞浓度对转化效率的影响,结果见图4。经统计学分析,1组(1∶1倍稀释)、2组(1∶3倍稀释)、3组(1∶5倍稀释)之间结果无显著差异(p>0.05), 1组、2组、3组与4组(1∶7倍稀释)之间结果差异极显著(p<0.01),试验以1∶1倍稀释浓度为最佳操作条件。
2.5 电转化后复苏培养液及复苏时间对转化率的影响
选用LB和SOC不同复苏液对电击后感受态细胞进行复苏,结果见图5。用LB复苏液复苏电击后细胞效果明显优于SOC复苏液,经统计学分析,差异极显著(p<0.01)。
选取LB复苏液后分别摇动0.75 h、1.5 h、2.0 h、2.5 h后,从图5看出并经统计学分析,不同复苏时间对转化效率没有影响。经统计学分析,差异不显著(p>0.05),因此试验选用电击后复苏0.75 h。
选取SOC复苏液后分别摇动0.75 h、1.5 h、2.0 h、2.5 h后,从图5看出并经统计学分析,差异不显著(p>0.05),不同复苏时间对转化效率没有影响。因此试验选用电击后复苏0.75 h。
2.6 电转化条件对转化率的影响
分别设定三组不同电击参数及不同厚度电击杯,确定其对转化效率影响,结果见图6。从图中可以看出第1组即电压1 800 V,电容25 μF,电阻200 Ω,电转化效率最高,并经统计学分析,1组与2组、3组间差异极显著(p<0.01),为最佳电转化参数。
2.7 质粒浓度的改变对转化率的影响
选取100 ng/mL、 50 ng/mL、25 ng/mL不同浓度的pDJ01质粒2 μL与100 μL感受态细胞充分混合后,从图7看出100 ng/mL pDJ01质粒转化效率最佳,经统计学分析,1组与2组、3组间差异极显著(p<0.01),为最佳质粒浓度。
2.8 抗生素浓度对转化率的影响
向LB固体培养基中分别添加10 μg/mL、20 μg/mL、40 μg/mL浓度的氯霉素,从而确定不同浓度抗生素对转化效率的影响。结果见图8,抗生素浓度为20 μg/mL时转化率最高,恰好适宜转化后的细胞增殖并抑制杂菌生长,经统计学分析,1组与2组、3组间差异极显著(p<0.01),在氯霉素含量为20 μg/mL的条件下,转化效率最高。
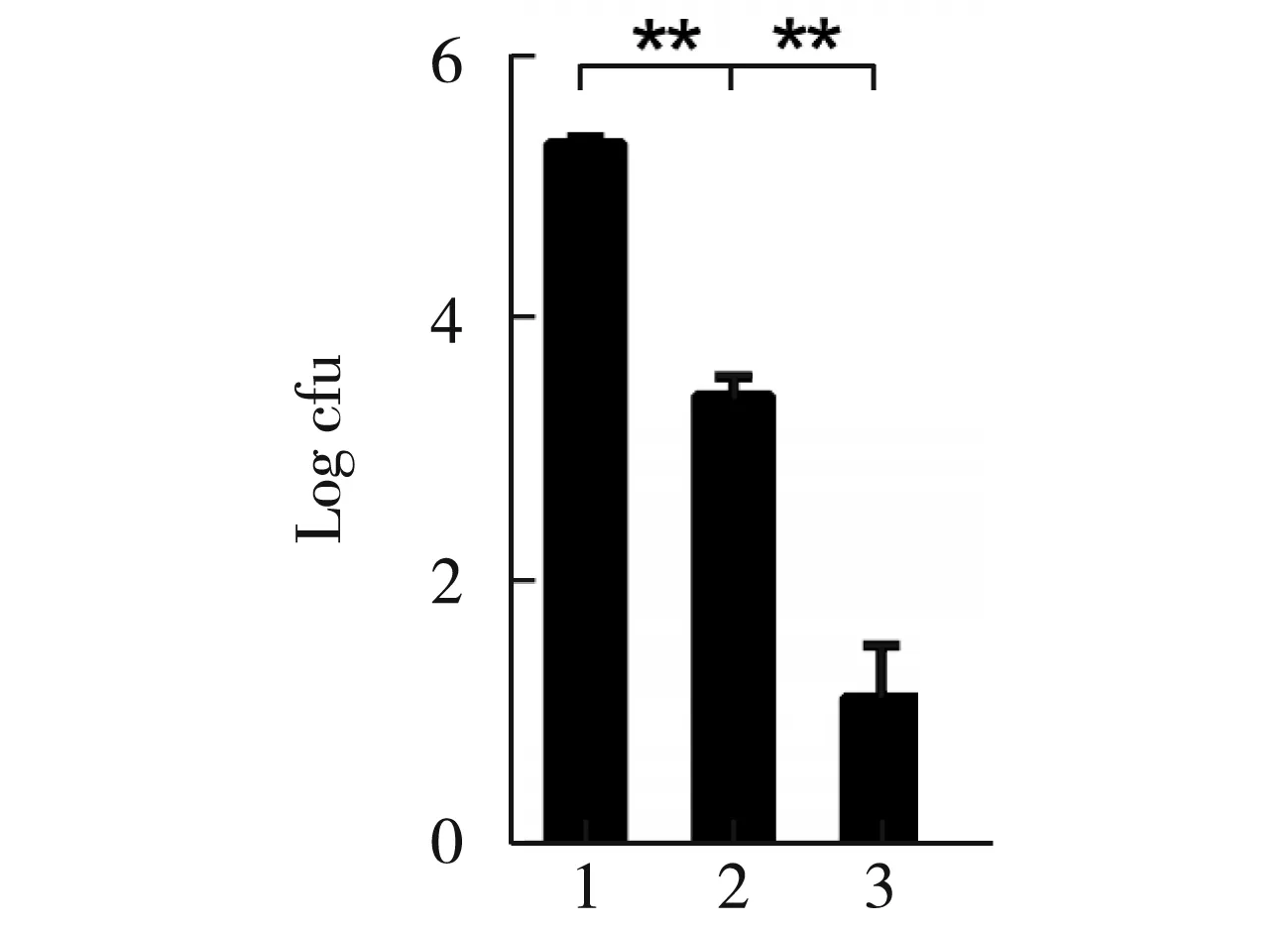
图7 质粒浓度的改变对转化率的影响
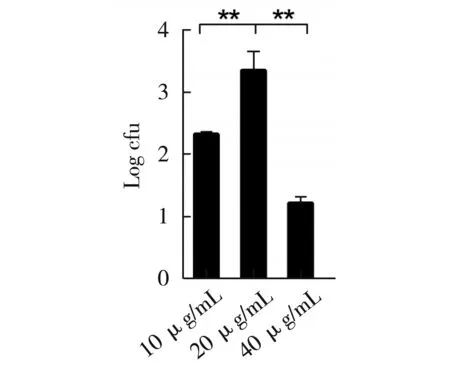
图8 抗生素浓度对转化率的影响
3 讨 论
感受态细胞的制备和转化已经成为分子生物学实验中的一项常规操作,常见转化方法包括电转化法、MgCl2-DMSO法、LiAc和 CaCl2法等,而电转化法相对成本较低、操作简单、转化效率较为理想,转化条件因实验室不同,结果也不尽一致,而且不同的菌株对电转化的反映程度不同,所用的转化效率和转化条件一定不同[5-8]。研究对大肠杆菌TG1转化条件进行了探索,为后续平端连接以及建库打下良好的基础。
电压是决定电转化效率的重要参数,通过运用高电压将细胞的细胞壁电击出可以使大分子物质通过的小孔。由于利用强电压对细胞进行电击将会对细胞造成极大的损伤,在此过程中会使较多的细胞受损死亡以及生存受限而难以得到高转化率,并且死亡的菌体会严重影响细菌的生存空间从而限制其生长。因此,严格选择适宜的电压是进行电转化试验时,达到预期效果和必需条件的重点。经过试验摸索最适电压为1 800 V,此电压电击转化率最好。
研究对SOC、LB两种复苏液的效果也进行了比较。SOC复苏液营养物质含量较LB更加丰富,但其对电击后细菌的生长并没有明显促进作用,即使在复苏过程中,菌体沉淀量远多于LB复苏液,事实上并没有在转化率上体现出来,分析其原因可能是因为SOC复苏液丰富的营养,相对而言只加速了未受损细胞的生长速度,而对转化率则没有明显促进作用[9]。这与黄学娟,张金迪,张壮等人的研究不符,其原因可能是由于试验条件与环境不同而造成的差异。
4 结 论
在本实验室条件下大肠杆菌TG1株感受态细胞最优制备条件为:TG1大肠杆菌母液按照1∶100导入新鲜LB液体培养液后, 37 ℃、170 rpm/min活化培养3 h,感受态终浓度1.4×107,复苏液选用LB液体培养液,复苏时间为3.0 h;最佳电转化条件:为电压1 800 V,电容25 μF,电阻200 Ω,pDJ01质粒浓度为100 ng/μL,氯霉素浓度20 μg/mL。
