支气管镜下介入方法联合治疗良性中心气道狭窄
2018-10-10刘湘泸宋卫东
涂 力 汤 洁 刘湘泸 宋卫东 徐 平
(北京大学深圳医院呼吸内科,深圳 518000)
良性中心气道狭窄是指气管、左右主支气管及右中间段支气管因各类良性病变引起的气道狭窄,可导致不同程度的呼吸困难甚至窒息死亡[1]。既往以外科手术治疗为主,随着呼吸内镜技术的迅速发展,呼吸内镜成为治疗良性气道狭窄的方法之一[2]。但治疗中采用的热消融及机械牵拉容易气道撕裂、穿孔、出血等并发症以及医源性损伤造成瘢痕狭窄,导致远期再狭窄。而冷冻治疗对软骨等含水量少的组织几乎没有损伤,在气道组织中,冷冻治疗不刺激肉芽及瘢痕组织增生,治疗后不易复发。为了解支气管镜下不同方案治疗良性中心气道狭窄的疗效及不良反应,对经支气管镜介入治疗的63例良性中心气道狭窄进行回顾性分析,现报道如下。
1 临床资料与方法
1.1 一般资料
收集我院2011年4月~2017年4月良性中心气道狭窄病例。选择标准:①经支气管镜确诊为中心气道内肉芽增殖、瘢痕所致的良性狭窄;②可耐受支气管镜检查及介入治疗。排除标准:①合并严重基础疾病、重要脏器功能衰竭、凝血功能异常;③气管软化型狭窄;④良、恶性气道肿瘤;⑤其他特殊非瘢痕病变,如气管骨化病、淀粉样变、复发性多软骨炎;⑥病例资料不全。
共入选63例,男24例,女39例。年龄15~78岁,平均35岁。病因:气管、支气管结核感染47例,气管插管后7例,异物取出后4例,外伤后2例,气管切开后2例,气管切除术后1例,其中10例有2处或以上中心气道狭窄病变。均有呼吸困难、喘息、咳嗽、咳痰、胸痛、间断发热、咯血,可闻及局限性干湿性啰音,呼吸音减弱。
早期采用支气管镜下电刀+球囊治疗,逐渐开始联合冷冻,后期基本均联合冷冻。支气管镜下联合电刀+球囊扩张+冷冻治疗36例为A组,中心气道狭窄41处;支气管镜下电刀+球囊治疗27例为B组,中心气道狭窄部位32处。
术前常规体格检查、三大常规检查、心电图、肝肾功能、凝血功能、胸部CT、肺功能及血气分析检测。通过CT三维重建及镜下测量中心气道狭窄的程度及长度。狭窄程度按狭窄横断面积占正常气管横断面积的百分比分为6级[1]:1级,狭窄程度<25%;2级,26%~50%;3级,51%~75%;4级,76%~90%;5级,>90%,几近完全闭塞;6级,完全闭塞。狭窄长度分为4级[1]:1级,狭窄长度<1 cm;2级,1~3 cm;3级,3~5 cm;4级,>5 cm。呼吸困难分级采用改良英国医学研究委员会(mMRC)标准[3,4]:0级,仅在费力运动时出现呼吸困难;1级,平地快步行走或爬小坡时出现气短;2级,由于气短,平地行走时比同龄人慢或者需要停下来休息;3级,在平地行走100米左右或数分钟后需要停下来喘气;4级,严重呼吸困难以致不能离开家,或在穿衣服、脱衣时出现呼吸困难。2组年龄、性别、呼吸困难分级、中心气道狭窄部位、程度、长度比较无显著差异(P>0.05),具有可比性,见表1。
A组:支气管镜下电刀+球囊+冷冻,包括36例41处病变;B组:支气管镜下电刀+球囊,包括27例32处病变狭窄部位:a.声门下;b.气管;c.双侧主支气管;d.右主支气管;e.右中间段支气管;f.左主支气管
1.2 方法
1.2.1 设备仪器 日本Olympus BF-IT240电子支气管镜;美国BostonScientific公司CRE球囊导管,球囊直径6~15 mm,长30~55 mm;Olympus高频电发生器及配套的圈套器和电针;德国ERBE冷冻治疗仪及软式可弯曲冷冻探头,直径分别为1.9 mm、2.4 mm,探针末端长度10 mm,冷源为液态CO2,冷冻探头温度可达-89 ℃。
1.2.2 治疗方法 术前禁食禁饮6 h,仰卧位。麻醉方法:常规2%利多卡因术前局部雾化吸入+术中局部喷注,咪达唑仑+芬太尼静脉镇静镇痛。给予吸氧、监测生命体征。完成常规支气管镜检查后,再行介入治疗处理气道狭窄,A组支气管镜下高频电刀+球囊扩张+冷冻,B组支气管镜下高频电刀+球囊扩张。
高频电刀治疗:负极板置于小腿处,连接高频电刀主机与负极板,将电刀或电圈套器经支气管镜的活检孔道插入,支气管镜到达病变部位,根据病变情况,对显著瘢痕狭窄或肉芽肿导致的狭窄气道使用电刀或电圈套器进行环行或纵行切割或圈套,电切功率35~40 W。切割时由浅入深,每次2 mm,持续3~5 s,直至肉芽肿和瘢痕导致的狭窄处管腔增大到可以通过球囊或冷冻探头,再将肿物及坏死物通过支气管镜负压吸出,异物钳或冷冻探头回收。
球囊导管扩张:经高频电刀或冷冻处理瘢痕狭窄气道后,根据狭窄部位、长度及狭窄程度选取略小于支气管正常管径的高压球囊扩张导管,经支气管镜的活检孔道插入,送至气道狭窄段的中心部,用压力泵向球囊内加压,压力选择3~8 atm(1 atm=101.325 kPa),压力由低至高,逐步递增,维持1~2 min,监测生命体征,有缺氧、呼吸困难时及时将球囊退出。如无明显出血及胸痛,可反复填充球囊加压3~5次,管腔直径明显增大,操作获得即时效果。
冷冻治疗:可以在球囊扩张前,也可以在球囊扩张后进行,方法:①经高频电刀处理病变部分后,连接冷冻主机与冷冻探头,将冷冻探头经支气管镜的活检孔道插入,伸出至支气管镜远端0.5~1.0 cm,将探头的金属末端置于病灶上或深入病灶内,使用探头顶端或探头的侧壁对病灶进行处理。对肉芽组织实施冻切或冻融,切割后瘢痕边缘组织冻融。探头的顶端有冰球形成后,持续冷冻时间30 s~2 min,对较大的病灶设定几个冷冻点,每个点反复1~3次,直至病灶的可见部分完全被冷冻。②在球囊扩张原狭窄气道开放后,可见到之前未发现的肉芽组织,可再次用冷冻处理这些新发现的病变。
1.2.3 术后处理及疗效判断 术后1周、2周、4周、8周、半年、1年复查支气管镜,根据病情变化适当调整间隔时间,再次治疗,若管腔扩大,镜下病变稳定,同时临床症状、呼吸困难好转并稳定,就仅做支气管镜检查,而不做介入干预。
术后即时、3个月、12个月进行疗效评价。气道狭窄再通的疗效标准[5]:缓解,临床症状完全消失,管径恢复到原径的2/3或以上;部分缓解,临床症状得以有效改善,管径恢复到原径的1/3~2/3;无效,临床症状无改善,腔内病灶及管径未改变或<1/3。
采用mMRC标准对术前和术后即时、3个月、12个月的呼吸困难程度进行评估和比较。
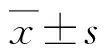
2 结果
63例共进行325次治疗。A组36例(电刀+球囊扩张+冷冻),治疗次数2~7次,(4.6±2.1)次;B组27例(电刀+球囊扩张),治疗次数3~10次,(6.1±3.3)次。A组治疗次数较B组少(t=-3.240,P=0.030)。患者均能耐受,未发生大出血、气道壁穿孔、纵隔气肿等严重并发症。2例A组及12例B组因坏死物、分泌物及水肿出现呼吸困难,经支气管镜吸出坏死物、分泌物,全身使用糖皮质激素后缓解,A组不良反应显著少于B组(χ2=13.500,P=0.000)。
2组术后即时气道狭窄再通疗效(表2)、呼吸困难改善(表3)方面无统计学差异(P>0.05);术后3、12个月A组气道狭窄再通疗效、呼吸困难改善均优于B组(P<0.05),1年总有效率(缓解+部分缓解)A组97.2%(35/36),B组96.3%(26/27)。A组术后肉芽肿较快形成稳定非挛缩样瘢痕,管腔扩大并维持稳定(图1、图2)。B组术后易出现黏膜水肿、肉芽肿及管腔再狭窄(图3)。
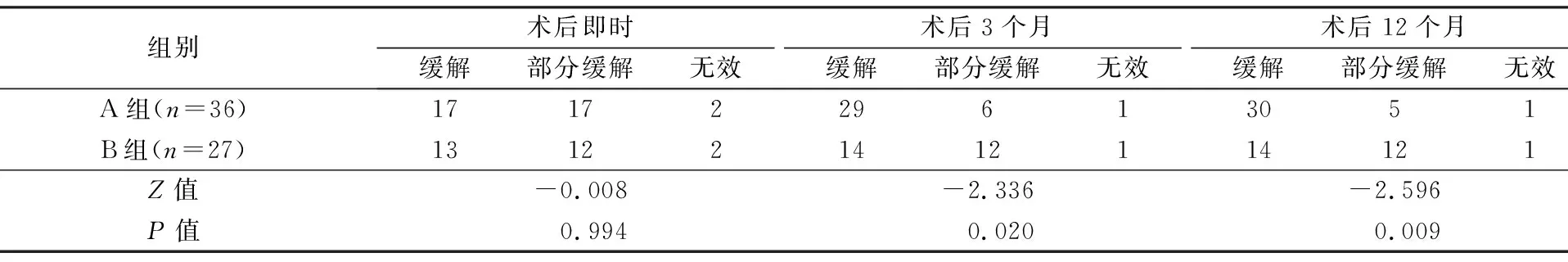
表2 2组术后疗效比较[n(%)]
A组:支气管镜下电刀+球囊+冷冻;B组:支气管镜下电刀+球囊
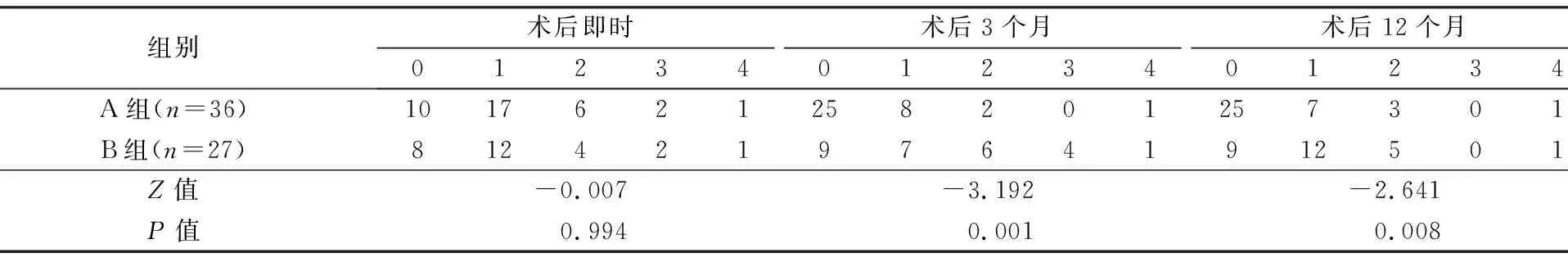
表3 2组术后呼吸困难mMRC分级的比较
A组:支气管镜下电刀+球囊+冷冻;B组:支气管镜下电刀+球囊
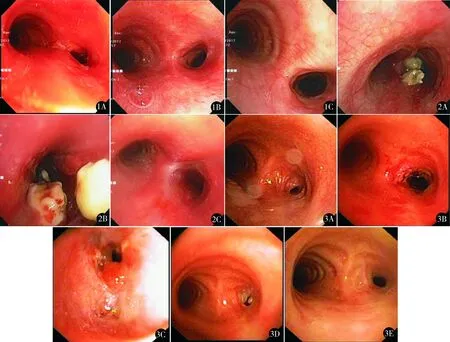
图1 A组病例1 A.右主支气管狭窄5级;B.用电刀切开、冻融、球囊扩张后,即时缓解;C.3个月后右主支气管部扩大到原径2/3,缓解 图2 A组病例2 A.右主支气管坏死物、肉芽增生,瘢痕增生,管腔狭窄5级;B.用冻切、球囊扩张后,即时缓解,反复以上治疗;C.3个月后右主支气管黏膜光滑,管径恢复到原径,缓解 图3 B组病例 A.右主支气管狭窄5级;B.用电刀切开并用球囊扩张,即时缓解;C.1个月后右主支气管肉芽,电刀及球囊治疗;D.半年后复查,仍有肉芽组织,电刀及球囊治疗;E.1年后右主支气管部扩大到原径的1/3,部分缓解
3 讨论
良性中心气道狭窄病因较多,包括支气管结核、气管切开或插管术后、支气管切除、外伤、异物、良性肿瘤等[5,6],通常为瘢痕挛缩和肉芽肿形成,还有小部分气管软化、气道塌陷。近年来,微创介入技术快速发展,已经成为治疗中心气道狭窄的主要方法[7,8]。良性中心气道狭窄常用的治疗方法有电刀、氩等离子凝固、激光等热消融,冷冻,以及球囊、硬质气管镜及气管插管扩张等,对反复瘢痕形成还通过腔内放疗、局部注药、放置涂抹药物的支架治疗,但瘢痕的治疗仍是一个难题。
经支气管镜球囊扩张主要用于良性瘢痕病变所致中心气道狭窄,对于病程短、气道轻度狭窄、气管狭窄长度短的患者效果较好,但对病程长、气道重度狭窄、气道狭窄较长的患者效果差,常易复发。
高频电刀可用于气道内良、恶性肿瘤和瘢痕性气道狭窄。连接针形电刀和圈套器可对气道瘢痕进行切割、松解,套扎新生物,设备简单,治疗费用低[9],适合大多数医院开展。可引起的不良事件包括血管损伤导致大出血、气道穿孔、气道内燃烧等,其发生与术者的经验有关,同时高频电刀术后气道常再发瘢痕狭窄,远期疗效不佳。
瘢痕的治疗一直是良性气道狭窄的关键,热消融、机械牵拉对瘢痕有较快的即时效果,但维持时间短。冷冻治疗是根据焦耳-汤姆逊阀制冷原理,释放高压的CO2气体,在局部产生-80 ℃的低温,使病变组织细胞中水分子快速结晶死亡并被溶解,还使局部血流停止、血管内微血栓形成引起细胞坏死或凋亡,使增生的肉芽及瘢痕组织坏死、脱落[10]。冷冻治疗适用于气道内良、恶性肿瘤,异物肉芽肿清除,坏死组织清除等[11,12]。Abdel-Meguid等[13]研究表明,将冷冻剂注入皮肤瘢痕疙瘩组织内,经1年随诊,瘢痕疙瘩的体积平均减少63%。接触性冷冻法和注入性冷冻法治疗皮肤瘢痕,病变组织内的血管内皮生长因子(VEGF)和肌腱蛋白C的表达均下调,注入性冷冻法更优于接触性冷冻法。由于冷冻治疗对软骨等含水量少的组织几乎没有损伤,因此对气道内组织进行冷冻治疗引起气道穿孔的危险性极小,治疗后也不会引起管壁塌陷狭窄及气胸、心律失常等并发症,安全性较高。在气道组织中,冷冻治疗不刺激肉芽及瘢痕组织增生,治疗后不易复发。但是冷冻治疗起效较慢,操作时间长,不适合重度狭窄及紧急解除气道狭窄,对已经形成的瘢痕挛缩松解效率低,冻切时易出血,因需要反复拔出内镜,导致出血阻塞气道风险较高。
各种治疗方法各有优缺点,良性中心气道狭窄治疗中,如何根据病变选择介入技术,从而达到更好的治疗效果、减少并发症,需要进一步研究。本研究对瘢痕及肉芽肿狭窄导致的中心气道狭窄进行回顾性分析,使用热消融、机械扩张后1年总有效率(缓解+部分缓解)联合冷冻治疗组为97.2%(35/36),未联合组为96.3%(26/27),2组绝大部分患者可以取得较好效果。同时,联合冷冻治疗组术后3、12个月狭窄管腔的扩大程度更高,气道通畅维持的稳定性更高,提示冷冻治疗对于瘢痕形成和管腔再狭窄有抑制作用。我们分析其原因为,虽然高频电刀、球囊扩张可以即时开通气道,快速缓解阻塞,但是这些操作本身可以导致损伤后再次肉芽致瘢痕形成,易导致再狭窄,而使用电刀、球囊扩张、冷冻,可减少热消融后组织水肿及瘢痕形成,有效减少医源性损伤再度狭窄,对维持治疗的稳定性有很好的作用。
综上所述,我们认为对于良性中心气道狭窄,采用联合使用电刀、球囊扩张,同时利用冷冻技术处理损伤创面,疗效确切,安全,并发症少。
