腹腔镜与经骶尾部入路手术治疗良性直肠后肿瘤的比较
2018-10-10周皎琳邱辉忠王琦璞林国乐陆君阳孙曦羽牛备战张冠南
周皎琳 吴 斌 邱辉忠 王琦璞 肖 毅 林国乐 陆君阳 孙曦羽 牛备战 张冠南 徐 徕
(中国医学科学院北京协和医院基本外科,北京 100730)
直肠后肿瘤生长于直肠后间隙,也称“骶前肿瘤”。虽为罕见病,但种类众多,成人以发育性囊肿(包括表皮样囊肿、皮样囊肿、尾肠囊肿及囊性畸胎瘤等)相对常见,女性多发(男女性别比 1∶1.8~1∶15)[1~4]。儿童骶尾部畸胎瘤的恶性率高达20%[5],成人直肠后发育性囊肿多为良性[2,3]。直肠后肿瘤常深埋盆底,最多见的发育性囊肿常体积巨大,跨越盆底肌生长,并与尾骨前方紧密粘连。传统开腹手术不仅创伤大,且难以显露肿瘤,经典的术式为经骶尾部入路手术[2,4,6]。1995 年Sharp等[7]报道第1例腹腔镜良性直肠后肿瘤切除术,此后出现一些个案及小样本研究[8~12]报道,最多12例[9]。本研究对我科腹腔镜与传统经骶尾部入路2种术式进行比较,总结我科手术治疗的经验与教训。
1 临床资料与方法
1.1 一般资料
1990年9月~2015年9月我科采用单纯经骶尾部入路或腹腔镜手术治疗良性直肠后肿瘤68 例(排除脊膜膨出、恶性病变以及接受经腹入路或联合入路手术的病例),其中1990年9月~2012年2月36例行单纯经骶尾部入路手术(骶尾入路组),2012年9月~2015年9月32例行腹腔镜手术(腹腔镜组)。男12例,女56例,男∶女=1∶4.7。年龄15~75岁,中位年龄33.5岁。42例无明显症状,在体检中行超声、CT 或核磁共振检查时被偶然发现,26例有非特异性症状,包括下腹或骶尾部坠胀感20例次,大便费力11例次,小便不畅3例次。63 例肛诊扪及直肠后方或后侧方肠壁外肿物,32例质软,26例质韧,其余 5 例质地不详(病历未描述)。9 例骶尾部见皮肤隆起包块或结节,其中 3 例出生时即存在。根据超声、CT 或核磁共振结果,肿瘤最大径线 2.5~15.0 cm,(8.0±2.7)cm,下缘距肛缘距离 2.0~7.0 cm,(3.5±1.5)cm。18例既往曾接受24例次病灶切除术(开腹手术14例次,后路手术7例次,腹腔镜手术3例次),其中6例曾接受2次手术。上述手术均以根治性切除为目的,术中大多未能彻底切除肿瘤,甚至仅行探查术。除3例次幼年期接受的后路手术外,其余21例次既往手术均在术后短期(3年)内发现肿瘤再现;15例明确报告未彻底切除肿物,甚至仅行引流术或探查术。2组一般资料无统计学差异(P>0.05),有可比性(表1)。
病例选择标准:①良性直肠后肿瘤(肿瘤大小、上下界、与骶尾骨位置关系不限);②除外脊膜膨出,其余病理类型不限;③年龄>14周岁,不超过75周岁。
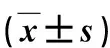
表1 2组患者一般资料比较
1.2 方法
1.2.1 腹腔镜手术 取截石位,采用五孔法 (术者站立于患者右侧,10 mm 观察孔位于脐上缘,10 mm 主操作孔位于右侧髂前上棘内侧偏下,3个 5 mm 辅助操作孔分别位于左、右脐旁腹直肌外缘及左侧髂前上棘内侧偏下)。提起上段直肠及其系膜,超声刀切开其右侧后腹膜,寻找到位于直肠系膜筋膜与盆腔壁层筋膜之间的疏松间隙(Toldt’s 筋膜间隙)。沿间隙向对侧及盆腔方向解剖游离,过程中注意保护输尿管及盆腔自主神经。向前上方牵引、推开直肠及系膜(必要时可切开直肠两侧的后腹膜以利手术显露),继续沿间隙向盆底游离,显露肿瘤头端。剥开表面的结缔组织,找到肿瘤真包膜并沿其仔细游离(图1A)。许多巨大的发育性囊肿跨越盆底肌生长,此时需切开其附着的肛提肌纤维,进入坐骨直肠窝以游离肿瘤的尾端,直至将其完整切除( 图1B~D)。将肿瘤装入腔镜取物袋,自延长的主操作孔取出。冲洗手术野,放置盆腔引流管1根。
1.2.2 经骶尾部入路(后入路)手术 俯卧折刀位(Jackknife 体位)。取后正中线或经骶尾旁切口。切开皮肤、皮下层,游离显露肛尾韧带,离断之,使尾骨游离。切开盆底肌(部分耻骨直肠肌、耻骨尾骨肌、髂骨尾骨肌),直至进入直肠后间隙。对于大而位置高的病灶,可切除尾骨甚至一侧远端骶骨,以增加术野显露。对于向肛侧延伸的肿物,必要时可切开肛门外括约肌,于括约肌两断端缝线做标记,便于后续进行 “点对点” 缝合重建。沿肿瘤的真包膜游离,将其与周围结构分离,切开其与骶尾骨前方结缔组织的致密粘连,直至将其完整切除。逐层缝合重建盆底肌、外括约肌(切开者)。对于尾骨切除者,尾骨残腔留置引流管1根,接负压引流。
1.3 统计学处理
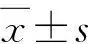
2 结果
2.1 术后病理情况
68例直肠后肿瘤术后病理均为良性病变,包括表皮样囊肿31例(45.6%)、皮样囊肿4例(5.9%)、尾肠囊肿2例(2.9%)、囊性畸胎瘤27例(39.7%)、神经鞘瘤3例(4.4%)、平滑肌瘤1例(1.5%)。
2.2 围术期情况
2 组手术时间、术中出血量差异无统计学意义(P>0.05),骶尾入路组术后住院时间明显长于腹腔镜组,术后切口感染率明显高于腹腔镜组(切口感染经换药后逐渐愈合),见表2。腹腔镜组2例发生迟发性直肠穿孔,分别于术后第4、5天因发热,经水溶性对比剂直肠造影证实,均立即接受急诊转流性肠造口手术,分别于术后0.5、1 年经直肠造影证实穿孔自愈后,成功接受造口还纳手术。2组患者围手术期死亡率均为0。
2.3 肿瘤根治性疗效
10例失访,58例随访(54.3±36.8)月,其中骶尾入路组28例随访(79.1±38.8)月,腹腔镜组30例随访(31.3±11.0)月。5例术后复查盆腔 CT 或核磁时发现肿瘤残留或复发(腹腔镜组3例,骶尾入路组2例):均为发育性囊肿;腹腔镜组3例均为多囊性病变,术后CT或核磁检查病灶均为位于主病灶尾侧、与其分离的小囊肿,故判断此3例为病变残留(图2);骶尾入路组2例提示术后肿瘤复发的CT片难以追溯,无法判断是肿瘤残留或复发。2 组术后肿瘤残留或复发率差异无统计学意义(P>0.05),见表2。
3 讨论
直肠后肿瘤为罕见病。据国外学者估算,大型医院中每4万~6万入院患者中有1例直肠后肿瘤[1,2]。根据发生来源,直肠后肿瘤可分为先天性、神经源性、炎症性、骨性,转移瘤等,其中约2/3属先天性[2,3]。成人先天性直肠后肿瘤多为良性,其中以发育性囊肿最为多见[10,13~15]。良性直肠后肿瘤生长缓慢,部位隐匿,常无明显症状,不少患者是在接受超声、CT、核磁等影像学检查时被偶然发现。直肠后肿瘤生长到较大体积时可出现占位性症状,主要包括骶尾部疼痛及坠胀感、便秘、尿频等,育龄女性中曾有肿瘤阻塞产道导致难产的报道。直肠后囊肿可出现自发性感染,穿刺活检或抽液可造成继发性感染,重时可形成脓肿,甚至囊肿-皮肤瘘或囊肿-直肠瘘[4,16]。少数畸胎瘤、表皮样囊肿等可发生局部恶变[3]。因此,多数观点认为直肠后肿瘤一经诊断应采用积极的手术治疗,即使是无症状的良性病变[2,8,13,14]。本研究 64 例发育性囊肿,至少26例有多囊性特点。基于发育性囊肿的这一特点,术者应在术前仔细阅览CT或核磁片,避免术中遗漏分隔的病变。对于骶尾部皮下的分隔性囊肿,可联合后入路手术予以切除。
由于少见且部位深在,不少外科医生对直肠后肿瘤的手术入路并不熟悉。本研究中不少患者的治疗过程曲折,甚至经历过不止一次失败的手术。国际上,经骶尾部入路为直肠后肿瘤的经典术式。相较于传统开腹手术,后入路手术创伤小、出血少、直达肿瘤部位,尤其适用于深埋盆底且与尾骨前方致密粘连的发育性囊肿[4,16]。但对于体积大、位置高的肿瘤来说,经骶尾部入路手术中肿瘤头侧的显露与游离较为困难。20世纪 90 年代开始,腹腔镜直肠后肿瘤切除术逐渐报道,多为个案或小样本系列研究[7~12]。本研究对腹腔镜与经骶尾部入路手术进行比较,结果显示腹腔镜可达到与后路手术相近的切除彻底性。对于这种深埋盆底且占据狭小空间的肿瘤来说,腹腔镜具有一些独特的优势,其无遮挡、放大的视野以及精巧的手术器械使医生可在深在、狭窄的空间内进行精细解剖,即使对于肿瘤延伸至盆底下方的部分,通常也可以在直视下进行解剖游离。同时,操作更加精细、出血更少,患者术后恢复更快、切口感染率更低。

图1 腹腔镜手术切除直肠后发育性囊肿 A.向侧方推开直肠及其系膜(白色箭头,下同),沿囊肿(黑色箭头)包膜游离其与周围组织的粘连;B,C.对于延伸至盆底肌下方的囊肿(黑色箭头),沿其包膜游离附着的肛提肌纤维(白色星号);D.直至囊肿尾端(黑色箭头)被全部游离切除,显露出盆底肌下方的坐骨直肠窝脂肪(白色五角星) 图2 直肠后发育性囊肿常为多囊性,腹腔镜手术后的一些肿瘤“复发”实际上源于病变尾端分隔性囊肿的手术残留 A.术前 CT 显示1个有多个分隔的多囊性直肠后发育性囊肿;B.术后CT显示右侧盆底肌下方有1个分隔性囊肿残留(白色长箭头),白色短箭头为盆底肌

表2 2组患者术中、术后情况比较
*偏态分布,用中位数(最小值~最大值)表示
**Fisher精确检验
腹腔镜组2例出现迟发性直肠穿孔的严重并发症,均为跨越盆底肌的低位发育性囊肿。由于肛提肌裂孔部位的直肠已无系膜脂肪覆盖(即直肠裸区),同时该部位深在,是术中显露和游离最为困难的地方,直肠壁与肛提肌的肌纤维有时难以辨认。在邻近肠壁进行操作时,超声刀容易对直肠壁造成直接损伤或热灼伤,导致术中或术后迟发性穿孔。通常术中解剖辨认困难时,可由助手进行数次的直肠指诊,挑起肠壁以助辨认正确的解剖层面,必要时通过直肠注气试验来排除肠穿孔。2例在术中检查时均未发现直肠穿孔,术后4~5 d出现迟发性穿孔,考虑很可能源于超声刀对肠壁的热灼伤。鉴于腹腔镜入路的此类风险,近年来,我们对在盆底部位与直肠裸区关系密切的巨大肿瘤采取联合经腹腔镜-骶尾部入路的手术方式,先在腹腔镜下游离肿瘤的头侧部分达盆底,对于解剖、显露困难或邻近肠壁的部分暂不予处理。然后变换体位,采用后入路方式游离肿瘤位于盆底肌尾侧的部分。由于腹腔镜的游离已深达盆底,后路手术一般无须切除尾骨,从而避免术后尾骨窝积液、切口感染、远期尾部痛等并发症。
由于盆腔空间有限,巨大的直肠后发育性囊肿常挤占整个术区,无解剖游离空间。同时,囊肿的部分区域壁薄,且常与周围严重粘连,术中破溃有时难以避免。本研究中2组术中囊肿破裂率均在70%以上。此类情况下,采取人为控制下的囊肿减压(囊肿表面做一小口,吸引器吸出部分囊肿内容物,多为皮脂)是赢得手术空间、助力解剖游离的一种可行手段。经人为控制的良性囊肿减压结合充分的术野冲洗,围手术期并发症率并未明显升高,即使对于存在感染的囊肿亦如此[10,16]。
本研究历史对照具有一定的局限性。虽然2组一般资料差异无统计学显著性(P>0.05),2组手术均由同一个专业组的医生按照相对统一的标准完成,但统计结果偏倚仍不可避免。尤为突出的是,伴随快速康复理念的普及,近年来患者术后住院时间在明显缩短,因而对这一指标的比较结果应谨慎看待。
综上,本研究结果显示对于良性直肠后肿瘤,腹腔镜手术与传统经骶尾部入路手术具有相近的肿瘤根治性效果。同时,腹腔镜入路对于肿瘤头侧部分的显露更加充分、解剖更为精细,具有创伤小、伤口感染率低等优点。对于体积巨大,特别是与盆底部直肠裸区关系密切的病变,腹腔镜手术有一定损伤直肠壁的风险。此时,联合后入路手术有助于更加安全、彻底地切除肿瘤。我们有理由相信,随着微创外科技术的继续进步,高清腹腔镜、单孔腹腔镜[17]、3D 腹腔镜乃至机器人手术[18,19]均有望进一步提高此类肿瘤切除手术的安全性、有效性及微创效果。
