输尿管硬镜与软镜治疗10~20 mm输尿管上段结石的比较∗
2018-10-10顾志文罗发彩张贺庆宋生生詹河涓
顾志文 郑 彬 罗发彩 张贺庆 宋生生 陈 岳 詹河涓
(广东省佛山市禅城区中心医院泌尿外科,佛山 528031)
输尿管上段结石位于输尿管肾盂连接部和骶髂关节上缘之间,临床上较为多见。<20 mm输尿管上段结石最为常见,治疗方法主要有体外冲击波碎石(extracorporeal shock wave lithotripsy, ESWL)、输尿管硬镜(rigid ureteroscopy,R-URS)、输尿管软镜(flexible ureteroscopy,F-URS)或经皮肾镜碎石术(percutaneous nephrolithotripsy,PCNL)等。ESWL治疗效果受到结石成分、大小、有无上尿路梗阻等诸多因素影响,腔内镜治疗输尿管上段结石的疗效确切,近年来逐渐被术者和患者所重视[1]。输尿管硬镜和输尿管软镜是最为常用的2种内镜,可用于输尿管上段结石的治疗,但何种手术方式更为合适目前尚无统一定论,对比研究文献也甚少。本研究回顾性比较我院2014年12月~2016年12月53例输尿管上段结石行R-URS或F-URS碎石术,探讨输尿管上段结石更好的腔内治疗术式。
1 临床资料与方法
1.1 一般资料
本研究53例,主要症状为腰痛42例,血尿5例,体检发现无明显症状6例。2015年12月之前主要行R-URS,2015年12月后主要行F-URS。2组患者一般资料比较无明显统计学差异(P>0.05),具有可比性,见表1。
病例选择标准:经病史、查体、泌尿系超声、静脉肾盂造影、CT等检查证实为输尿管上段结石,均为单侧、单发结石,且结石最大直径10~20 mm。排除患侧肾及输尿管解剖结构异常、输尿管狭窄、肾中重度积水或既往同侧输尿管手术史者。
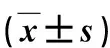
表1 2组患者一般资料比较
1.2 方法
R-URS组:腰麻联合硬膜外麻醉21例,静脉吸入复合麻醉4例。截石位,常规消毒铺巾。F8.0/9.8Wolf输尿管硬镜在F4输尿管导管引导下套入法进入输尿管,缓慢上镜至见到结石,外接科医人钬激光碎石机,导入500 μm光纤,钬激光功率选择1 J、20 Hz,直视下用钬激光将结石击碎成光纤大小,较大的碎石块用取石钳取至膀胱。泥鳅导丝留置F5双J管,退镜,留置双腔气囊导尿管。
F-URS组:腰麻联合硬膜外麻醉23例,静脉吸入复合麻醉5例。截石位,常规消毒铺巾。常规用F8.0/9.8Wolf输尿管硬镜探查患侧输尿管,如果输尿管无狭窄置入Bard镍钛诺导丝,沿导丝置入COOK F12~45输尿管软镜鞘。直视下置入Olympus电子输尿管软镜,发现结石后导入200 μm光纤,外接科医人钬激光碎石机,钬激光功率选择1 J、20 Hz,将结石击碎至光纤大小,较大结石碎片可用镊钛套石蓝取出。术后留置F5双J管、双腔气囊导尿管。
2组术前后2 d静脉使用广谱抗生素。术后第2天拔除导尿管,如患者无发热,拔除尿管后可出院。术后所有患者均予坦索罗辛缓释胶囊(哈乐)0.2 mg/d。术后2~4周拔除双J管,如有结石残留行ESWL或二期手术。
1.3 观察指标
手术时间(从尿道入镜开始至出镜结束),术后住院时间(出院标准:无发热,拔除尿管后可出院),住院费用,术后白细胞增高值(术后第1天与术前血常规白细胞差值),血红蛋白丢失量(术后第1天与术前血常规血红蛋白差值),止痛药使用率[按照疼痛数字等级评定量表(numeric rating scales,NRS)进行疼痛评分,≥4分需要使用止痛药物治疗]以及有无石街形成、发热(>37.3 ℃)、脓毒血症、感染性休克等并发症发生;术后2、4周和半年判定结石清除率。根据《中国泌尿外科疾病诊断治疗指南2014版》[2],无结石残留或残留结石直径≤4 mm为临床无意义残石(clinically insignificant residual fragment,CIRF),且无任何症状,即判定为结石成功清除。术后半年复查B超判断有无术侧肾盂积液,如有行IVU检查进一步明确有无合并输尿管狭窄。
1.4 统计学分析
2 结果
2组患者均一次顺利入镜,手术时间、术后住院时间无明显统计学差异(P>0.05)。R-URS组所有患者均能寻获结石,但7例在碎石过程中部分结石移位至肾内,其中包括位于L3水平以上4例和L3水平以下3例;F-URS组仅1例因术中出血影响视野而未能继续有效碎石,其余均成功碎石,一次碎石成功率96.4%(27/28),显著高于R-URS组72.0%(18/25)(P<0.05)。术后2周11例结石残留,其中R-URL组9例,F-URL组2例,结石清除率分别为64.0%(16/25)、92.9%(26/28),有明显统计学差异(P<0.05),残留结石者包括石街5例,非石街6例行ESWL(R-URS 组5例,F-URS组 1例),R-URS组1例行2次ESWL。术后4周、半年结石清除率R-URS组分别为88.0%(22/25)、92.0%(23/25),F-URS组分别为 96.4%(27/28)、96.4%(27/28),均无明显统计学差异(P>0.05)。住院费用F-URS组显著高于R-URS组,见表2。
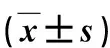
表2 2组术中、术后情况比较
2组患者均无感染性休克、死亡等重大手术并发症发生,在术后疼痛不适、术后发热、术后石街形成等并发症均无明显统计学差异(P>0.05),见表3。石街形成5例,石街长度18~50 mm,(33.7±9.3)mm,拔除双J管后4例石街自行排出,1例辅助ESWL后排出。2组均无发生输尿管撕脱、穿孔、断裂等输尿管严重并发症。R-URS组术中输尿管黏膜挫伤发生率36.0%(9/25),显著高于F-URS组7.1%(2/28) (χ2=6.687,P=0.010),但随访半年无一例发生输尿管狭窄。R-URL组血红蛋白丢失量显著高于F-URL组,无一例需要输血治疗。
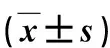
表3 2组手术并发症比较
*偏态分布,用中位数(最小值~最大值)表示
**Fisher精确检验
2.3 典型病例
47岁男性,体检发现右侧输尿管上段结石4年入院,结石大小16 mm,行R-URS,术中部分结石碎片移位至肾内,后形成石街;术后2周拔除输尿管支架管,石街减少;辅助ESWL 1次,随访至术后4周,结石完全清除,见图1。
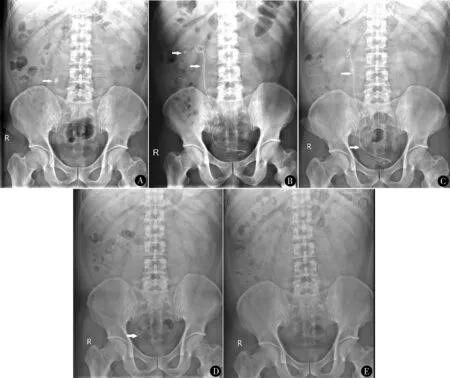
图1 输尿管上段结石R-URS术前后KUB A.术前KUB,箭头示结石位于输尿管上段;B.术后2 d KUB,箭头示结石碎片;C.术后2周KUB,箭头示石街形成;D.拔除输尿管支架管后KUB箭头示石街减少;E.辅助ESWL后,术后4周KUB示结石消失
3 讨论
输尿管上段结石靠近肾脏,位置较为特殊,临床上治疗较为困难。ESWL是治疗输尿管上段结石常用的方法,2017版EAU指南推荐,结石<10 mm时ESWL可作为首选治疗方式,≥10 mm输尿管上段结石ESWL不再作为首选;结石滞留时间超过3个月,容易被肉芽组织包裹,ESWL治疗后结石不仅难易排出,有时反复碎石反而会导致局部水肿,加重梗阻,容易合并泌尿道感染甚至肾功能损害等[3]。近年来,随着泌尿外科微创技术的快速发展,腔内治疗成为了一种常规手段,其中输尿管硬镜和输尿管软镜均为经人体自然腔道的术式,是输尿管结石最为微创的腔内治疗方式。
输尿管软镜治疗上尿路结石,具有创伤小、恢复快、清石率高等优点,曾被认为是输尿管上段结石治疗的首选[4]。但由于输尿管软镜价格昂贵、易损坏且维修困难,目前仅适于处理<20 mm结石,对于这些结石,输尿管软镜自身的损耗较小[5]。Karadag等[6]应用输尿管软镜治疗61例直径为(11.01±2.24) mm的单发输尿管上段结石,术后即刻清石率86.8%,术后3个月清石率93.4%,无输尿管撕脱、脓毒血症等严重并发症。Hyams等[7]对71例直径<2 cm的输尿管上段结石行输尿管软镜联合钬激光碎石,总体清石率为95%,其中<1 cm的清石率更是达100%。本研究F-URS组28例结石直径(14.1±3.3) mm,经输尿管软镜联合钬激光碎石,碎石成功率96.4%(27/28),术后2周结石清除率92.9%(26/28),残余结石行ESWL后,最终结石清除率达96.4%(27/28),疗效显著。
输尿管硬镜比输尿管软镜更早应用于治疗输尿管结石,被认为是输尿管中下段结石的首选治疗方式[8],但是否适用于输尿管上段结石的治疗仍有争议较大。陆佳荪等[9]认为输尿管上段结石距离肾盂较近,结石容易向肾内逃逸,输尿管镜又不能转弯进入各肾盏,处理输尿管上段结石相对困难。唐荣志等[10]认为输尿管镜长度可达肾盂位置,通过一定的手术技巧,L5~L3水平的输尿管上段结石仍可首选这种治疗方式。本研究R-URS组一次碎石成功率72.0%(17/25),显著低于F-URS组(χ2=4.391,P=0.036);R-URS术后2周结石清除率64.0%(16/25),显著低于F-URS组(χ2=6.687,P=0.010),考虑为碎石移位至肾内所致。赵晓风等[11]建议输尿管镜处理输尿管上段结石时,应用取石网篮可阻挡结石移位,提高结石清除率。我们认为钬激光在碎石过程中可能会烧断网篮,甚至造成异物残留,故本研究未采用取石网篮或封堵器进行拦截,术后对残余结石行ESWL治疗,最终总体结石清除率可增高至92.0%(23/25),接近F-URS组(P>0.05),而且住院费用更低(P<0.05)。可见,R-URS治疗输尿管上段结石可行、有效,通过一定的手术技巧,可媲美输尿管软镜的疗效。R-URS处理输尿管上段结石的关键在于:①采取头高脚低体位,使患者膝关节与头部在同一水平,利用结石自身重力减少结石上浮;②术中注意控制冲水压力,可利用50 ml注射器连接输液器由助手手工灌注,保持视野清晰即可;③在碎石过程中,先打通结石远近两端,利用500 μm直径的钬激光光纤压着结石碎块,再由输尿管近端向远端进进一步粉碎,尽可能将结石粉碎至光纤大小,对稍大块的结石尽量钳出,小结石多能自行排出,注意术后需密切随访,对残留结石需ESWL辅助治疗或二次手术。
输尿管硬镜和输尿管软镜的并发症类似,总体发生率2.7%~25%[12,13]。本研究主要为Clavien Ⅰ~Ⅱ级并发症,包括黏膜损伤、腰痛、发热及石街形成,2组均未发生输尿管穿孔、输尿管撕脱、感染性休克等严重并发症。在黏膜损伤和血红蛋白丢失方面,R-URS组发生率显著高于F-URS组(P<0.05),可能是因为输尿管上段结石位置较高,输尿管镜操作路径较长,反复进出输尿管造成黏膜摩擦渗血,输尿管软镜常规放置输尿管软镜鞘,保护输尿管壁,黏膜损伤较轻,出血较少;部分患者术后血红蛋白浓度升高,血红蛋白丢失呈负数,可能是由于术后液体进入减少,血液浓缩所导致。术后石街形成是腔内碎石较为常见的手术并发症,2组发生率分别为8.0%(2/25)、10.7%(3/28),无明显统计学差异(P>0.05),但2组5例石街有4例在输尿管支架管后能自行排出,可能也与文献[14,15]报道的口服α-受体阻滞剂、适当缩短留置双J管时间能促进石街排出有关。F-URS组1例术中合并出血影响手术进展,考虑为钬激光处理息肉过程所致,袁武雄等[16]也有这方面的报道,尤其是钬激光烧灼息肉基底部时,反复的创面渗血不仅影响手术视野,还容易引起输尿管穿孔。输尿管狭窄是输尿管腔内手术潜在的远期并发症,文献报道发生率为4%~7.8%[17,18],主要与输尿管穿孔、输尿管黏膜损伤、黏膜下残余结石等因素有关。2组术后均留置双J管,对黏膜损伤者适当延长双J管留置时间至4周,随访半年未发现输尿管狭窄。
综上所述,对于10~20 mm输尿管上段结石,输尿管镜与输尿管软镜手术均安全可行,其中输尿管软镜结石清除率高,并发症较轻,术后恢复快,辅助治疗率低,可作为首选治疗方式,有条件的医院值得推广。输尿管镜的结石清除率不高,术后往往需要结合ESWL治疗,但因可操作性强,并发症也较少,而且费用较低,在基层医院也可供参考选用。另外,本研究为回顾性研究,样本量较小,有待以后进行大样本的前瞻性研究和更长期的临床随访。
