水稻高秆染色体片段代换系Z1377的鉴定及重要农艺性状QTL定位
2018-10-10崔国庆王世明马福盈向朝中李云峰何光华张长伟杨正林凌英华赵芳明
崔国庆 王世明 马福盈 汪 会 向朝中 李云峰 何光华张长伟 杨正林 凌英华 赵芳明,*
水稻高秆染色体片段代换系Z1377的鉴定及重要农艺性状QTL定位
崔国庆1王世明1马福盈1汪 会1向朝中2李云峰1何光华1张长伟1杨正林1凌英华1赵芳明1,*
1西南大学水稻研究所 / 西南大学农业科学研究院, 重庆 400715;2重庆市丰都县龙孔镇农业服务中心, 重庆 408200
株高是水稻重要的农艺性状, 往往与产量相关性状密切关联, 在水稻育种中有重要利用价值。本研究以日本晴为受体、缙恢35为供体亲本, 经表型和分子标记双重选择, 鉴定了一个水稻高秆染色体片段代换系Z1377。Z1377共含有18个代换片段, 平均代换长度为2.95 Mb。与日本晴相比, Z1377的株高、倒一节间至倒四节间长、穗长、一次枝梗数、二次枝梗数、粒长、每穗实粒数、总粒数显著增加; 粒宽显著变细, 有效穗数、结实率显著减少, 但仍达86.75%。用日本晴与Z1377杂交构建的次级F2群体共检测到16个相关QTL, 分布于第2、第3、第4、第5、第6、第7和第9染色体。其中有8个可能与已克隆基因等位, 如、、等, 另8个如等尚未见报道。Z1377的株高由一个主效QTL ()和一个微效QTL ()控制, 其中的贡献率达28.59%。而且, 在F2群体中, 高秆和矮秆基本呈现双峰分布, 经卡平方测验, 符合3∶1分离比, 表明高秆对矮秆显性, 并主要由负责。这将为该主效基因的精细定位和克隆奠定基础, 同时为进一步选育含2~3个代换片段的中高优良染色体片段代换系并应用于育种奠定基础。
水稻; 染色体片段代换系; 株高; 产量相关性状; QTL定位
自20世纪50年代的水稻“第一次绿色革命”以来, 水稻产量得到大幅提高, 该技术的关键是通过株型矮化以提高收获指数来获取高产。然而, 水稻收获指数目前已经很高, 通过该途径提高产量已较难, 矮秆已成为限制水稻生物量的关键因素。随着科技的高速发展, 通过发展半高秆抗倒品种提高产量已成为重要途径。因此深入挖掘水稻株高发育相关基因, 阐明水稻株高形成的分子机制, 对于水稻株型育种有重要意义。
目前通过克隆水稻株高相关基因, 初步揭示了水稻株高主要由赤霉素(gibberellin, GA)、油菜素内酯(brassionosteriod, BR)和独角金内酯(strigolactones, SL) 3种水稻内源激素调控[1]。“绿色革命”基因编码GA合成途径中的GA20氧化酶[2]。多个调控GA合成途径的基因如[3]、[4]等突变, 使该途径发生障碍, 导致不同程度的水稻矮化。BR是控制水稻株高的第2种关键激素, 能促进茎的伸长。矮秆突变体株高只有10~30 cm, 由控制, 是水稻BR生物合成的一个关键酶, 即BR-6氧化酶, 属于细胞色素P450家族[5]; 矮秆基因的编码蛋白CYP724B1, 也属于P450家族, 通过外源施加BR后可以恢复表型[6]。还有一些基因, 如, 突变后外源施加BR无法恢复表型, 主要通过调控BR传导途径来影响水稻株高[7]。此外, 独角金内酯(SL)也参与调控水稻株高, 如编码类胡萝卜素裂解双加氧酶, 该酶参与SL的生物合成[8]。
株高是遗传复杂的农艺性状, 涉及到大量的基因, 而且往往与产量性状相关联。因而, 目前克隆基因仍不能完全阐明株高发育的分子机制, 有必要发掘新的株高相关基因。尤其, 目前发现的株高突变体, 多数均表现矮秆、穗型和谷粒偏小, 如[3]、[5]、[6]等, 较难直接用于聚合育种。本研究以日本晴为受体亲本、缙恢35为供体亲本鉴定了一个18代换片段的水稻高秆染色体片段代换系Z1377, 全面分析该代换系并进行株高等重要农艺性状QTL定位, 以期为克隆株高等性状的主效QTL奠定基础。
1 材料与方法
1.1 试验材料
18代换片段的水稻染色体片段代换系Z1377以日本晴为受体、缙恢35为供体亲本, 经连续回交自交结合表型和分子标记双向选择选育而成。缙恢35是西南大学选育的优良三系恢复系, 选择其为供体亲本是为鉴定其在测序品种日本晴的遗传背景下代换片段上的优良等位基因。QTL定位群体材料为日本晴和Z1377杂交构建的次级F2群体。
1.2 试验方法
1.2.1 Z1377代换片段鉴定 使用均匀分布于水稻全基因组的429个标记, 进行日本晴和缙恢35的多态性分析, 选出253个多态性标记[9], 然后用这些多态性标记从BC2F1进行分子标记和表型双向选择, 直至BC2F10初步选育成18代换片段的Z1377。参照向佳等[10]描述的方法鉴定代换片段, 当某一标记的检测结果与受体亲本的带型(A)一致时, 认为该段DNA来自日本晴基因组; 当某一标记的检测结果与供体亲本带型(B)一致时, 则认为该段DNA来自缙恢35基因组。连续B标记间所在区段表示代换片段。按Paterson等[11]方法计算代换片段长度。
1.2.2 材料种植方法 2016年以日本晴与Z1377杂交, 收获F1并于同年秋季在海南种植, 并收获F2种子。2017年3月8日, 用亲本(日本晴和Z1377)及F2群体种子于重庆西南大学水稻研究所实验基地育苗。4月15日, 以株、行距分别为16.67 cm和26.67 cm移栽日本晴和Z1377各30株及88个F2单株于同一试验田, 常规管理。
1.2.3 农艺性状调查 Z1377与日本晴的抽穗期相当, 仅晚4 d, 因而QTL定位时没有考察该性状。在成熟期, 平地面收取日本晴和Z1377各10株以及F2群体88株作为样本, 考察株高、有效穗数、各节间长度、穗长、一次枝梗数、二次枝梗数、粒长、粒宽、实粒数、总粒数、千粒重和单株产量。其中, 株高和各节间长度测定每株主穗的长度。穗长、一次枝梗数、二次枝梗数、每穗实粒数和总粒数测定用每株全部有效穗的平均值。千粒重测定, 以日本晴和Z1377各取饱满均匀的3000粒籽粒, 每1000粒作为一个单元在电子天平称重, 重复3次; F2群体每株以200粒作为一个单元称重, 乘以5, 重复3次, 计平均数。以每穗实粒数占每穗总粒数的百分比表示结实率。以粒长与粒宽的比为谷粒长宽比。Microsoft Excel 2003统计10株日本晴和Z1377的上述性状的平均值及F2群体各参数如平均数、最小值、最大值、偏度和峰度, 并进行测验。
1.2.4 分子定位 采用CTAB法提取亲本及用于QTL定位的88个F2单株的DNA。参照向佳等[10]描述的PCR扩增和非变性聚丙烯酰胺凝胶电泳和快速银染的方法。将日本晴带型标以“-1”, Z1377带型标以“1”, 双亲带型标以“0”, 缺失带型标以“.”。将F2的88个单株的各性状平均值及标记赋予值一同用于QTL定位。在SAS统计软件上, 利用加州大学河滨分校徐世忠教授编写的HPMIXED程序限制性最大似然(REML)法(略加修改)定位QTL[12], 以< 0.05为阈值决定一个QTL是否与代换片段上的某标记连锁。
2 结果与分析
2.1 Z1377的代换片段鉴定
用Z1377代换片段上的56个SSR标记及代换片段外的24个SSR标记对10株Z1377进行进一步代换片段鉴定和遗传背景纯度检测, 发现10个单株的代换片段一致, 且没有检测出除代换片段外的缙恢35其他残留片段, 说明Z1377已纯合。Z1377共含有来自缙恢35的18个代换片段, 分布于水稻12条染色体(图1)。总代换长度为53.1 Mb, 最长代换长度为8.2 Mb, 最短代换长度为0.7 Mb, 平均代换长度为2.95 Mb。
2.2 Z1377的农艺性状分析
与受体日本晴相比, Z1377的株高极显著增加(图2和表1)。Z1377除比日本晴多了2个节间(倒五节和倒六节)外, 穗长和其他4个节间长度均显著增加。说明Z1377的株高增加是节间数目和节间长度及穗长共同增加的结果。此外, Z1377的一次枝梗数、二次枝梗数、粒长、实粒数、总粒数显著增加; 有效穗数、粒宽、结实率显著减小, 然而, 其结实率仍达86.75%。Z1377的千粒重和单株重与日本晴无显著差异(表1)。暗示了Z1377中携带了来自缙恢35的多个差异性状的QTL。
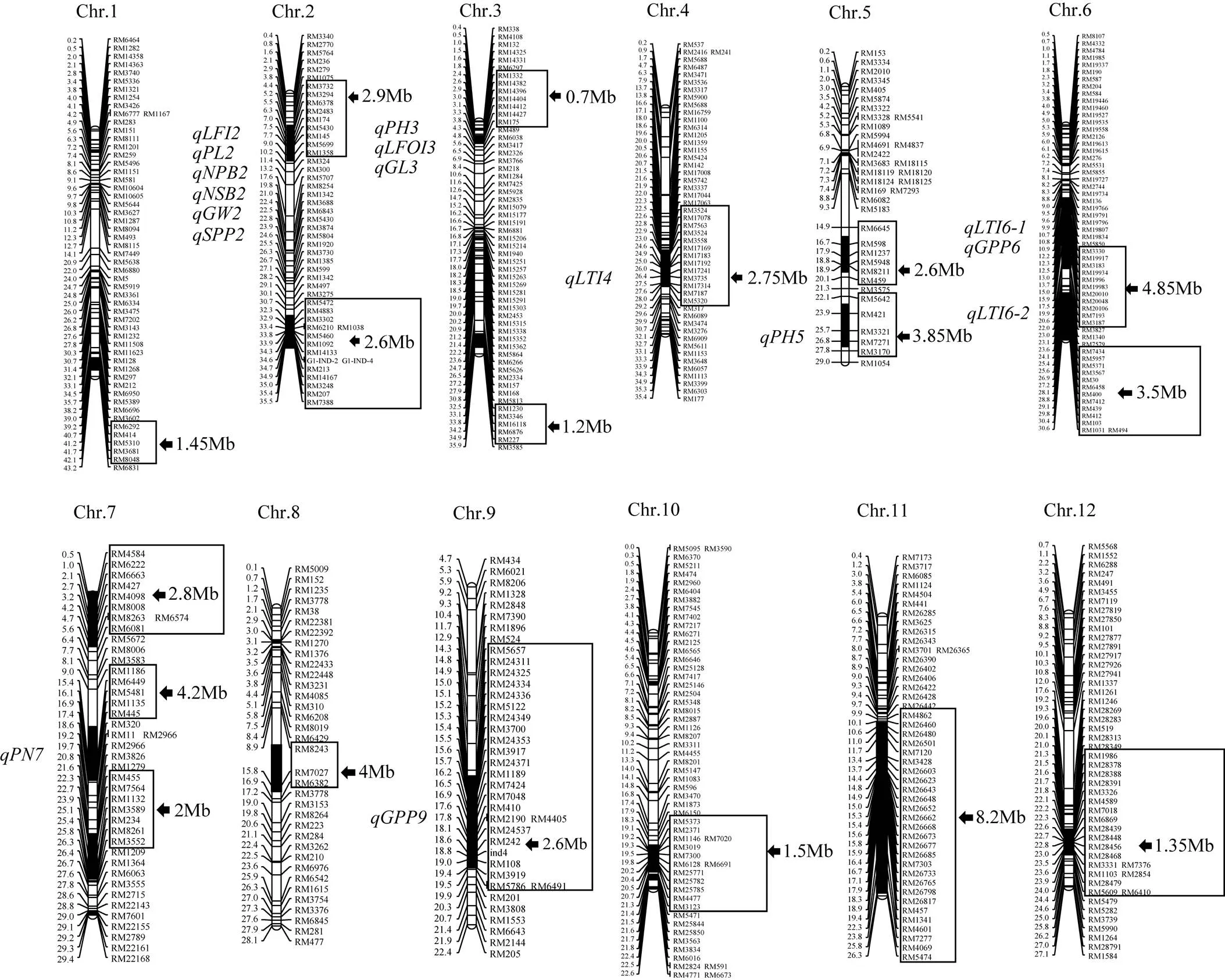
图1 Z1377的代换片段
每条染色体左侧为物理距离(Mb)和定位的QTL; 右侧为标记名称、代换区间(框内标记)和代换长度(黑箭头指向)。
Physical distances (Mb) and mapped QTL are marked at the left of each chromosome; Markers, substitution interval squared by frame, and substitution length (black arrow direction) are displayed at the right of each chromosome.
2.3 Z1377的株高等性状在F2群体的分布和遗传分析
以日本晴为母本与高秆代换系Z1377杂交, F1植株的株高偏高, 说明增加株高可能为显性遗传。在88株的F2群体中, 株高呈负偏态双峰分布, 矮株峰值主要集中在80~110 cm, 合计18株; 高株峰值主要集中在110~170 cm, 合计70株。经卡平方测验, 高株(70)∶矮株(18)符合3∶1分离比(χ2= 0.74 < χ2(0.05,1)= 3.84)(图3), 表明Z1377的株高增加主要受主效QTL显性控制。其他的多数性状基本呈正态分布,-0.5≤偏度≤0.5;-0.5≤峰度≤2.0, 如倒一至倒五节间长、穗长、一次枝梗数、二次枝梗数、每穗实粒数、总粒数及千粒重。而有效穗数呈正偏态且峰度很高, 倒六节间长和结实率图形接近半矩形; 单株产量呈较强正偏态(图3)。

图2 日本晴和Z1377的表型
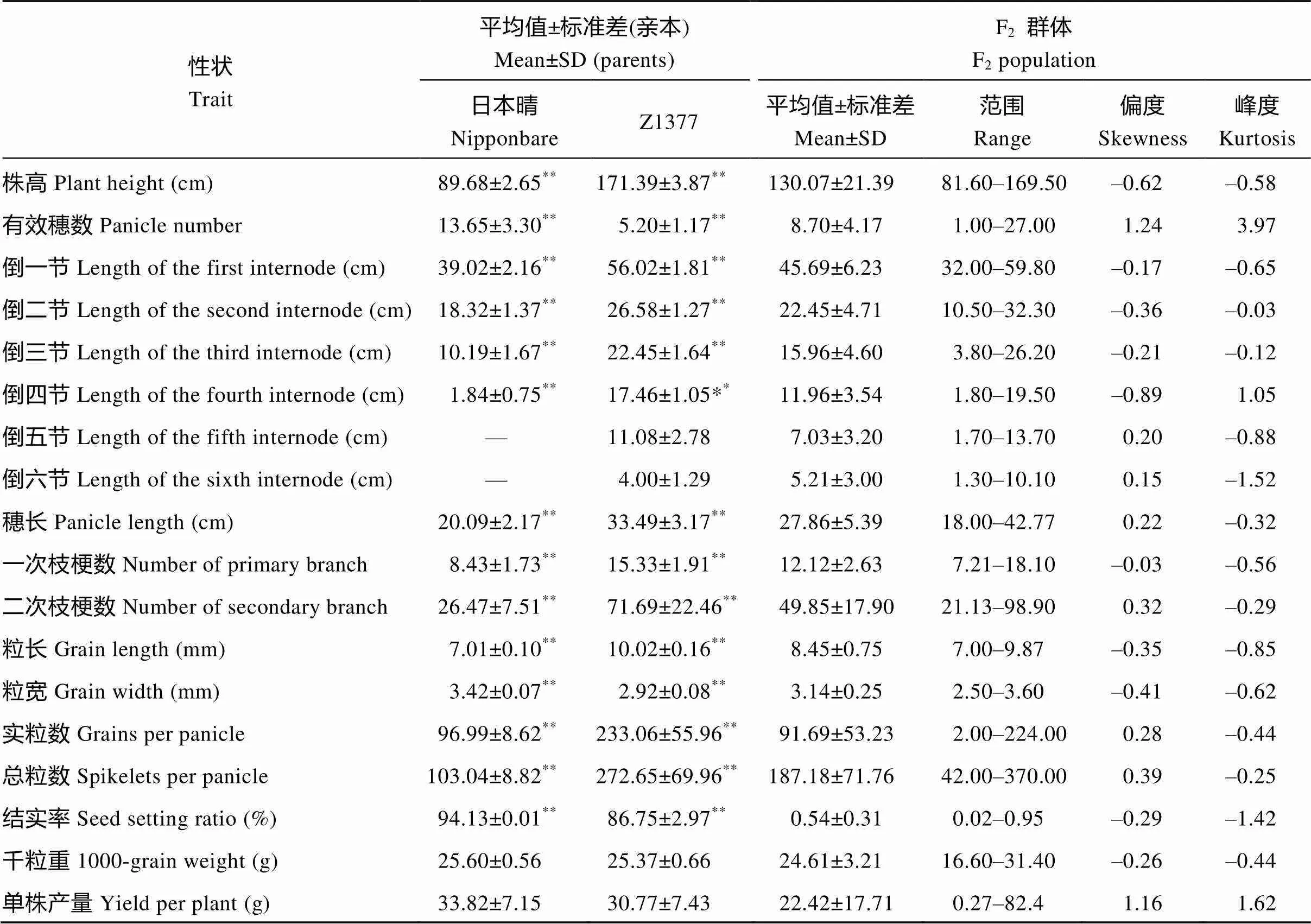
表1 成熟期的日本晴和Z1377及F2群体各性状统计参数
*和**分别表示性状间存在显著(< 0.05)或极显著(< 0.01)差异。
*and**indicate significant difference between traits at< 0.05 and< 0.01, respectively.

图3 日本晴与Z1377杂交的F2群体株高分布
2.4 Z1377重要农艺性状QTL定位
共鉴定出16个重要农艺性状QTL, 分布于第2、第3、第4、第5、第6、第7、第9染色体。影响株高的QTL共有2个, 分别为和, 位于第3和第5染色体, 来自缙恢35的等位基因分别可增加7.52 cm和4.65 cm的株高, 贡献率分别为28.59%和10.96%, 其中是一个主效株高QTL。倒一节间长, 位于第2染色体, 估计可增加长度为1.15 cm, 贡献率为3.65%。倒三节长QTL共3个, 其中位于第4染色体, 估计可增加长度为1.19 cm, 贡献率为8.50%;和均位于第6染色体, 估计增加长度分别为1.80 cm和1.13 cm, 贡献率分别为19.41%和7.59%。倒四节长, 位于第3染色体, 估计增加长度为1.31 cm, 贡献率为16.44%。穗长、一次枝梗数、二次枝梗数、粒宽、总粒数, 均位于第2染色体, 与RM6378连锁, 估计效应分别为1.30 cm、0.54、4.57、-0.06 mm和14.68, 贡献率分别为11.00%、8.09%、11.09%、7.43%和5.82%。粒长, 位于第3染色体, 估计增加粒长为0.18, 贡献率为12.38%。2个实粒数QTL和,分别位于第6和第9染色体, 估计可分别增加每穗38.86粒和90.26粒, 贡献率分别为0.50%和2.71%。有效穗位于第7染色体, 暗示来自缙恢35的等位基因估计可减少每株2.53个有效穗, 贡献率为3.9%。
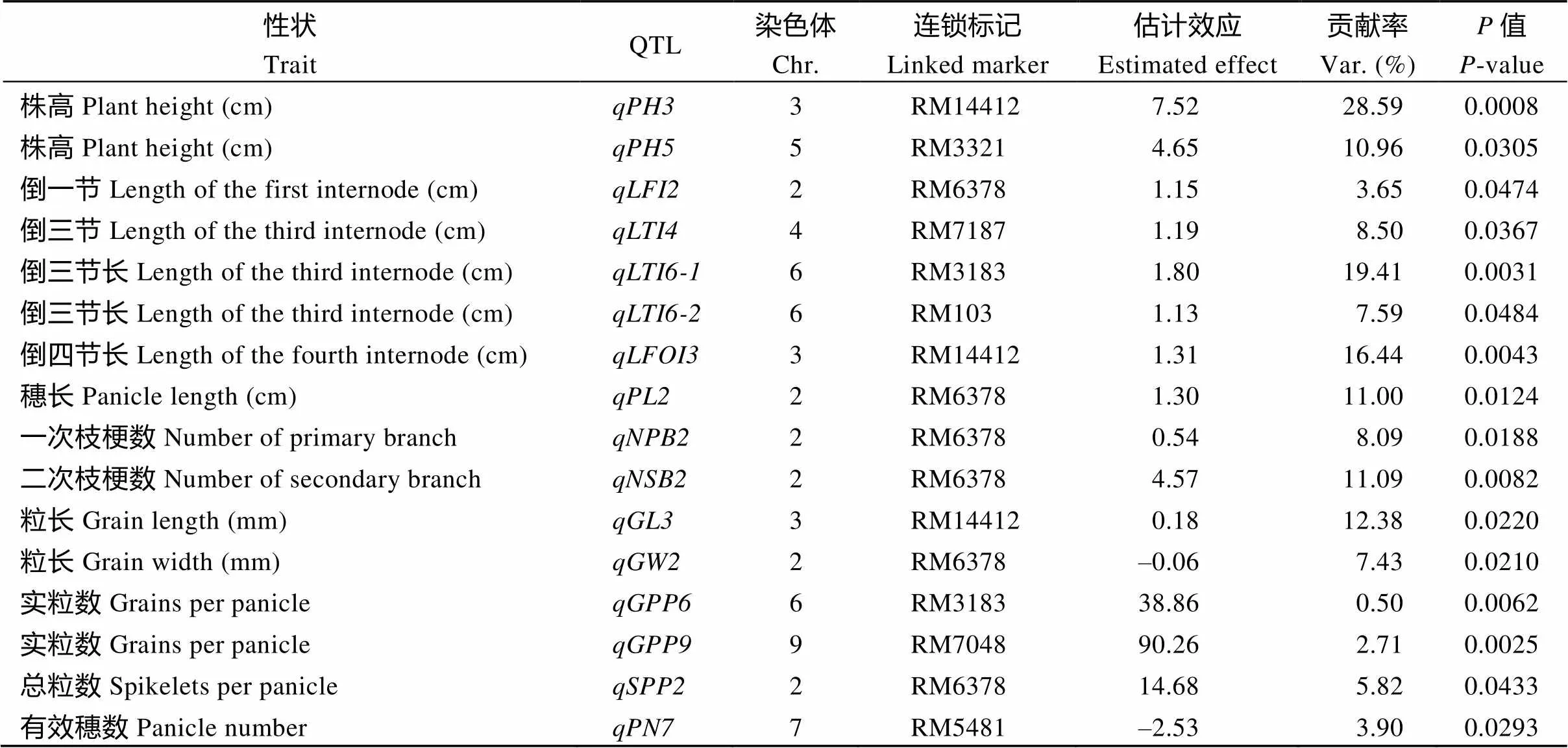
表2 水稻重要农艺性状QTL
3 讨论
利用染色体片段代换系可简化复杂遗传性状的研究, 并有利于农艺性状基因的鉴定[13]。本研究鉴定了一个水稻高秆染色体片段代换系Z1377, 其株高的增加由其节间的增多(增加2节)以及各节间和穗长的共同增加所致。然而, 其抽穗期与日本晴相当, 仅晚4 d, 表明Z1377的生长速率快于日本晴, 与抽穗期延长的株高增加[10]相比, 具有更重要的研究价值。目前现有水稻品种的收获指数已接近植物生理学家认为的上限0.6, 进一步高产必须首先在生物量上有所突破, 而其重要途径之一就是增加株高[14]。尽管Z1377在育种上直接应用嫌太高(株高171.39 cm), 但可在明确其株高及重要性状的遗传行为基础上进一步将其分解加以利用。
为了进一步明确Z1377株高等差异性状的遗传行为, 本研究利用日本晴与Z1377杂交产生的次级F2群体鉴定出了16个重要农艺性状的QTL, 除粒宽和结实率QTL外, 其他都是正效应。2个株高QTL (和)的遗传效应分别增加株高7.52 cm和4.52 cm, 贡献率分别为28.59%和10.96%。说明Z1377的株高遗传为一个主基因加一个微效基因模式。然而, 在F2群体中, 高秆和矮秆基本呈现双峰分布, 经卡平方测验符合3∶1分离比, 表明高秆对矮秆显性, 主要由负责。经与已定位的QTL比较,是一个尚未报道的株高QTL, 可能是一个新基因。而, 与已经克隆的水稻长穗颈基因位于同一区间, 该基因编码细胞色素P450单加氧酶,控制的隐性高秆突变体通过倒一节显著伸长增加株高[15]。穗长基因与已克隆的影响穗长基因[16]及调控水稻穗结构基因在相同的区间, 其中含有2个保守锌指结构域, 但缺乏转录激活能力, 过表达植株表现半矮化、短节间和穗;编码包含NHL结构域的蛋白,突变体株高略矮, 分蘖数减少, 穗变短, 二次枝梗减少, 每穗粒数减少, 籽粒变宽、变厚、变短, 千粒重增加[17]。而本研究鉴定的倒一节间长、一、二次枝梗数和以及窄粒和多粒数也均在该区间。此外, Li等[18]也在此区间(RM3732-RM1358)报道了一次枝梗数目增多的大穗基因(), 可能与本研究发现的是等位基因。Song等[19]同样在该区间克隆了一个控制水稻粒宽的QTL-, 可能与本研究中等位,编码一个环型E3泛素连接酶。这些基因之间有着怎么样的调控关系有待进一步研究, 说明Z1377是研究这些基因关系的重要材料。本研究鉴定的粒长基因与增加籽粒长度和重量的[20]在同一座位(RM1332-RM175)。本研究鉴定的多实粒数基因与增加粒数的等位基因[21]和[22]在相同的区间(RM5657-RM6491)。表明这些基因/QTL比较稳定, 能在不同遗传背景和环境中被检出。本研究中的、、、、、、、均未见报道, 可能是新的位点。因而, 我们一方面可进一步精细定位和克隆主效株高QTL-, 为调控株高形成的分子机制研究奠定基础; 另一方面, 可据F2各株系的QTL定位结果和株高等表型结果深入分析, 如在表型上选择中高且其他性状优良, 在分子标记上将、、、、等QTL的标记选为日本晴背景, 将这些增加株高的QTL去除, 而保留多粒数等有利基因, 就可选出含2~3个代换片段的中高优良染色体片段代换系, 进而在育种中加以利用。
株高QTL常与产量相关性状QTL成簇状分布, 或一因多效, 或紧密连锁。本研究检出的株高、倒四节间长和粒长同连锁于第3染色体RM14412。倒一节间长、一、二次枝梗数和以及窄粒和多粒数也同连锁于第2染色体RM6378标记。刘胜男等也在同一代换片段上检测出了株高粒长和千粒重[23]也是一个一因多效的基因, 同时控制水稻株高、每穗粒数和抽穗期[24]。这些相关性状QTL成簇状分布的现象相当普遍, 被称为“多因子连锁(linked factors)”[25], 可能是自然选择中性状的有利协同进化的结果[26]。在聚合育种中, 当目标性状QTL与有利性状连锁时, 便于利用; 然而往往是不利性状QTL连锁较多, 这就需要我们打破连锁累赘, 才能达到预期目标。
4 结论
鉴定了一个以日本晴为受体、缙恢35为供体亲本的水稻高秆染色体片段代换系Z1377, 共含有18个代换片段, 平均代换长度2.95 Mb, 携带多个育种有利的性状。Z1377的株高增加是节间数增多2节及各节间和穗长共同增加的结果。Z1377的株高由一个主效QTL ()和一个微效QTL控制, 且主要由负责, 呈显性单基因遗传, 为首次报道。Z1377共携带16个重要性状的QTL, 其中8个已被克隆。该研究对的精细定位和克隆以及为进一步选育含2~3个代换片段的中高优良染色体片段代换系并应用于育种奠定了基础。
[1] Wang Y H, Li J Y. The plant architecture of rice (L.)., 2005, 59: 75–84
[2] Monna L, Kitazawa N, Yoshino R, Suzuki J, Masuda H, Maehara Y, Tanji M, Sato M, Nasu S, Minobe Y. Positional cloning of rice semidwarfing gene,: rice “green revolution gene” encodes a mutant enzyme involved in gibberellin synthesis., 2002, 9: 11–17
[3] Tong H N, Xiao Y H, Liu D P, Gao S P, Liu L C, Yin Y H, Jin Y, Qian Q, Chu C C. Brassinosteroid regulates cell elongation by modulating gibberellin metabolism in rice., 2014, 26: 4376–4393
[4] Wu J H, Zhu C F, Pang J H, Zhang X R, Yang C L, Xia G X, Tian Y C, He C Z., a C2C2-type zinc finger protein, interacts withto promote seed germination through the modulation of gibberellin biosynthesis in., 2014, 80: 1118–1130
[5] Hong Z, Ueguchi-Tanaka M, Shimizu-Sato S, Inukai Y, Fujioka S, Shimada Y, Takatsuto S, Agetsuma M, Yoshida S, Watanabe Y, Uozu S, Kitano H, Ashikari M, Matsuoka M. Loss-of-function of a rice brassinosteroid biosynthetic enzyme, C-6 oxidase, prevents the organized arrangement and polar elongation of cells in the leaves and stem., 2002, 32: 495–508
[6] Tanabe S, Ashikari M, Fujioka S, Takatsuto S, Yoshida S, Yano M, Yoshimura A, Kitano H, Matsuoka M, Fujisawa Y, Kato H, Iwasaki Y. A novel cytochrome P450 is implicated in brassinosteroid biosynthesis via the characterization of a rice dwarf nutant,, with reduced seed length., 2005, 17: 776–790
[7] Tong H N, Jin Y, Liu W B, Li F, Fang J, Yin Y H, Qian Q, Zhu L H, Chu C C., a new member of the GRAS family, plays positive roles inbrassinosteroid singaling in rice., 2009, 58: 803–816
[8] Ito S, Kitahata N, Umehara M, Hanada A, Kato A, Ueno K, Mashiguchi K, Kyozuka J, Yoneyama K, Yamaguchi S, Asami T. A new lead chemical for strigolactone biosynthesis inhibitors., 2010, 51: 1143–1150
[9] 赵芳明, 郭超, 魏霞, 杨正林, 凌英华, 桑贤春, 王楠, 张长伟, 李云峰, 何光华. 日本晴与5个优良恢复系的多态性标记筛选及遗传差异分析. 西南大学学报(自然科学版), 2016, 38(11): 1–7 Zhao F M, Guo C, Wei X, Yang Z L, Ling Y H, Sang X C, Wang N, Zhang C W, Li Y F, He G H. Polymorphic SSR markers screening and genetic difference analysis between Nipponbare and five excellent restorer line.(Nat Sci Edn), 2016, 38(11): 1–7 (in Chinese with English abstract)
[10] 向佳, 李燕, 樊亚伟, 许军红, 郑丽媛, 何光华, 杨正林, 王楠, 赵芳明. 一个具有主效晚抽穗基因的水稻染色体片段代换系的鉴定、形态分析及定位. 作物学报, 2015, 41: 683–691 Xiang J, Li Y, Fan Y W, Xu J H, Zheng L Y, He G H, Yang Z L, Wang N, Zhao F M. Identification and morphological analysis of a rice chromosome segment substitution line carrying a major effect gene for late heading date and mapping of, 2015, 41: 683–691 (in Chinese with English abstract)
[11] Paterson A H, Damon S, Hewitt J D, Zamir D, Rabinowitch H D, Lincoln S E, Lander E S, Tanksley S D. Mendelian factors underlying quantitative traits in tomato: comparison across species, generations, and environments., 1991, 127: 181–197
[12] Zhao F M, Tan Y, Zheng L Y, Zhou K, He G H, Ling Y H, Zhang L H, Xu S Z. Identification of rice chromosome segment substitution line Z322-1-10 and mapping QTL for agronomic traits from the F3population., 2016, 44: 370–380
[13] Furuta T, Uehara K, Angeles-Shim R B, Shim J, Ashikari M, Takashi T. Development and evaluation of chromosome segment substitution lines (CSSLs) carrying chromosome segments derived fromin the genetic background ofL., 2014, 63: 468–475
[14] 王坚, 赵开军, 乔枫, 杨生龙.不同长度RNAi片段对水稻株高等农艺性状的遗传效应. 作物学报, 2012, 38: 632–638 Wang J, Zhao K J, Qiao F, Yang S L. Genetic effects of different RNA interference fragments fromon plant height and other agronomic traits in rice., 2012, 38: 632–638 (in Chinese with English abstract)
[15] Zhu Y Y, Nomura T, Xu Y H, Zhang Y Y, Peng Y, Mao B Z, Hanada A, Zhou H C, Wang R X, Li P J, Zhu X D, Mander L N, Kamiya Y, Yamaguchi S, He Z H.encodes a cytochrome P450 monooxygenase that epoxidizes gibberellins in a novel deactivation reaction in rice., 2006, 18: 442–456
[16] Zhang Y, Lan H X, Shao Q L, Wang R Q, Chen H, Tang H J, Zhang H S, Huang J. An A20/AN1-type zinc finger protein modulates gibberellins and abscisic acid contents and increases sensitivity to abiotic stress in rice ()., 2016, 67: 315–326
[17] Chen J, Gao H, Zheng X M, Jin M N, Weng J F, Ma J, Ren Y L, Zhou K N, Wang Q, Wang J, Wang J L, Zhang X, Cheng Z J, Wu C Y, Wang H Y, Wan J M. An evolutionarily conserved gene,, plays a role in determining panicle architecture, grain shape and grain weight in rice., 2015, 83: 427–438
[18] Li M, Tang D, Wang K J, Wu X R, Lu L L, Yu H X, Gu M H, Yan C J, Cheng Z K. Mutations in the F-box geneimprove the panicle architecture and enhance the grain yield in rice., 2011, 9: 1002–1013
[19] Song X J, Huang W, Shi M, Zhu M Z, Lin H X. A QTL for rice grain width and weight encodes a previously unknown RING-type E3 ubiquitin ligase., 2007, 39: 623–630
[20] Heang D, Sassa H. Antagonistic actions of HLH/bHLH proteins are involved in grain length and weight in rice., 2012, 7(2): e31325
[21] Taguchi-Shiobara F, Kawagoe Y, Kato H, Onodera H, Tagiri A, Hara N, Miyao A, Hirochika H, Kitano H, Yano M, Toki S. A loss-of-function mutation of ricecauses semi-dwarfness and slightly increased number of spikelets., 2011, 61: 17–25
[22] Huang X Z, Qian Q, Liu Z B, Sun H Y, He S Y, Luo D, Xia G M, Chu C C, Li J Y, Fu X D. Natural variation at thelocus enhances grain yield in rice., 2009, 41: 494–497
[23] 刘胜男, 张华, 柳絮, 李广贤, 杨永义, 姚方印. 水稻株高和产量相关性状的QTL定位. 山东农业科学, 2015, 47(4): 8–12 Liu S N, Zhang H, Liu X, Li G X, Yang Y Y, Yao F Y. QTL mapping of plant height and yield-related traits of rice., 2015, 47(4): 8–12
[24] Xue W, Xing Y, Weng X, Zhao Y, Tang W, Wang L, Zhou H, Yu S, Xu C, Li X, Zhang Q. Natural variation in Ghd7 is an important regulator of heading date and yield potential in rice., 2008, 40: 761–767
[25] Jones D F. Dominance of linked factors as a means of accounting for heterosis., 1997, 2: 466–479
[26] Cai W, Morishima H. QTL clusters reflect character associations in wild and cultivated rice., 2002, 104: 1217–1228
Identification of Rice Chromosome Segment Substitution Line Z1377 with Increased Plant Height and QTL Mapping for Agronomic Important Traits
CUI Guo-Qing1, WANG Shi-Ming1, MA Fu-Ying1, WANG Hui1, XIANG Chao-Zhong2, LI Yun-Feng1, HE Guang-Hua1, ZHANG Chang-Wei1, YANG Zheng-Lin1, LING Ying-Hua1, and ZHAO Fang-Ming1,*
1Rice Research Institute, Southwest University / Academy of Agricultural Sciences, Southwest University, Chongqing 400715, China;2Center of Agricultural Serve at Longkong Town, Fengdu County, Chongqing 408200, China
Plant height is an important agronomic trait in rice, usually relating to yield-related traits. Here, a novel rice chromosome segment substitution line Z1377 with increased plant height was identified from recipient Nipponbare and donor Jinhui 35 through selection of both phenotype and molecular marker. Z1377 carried 18 substitution segments with average substitution length of 2.95 Mb. Compared with Nipponbare, Z1377 had significantly increased plant height, length of the 1st, 2nd, 3rd, and 4th internode, panicle length, number of primary and secondary branches and grain length, and decreased grain width, number of panicles per plant and seed setting ratio. However, the seed setting ratio was still 86.75%. Furthermore, F2population from crosses between Nipponbare and Z1377 was used to map QTLs for plant height and other important agronomic traits. A total of 16 QTLs were detected, of which eight had been reported with the cloned genes such as,,, and the other eight were still not reported, such as. The plant height of Z1377 was mainly controlled by a major QTL () with the explained phenotypic variance of 28.59% and a minor QTL (). Moreover, the high and dwarf plants basically displayed a bimodal distribution in the F2population, and fitted to 3:1 segregation ratio by Chi-square test, indicating that high plant is dominant to dwarf plants and mainly conferred by. These results lay a foundation for fine mapping and cloning, meanwhile, also provide good bases for developing excellent chromosome segment substitution lines with moderate height plant carrying 2–3 substitution segments to be used in breeding.
rice; chromosome segment substitution lines; plant height; yield-related traits; QTL mapping
2018-01-05;
2018-06-12;
2018-06-20.
10.3724/SP.J.1006.2018.01477
赵芳明, E-mail: zhaofangming2004@163.com
E-mail: 271014808@qq.com
本研究由国家重点研发计划项目(2017YFD0100202), 重庆市科委主题专项(CSTC, 2016shms-ztzx0017)和西南大学基本业务费专项创新团队项目(XDJK2017A004)资助。
This study was supported by the National Key Research and Development Program of China (2017YFD0100202), the Project of Chongqing Science & Technology Commission (CSTC, 2016shms-ztzx0017), and the Fundamental Research Funds for the Central Universities (XDJK2017A004).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180619.1919.008.html
