以抗除草剂Bar基因稳定转化谷子技术研究
2018-10-10陈倩楠杜丽璞贾冠清赵宝华叶兴国刁现民
陈倩楠 王 轲 汤 沙 杜丽璞 智 慧 贾冠清 赵宝华叶兴国 刁现民,*
以抗除草剂基因稳定转化谷子技术研究
陈倩楠1,2王 轲1汤 沙1杜丽璞1智 慧1贾冠清1赵宝华2叶兴国1刁现民1,*
1中国农业科学院作物科学研究所, 北京 100081;2河北师范大学生命科学学院, 河北石家庄 050024
农杆菌介导的谷子遗传转化效率一直是制约谷子功能基因研究及转基因育种效率的主要因素。本研究以冀谷11谷子幼穗为外植体, 选取0.5~1.0 cm的幼穗, 切成0.5 cm左右的小段, 置改良后的MS培养基上诱导15~20 d形成胚性愈伤组织3120块。愈伤组织侵染转化前用侵染液悬浮浸泡, 并经45°C热激预处理3 min, 可以有效提高26.1%的瞬时遗传转化效率。将转化后的愈伤组织经草丁膦(PPT)筛选后获得513块抗性愈伤组织, 抗性愈伤组织获得率为16.4%。抗性愈伤组织经分化、壮苗培养后获得7株抗性植株, 经PCR和Southern杂交检测得到6株T0代转基因阳性株, 对T3代转化植株叶片进行PPT抗性分析, 并结合Bar蛋白抗体试纸条鉴定, 表明基因已稳定整合到谷子基因组中。本研究建立了农杆菌介导转化谷子优良品种的遗传转化体系, 对提高谷子转基因育种效率和谷子模式研究系统的建立有重要意义。
谷子; 根癌农杆菌; 遗传转化; 热激; 抗除草剂
谷子((L.) Beauv.)在植物分类系统中处于禾本科(Gramineae)黍亚科(Panicoideae)狗尾草属(), 其野生祖先种是青狗尾草()[1]。我国黄河流域是谷子的发源地, 谷子在我国有着极其悠久的栽培历史。谷子籽粒脱皮后俗称“小米”, 营养价值均衡, 蛋白质、脂肪酸含量高, 富含丰富的维生素和微量元素[2]。我国也是谷子种植面积最大的国家, 占世界谷子种植总面积的88%。谷子作为抗旱节水作物, 在应对未来干旱环境和全球气候变暖导致的粮食减产风险中有着战略储备作物的意义。谷子是C4植物, 二倍体自花授粉, 基因组小, 生育周期短, 耐旱耐贫瘠, 抗逆性强, 适应性广, 正在逐渐发展成为研究C4植物光合作用和抗旱耐贫瘠的模式作物[3-4]。
目前, 有关谷子遗传转化的报道相对较少, 最早的谷子转基因研究报道是董云州等[5-6]利用基因枪法轰击谷子花粉。之后, 刁现民等[7]利用基因枪法轰击谷子胚性愈伤组织, 成功建立了谷子的转化体系, 但该方法的转化效率依然偏低。王永芳等[8]最先利用根癌农杆菌介导法进行谷子的遗传转化研究, 谷子的基因转化验证研究处于起步阶段。过表达基因的冀谷11转基因植株会导致其分蘖数增加[9];基因转化冀谷11胚性愈伤组织, 转基因植株会出现多种异常发育的花药[10]; 李丛[11]在冀谷11中超表达基因提高了转基因谷子的耐旱性。青狗尾草作为谷子的野生近缘种, 近年来其转化效率有了重大突破, 美国康奈尔大学Boyce Thompson植物研究所, 以青狗尾草A10作为材料, 成功建立了其农杆菌遗传转化技术体系, 转化效率接近20%[4]; 近几年相继有2篇文章报道通过花粉管通道与农杆菌介导相结合的方法成功获得可稳定遗传的转基因植株, Martins等[12-13]与Saha等[14]将外源基因通过载体构建的方式转入农杆菌中, 制成农杆菌悬浮液, 通过蘸花法也获得了转基因阳性植株, 但这种蘸花法在国际上多个实验室难以重复。目前国内外谷子的转基因研究均处于转基因体系构建和优化过程中, 尚无具有应用价值的谷子转基因成型材料。随着谷子研究价值的不断提高, 谷子的遗传转化技术也越来越重要。
在植物转基因研究中, 抗性标记基因的使用可以有效地从非转化细胞中筛选获得转化体。目前经常使用的抗性标记基因大多数是抗生素或除草剂抗性基因, 如潮霉素磷酸转移酶基因()[15]、新霉素磷酸转移酶基因()[16]、草丁膦抗性基因()[17]、草甘膦抗性基因()[18]等。随着转基因植物的大量推广, 人们越来越关注抗性标记滞留植物体内并表达是否对植物体本身或其他有利性状基因的表达产生影响, 因此, 提高转基因植物选择标记基因的安全性成为研究热点。基因是迄今为止用得最多的一个抗除草剂基因, 其编码的PPT乙酰转移酶可有效水解培养基中PPT及其类似物Basta、Bialaphos等, 使植物体内谷氨酰胺合成途径能够正常进行, 免除体内氨离子积累对植物细胞的毒害作用[19], 作为选择标记基因也成功被用于不同物种的遗传转化[20]。张晓东等[21]将小麦中编码HMW谷蛋白5和10亚基的基因和基因重组, 用基因枪法转化小麦幼胚、幼穗和花药, 获得了Basta抗性植株。傅荣昭等[22]将抗除草剂基因与雄性不育基因紧密连接, 创造了新的雄性不育转基因材料。黄大年等[23]将基因导入杂交水稻的恢复系, 也成功获得了可用于生产的抗除草剂杂交水稻。
由于大规模地、连续性地使用除草剂, 农田杂草已对除草剂产生抗性, 若单纯提高除草剂的使用浓度以达到杀死杂草的目的, 则容易对农作物产生毒害作用。因此, 育成抗除草剂的作物新品种已成为育种工作者的一个重要课题。谷子生产一直采用大量播种、人工间苗的栽培方式, 普通谷子品种缺乏适宜的除草剂, 所以谷田除草一直靠人工作业, 体力劳动繁重[24]。谷子本身又不具备抗除草剂或耐除草剂基因, 经育种工作者的长期研究, 在谷子的近缘野生种狗尾草中发现多个抗除草剂基因[25-27]。王天宇等[24,28]将源于狗尾草的多个不同类型的抗除草剂基因转移到栽培种上, 获得了抗三类实用有效除草剂(阿特拉津、氟乐灵、拿扑净)的新种质。
本试验以谷子幼穗为外植体, 利用基因作为选择标记基因, 旨在构建谷子稳定的遗传转化体系, 并创制谷子抗除草剂新材料, 为利用组织培养和基因工程技术开展谷子功能基因组学的研究和谷子抗除草剂育种奠定基础。
1 材料与方法
1.1 供试材料
选用冀谷 11, 种植于中国农业科学院作物科学研究所北京顺义试验站(夏季)和海南三亚试验站(冬季)。
植物表达载体pWMB111、农杆菌C58C1由中国农业科学院作物科学研究所转基因中心小麦转化组提供。pWMB111载体是由Ubi启动子同时调控的基因和基因。
1.2 培养基成分
遗传转化所用的基本培养基为MS培养基, 添加不同添加物后构成不同培养阶段所用培养基(表1)。
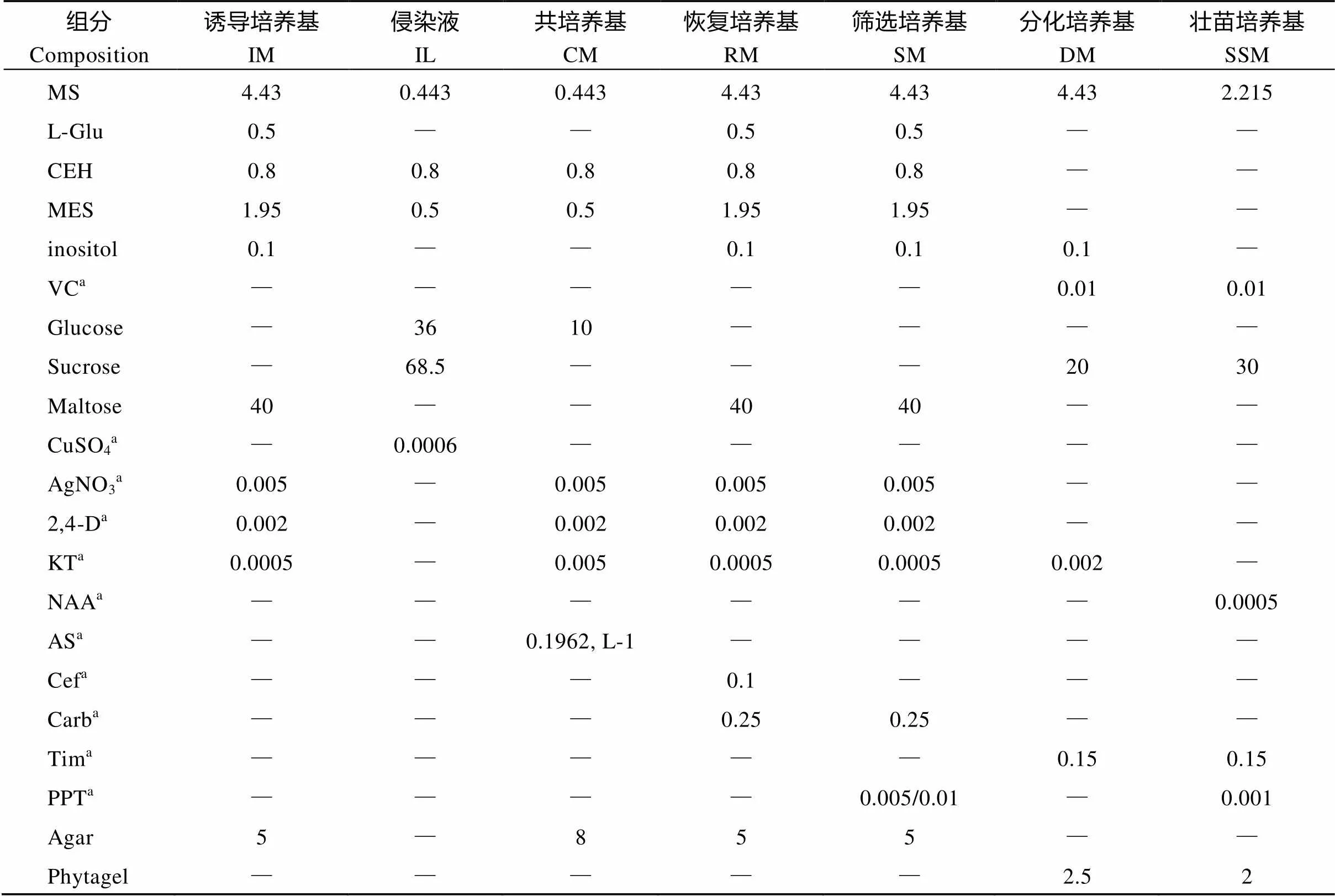
表1 农杆菌介导谷子愈伤组织转化培养基配方
所有培养基pH值均为5.8; IL侵染液使用前过滤除菌;a需过滤除菌, 培养基灭菌完成后再添加。
All medium pH values are 5.8; IL should be sterilized before use;ashould be filtered, and add into medium after medium sterilization.
VC: vitamin C; 2,4-D: 2,4-dichlorophenoxyacetic acid; KT: kinetin; NAA:1-naphthaleneacetic acid; AS: acetosyringone; Cef: cefetamet pivoxil; Carb: carbenicillin; Tim: timentin; PPT: phosphinothricin; IM: induction medium; IL: infection liquid; CM: co-culture medium; RM: recovery medium; SM: screening media; DM: differentiation medium; SSM: strong seedling medium.
1.3 试验方法
1.3.1 取样和幼穗愈伤组织培养 种植谷子材料, 当其进入孕穗期后每2天取一次样, 获得不同大小的幼穗, 至幼穗大于等于2.0 cm后停止取样。剥去苞叶, 用75%的酒精喷拭叶鞘表面, 于超净台内用无菌手术刀及镊子将叶鞘内的幼穗小心取出, 切成0.5 cm左右的小段, 接种于诱导培养基上, 28°C暗培养以诱导愈伤组织。分别设置7、15、30 d诱导时间, 保证每个处理均包含不同生长长度的幼穗材料。将诱导7、15、30 d的幼穗进行农杆菌侵染转化, 恢复培养3 d后, 检测基因的瞬时表达效率。
1.3.2 农杆菌介导的遗传转化 将胚性愈伤组织作为受体, 进行遗传转化热激处理(表2), 保证每个处理均包含不同生长长度的幼穗材料。然后4°C 6457×低温离心10 min; 加入无菌IL侵染液(含有100 µmol L–1的AS)重悬, 获得OD600=1.0的农杆菌悬浮液, 室温静置侵染10 min, 吸干愈伤组织表面的菌液, 在AS培养基上共培养2 d, 恢复培养3 d后, 再将其转移到含有PPT的筛选培养基, 培养4周完成筛选。将筛选后得到的抗性愈伤组织转移至分化培养基中培养, 待分化芽长至2~4 cm时转移至生根培养基中。再生苗长到约8 cm根系较健壮时, 开盖炼苗3~4 d, 最后将去除培养基的再生苗移入试验地或进行盆栽。

表2 遗传转化热激处理方式
1.3.3 转基因植株的PCR鉴定 利用SDS法分别提取T0代转基因植株和未转化植株全基因组DNA。PCR扩增基因片段的引物F: 5′-GCA CCATCGTCAACCACTAC-3′; R: 5′-TGAAGTCCAG CTGCCAAAA-3′; r酶(TaKaRa, 日本)检测PCR扩增体系为20 μL。反应程序为95°C变性5 min; 95°C变性40 s, 55°C退火40 s, 72°C延伸30 s, 30个循环; 72°C延伸10 min。取PCR产物10 μL进行1%琼脂糖凝胶电泳检测。
1.3.4 Southern杂交 利用SDS法提取的高质量总DNA 20~30 µg, 经I和d III限制性内切酶完全消化后, 在0.8%琼脂糖凝胶电泳上分离。参照Sambrook等[29]的方法将DNA转至带正电荷的尼龙膜上。探针为以pWMB111质粒为模板经PCR扩增的基因片段, 探针的标记以及杂交过程参考DIG High Prime DNA labeling and Detection Starter Kit II(Roche, 美国)的说明书。利用化学发光检测体系(UVP, 美国)进行免疫检测。
1.3.5 谷子转基因植株后代的检测 通过常规PCR法及Bar蛋白抗体试纸条法(取2 cm左右的叶片, 液氮速冻破碎; 加入0.3 mL的Extractin buffer, 将试纸条标有指示箭头的一端浸入buffer内, 静待2 min, 观察Bar蛋白抗体表达结果), 调查T1代转基因植株中基因分离比例, 同时又对处于5~6叶期野生型及T3代转基因植株进行PPT抗性分析, 即分别用0、2.5、5 g L–1PPT溶液涂抹野生型及T3代转基因植株新叶, 生长1周后, 观察统计植株存活率。
1.3.6 数据处理公式
愈伤组织出愈率(%)=(形成愈伤组织数/接种幼穗数)×100%
愈伤组织分化率(%)=(分化苗愈伤组织数/愈伤组织数)×100%
瞬时转化效率(%)=(染色后蓝斑的愈伤组织数/愈伤组织总数)×100%
2 结果与分析
2.1 幼穗大小及诱导培养时间对于愈伤组织状态的影响
本研究人为的将谷子幼穗长度分为5个级别, 试验发现在其他试验条件相同时, 不同长度的幼穗愈伤组织诱导率不同(图1-D和表3)。当幼穗长度在0.5~1.0 cm时, 愈伤组织的诱导效率最高, 可达到92.74%, 此时的愈伤组织为淡黄色, 质地紧密, 状态最佳。在相同培养条件下, 愈伤组织诱导培养时间影响胚性愈伤组织的形成。诱导培养时间为7 d时, 幼穗细胞未经脱分化形成愈伤组织, 不具有全能性(图1-A); 愈伤组织诱导时间为15 d时, 多为淡黄色、质地紧密的胚性愈伤组织(图1-B); 诱导培养时间为30 d时, 愈伤组织状态会急剧下降, 并出现大量白色芽状体, 丧失分化能力(图1-C)。
2.2 愈伤组织诱导培养时间对于谷子遗传转化效率的影响
当愈伤组织诱导时间为15 d时, 形成的愈伤组织较多(图2-B),染色检测表明瞬时转化效率在52%左右(图2-D, E), 且后期经过两轮筛选后, 愈伤组织还能保持较高的分化能力。愈伤组织诱导培养时间为7 d时(图2-A), 愈伤组织的转化效率在50%左右, 与诱导培养15 d的愈伤组织转化效率无显著性差异, 但后期经过转化筛选, 分化能力差; 愈伤组织诱导培养时间为30 d时(图2-C), 愈伤组织的转化效率显著降低, 仅在30%左右(图2-D, F), 此时的胚性愈伤组织数量急剧减少, 且在筛选过程中出现大量白色芽体, 分化能力降低。

图1 幼穗大小及愈伤组织状态
A: 诱导7 d后愈伤组织; B: 诱导20 d后愈伤组织; C: 诱导40 d后愈伤组织; D: 不同长度幼穗。
A: calli after induction for 7 d; B: calli after induction for 20 d; C: calli after induction for 40 d; D: young panicles in different sizes.

表3 幼穗诱导培养15 d后愈伤组织诱导效率的比较
愈伤组织诱导率(%)是指每100个幼穗中可诱导出的愈伤组织的幼穗个数。a3次重复的平均值±标准差。
Calli induction rate (%) refers to the number of inducible calli per 100 panicles.aMean of three repeats ± standard deviation.

图2 愈伤组织诱导培养时间对转化效率的影响
A: 诱导7 d后愈伤组织; B: 诱导15 d后愈伤组织; C: 诱导30 d后愈伤组织; D:瞬时转化效率; E: 诱导15 d愈伤组织染色; F: 诱导30 d愈伤组织染色。*, **分别表示在≤ 0.05和≤ 0.01水平上的显著差异。
A: calli after induction for 7 d; B: calli after induction for 15 d; C: calli after induction for 30 d; D:transient conversion efficiency; E:staining of calli after induction for 15 d; F:staining of calli after induction for 30 d. *and** indicates a significant difference at≤ 0.05 and≤ 0.01 levels, respectively.
2.3 热激处理对谷子遗传转化效率的影响
热激可以提高质粒的转化效率, 本试验设计了25°C (CK)、37°C、45°C、47°C共4个预处理温度, 以3 min为热激预处理时间进行试验。染色数据表明, 适当的热激有利于提高谷子愈伤组织的基因瞬时表达率。37°C 3 min热激后愈伤组织的基因染色效率与对照无显著差异; 45°C 3 min热激处理可以提高愈伤组织中基因瞬时表达效率, 比对照组平均提高了26.1%的瞬时转化效率; 47°C热激预处理对于农杆菌介导的愈伤组织瞬时表达有着抑制作用, 比对照组平均降低了8.4% (图3-A)。
对45°C热激温度设计了4组热激时间的试验, 恢复培养3 d后,染色数据统计显示, 热激温度为45°C, 热激时间为3 min有利于瞬时转化效率的提高, 差异极显著(图3-D~F)。热激时间为1.5 min时,表达效率与对照无显著差异, 热激时间为5 min时,瞬时转化效率低于对照组。试验结果表明, 45°C 3 min的热激时间能显著提高瞬时转化效率, 而45°C 5 min的热激处理对其瞬时遗传转化有抑制作用。
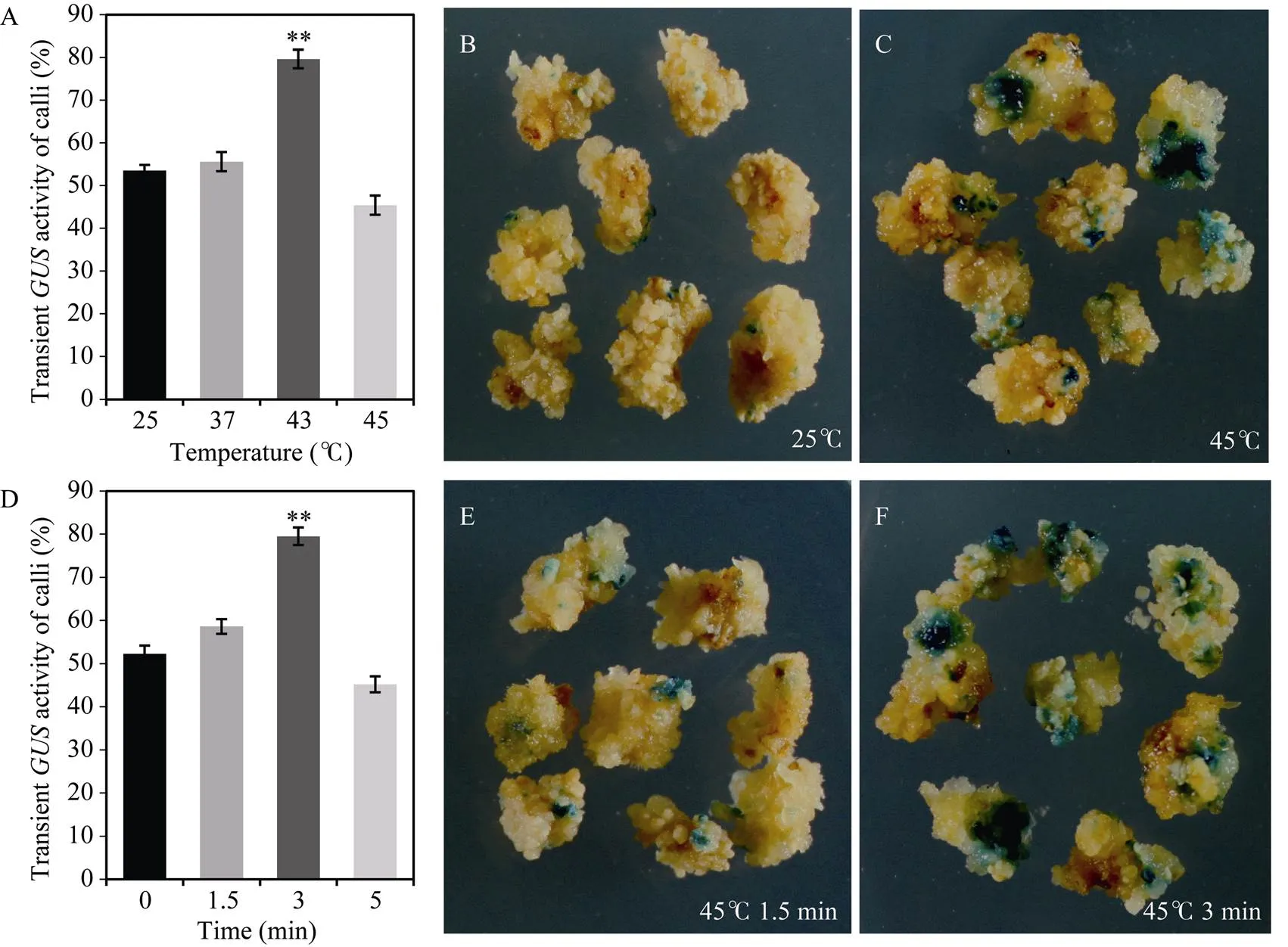
图3 谷子愈伤组织热激处理GUS瞬时转化
A: 不同温度下热激3 min的瞬时表达率; B: 25°C (CK)染色; C: 45°C热激下染色; D: 45°C热激温度下不同热激时间的瞬时表达率; E: 45°C热激1.5 min染色; F: 45°C热激3 min染色。*和**分别表示在≤ 0.05和≤ 0.01水平上显著差异。
A:transient expression rate at different temperatures of 3 min; B:staining under CK (25°C); C:staining at 45°C heat shock; D:transient expression rate at different time under 45°C heat shock; E: 45°C heat shock 1.5 minstaining; F: 45°C heat shock 3 minstaining. * and ** indicates a significant difference at≤ 0.05 and≤ 0.01 levels, respectively.
2.4 谷子转基因T0代阳性植株的获得和检测
冀谷11谷子幼穗小段经15 d诱导, 共得到有效愈伤组织3120块, 农杆菌侵染转化、筛选后得到513块抗性愈伤组织, 抗性愈伤组织诱导率为16.4%。抗性愈伤组织经分化、壮苗培养后获得7棵抗性再生植株, 经炼苗后移栽温室花盆生长(图4-A~D)。提取PPT抗性植株的DNA, 进行基因的PCR分析, 结果表明, 7株植株中有6株为阳性植株, 阳性植株率约为85.7% (图4-E), PCR检测结果初步证明基因已经整合进谷子基因组中。阳性的转化植株进一步做Southern杂交分析, 由图4-F可看出, 未转化植株未显示任何杂交信号, 而检测的4个转化植株中都显示了有基因的杂交信号, 证明该基因已经整合进谷子基因组中, 同时也证明了经农杆菌转化的外源基因拷贝数低的优点。

图4 T0代转基因植株鉴定
A: 愈伤组织分化; B: 再生植株; C: 壮苗; D: 再生植株移栽; E:基因PCR检测, 1~7为T0代转化单株; F: T0代转化株Southern blot, 1~5: 经I酶切, 7~11: 经d III酶切, 6: 野生型。M: marker DL2000; H: 水对照; WT: 野生型; P: 质粒。
A: calli differentiation; B: regenerated plant; C: strong seedling; D: transplanting of regenerated plants; E: bar PCR detection, 1–7 are T0generation transformed plants; F: Southern blot of T0generation of transgenic lines, 1–5: digested withI, 7–11: digested withind III, 6: wild type. M: marker DL2000; H: water control; WT: wild type; P: plasmid.
2.5 谷子转基因植株抗PPT除草剂鉴定和遗传分析
播种T0代转基因阳性植株, 获得T1代转基因植株, 待植株长至四叶期, 用常规PCR法及Bar蛋白抗体试纸法检测T1阳性株, 经统计112棵T1代植株, 阳性株与阴性株的分离比符合3︰1, 证实该基因是单拷贝插入。随后又对T3代转基因植株叶片进行PPT抗性分析, 用棉棒将浓度为0、2.5、5.0 g L–1的PPT溶液涂抹未转化植株叶片, 当PPT溶液浓度为2.5 g L–1以上时, 所有经过涂抹的谷子叶片均在1周内开始黄化, 脱水萎蔫, 直至枯死。而PCR检测呈阳性的转化植株经PPT溶液涂抹叶片后, 均表现出抗性, 结合Bar蛋白抗体试纸条结果确定了最适的PPT筛选浓度为2.5 g L–1(图5)。该结果也证实了基因可以在谷子转基因后代中稳定表达。
3 讨论
3.1 影响谷子组培特征及瞬时转化效率的主要因素
影响谷子组织培养的因素较多, 而合适外植体诱导出的胚性愈伤组织是高效转化率的基础。柳琳[30]探究了不同生长状态的谷子幼穗诱导出的愈伤组织状态, 发现枝梗分化期的谷子幼穗诱导的胚性愈伤组织率较高; 小穗分化期的谷子幼穗产生的胚性愈伤组织少, 多数变褐逐渐死亡; 小花分化期、雌雄蕊分化期和幼穗打包期的谷子幼穗诱导出的胚性愈伤组织极低。董云洲等[6]将处于小花分化期的幼穗在改良后的MS培养基上诱导20 d, 可分化的胚性愈伤组织获得率仅为0.55%, 与本研究的结果趋势相同。本试验又对枝梗分化期的幼穗细分, 发现长度为0.5~1.0 cm的幼穗胚性愈伤组织诱导效率最高, 可达到92.74%。
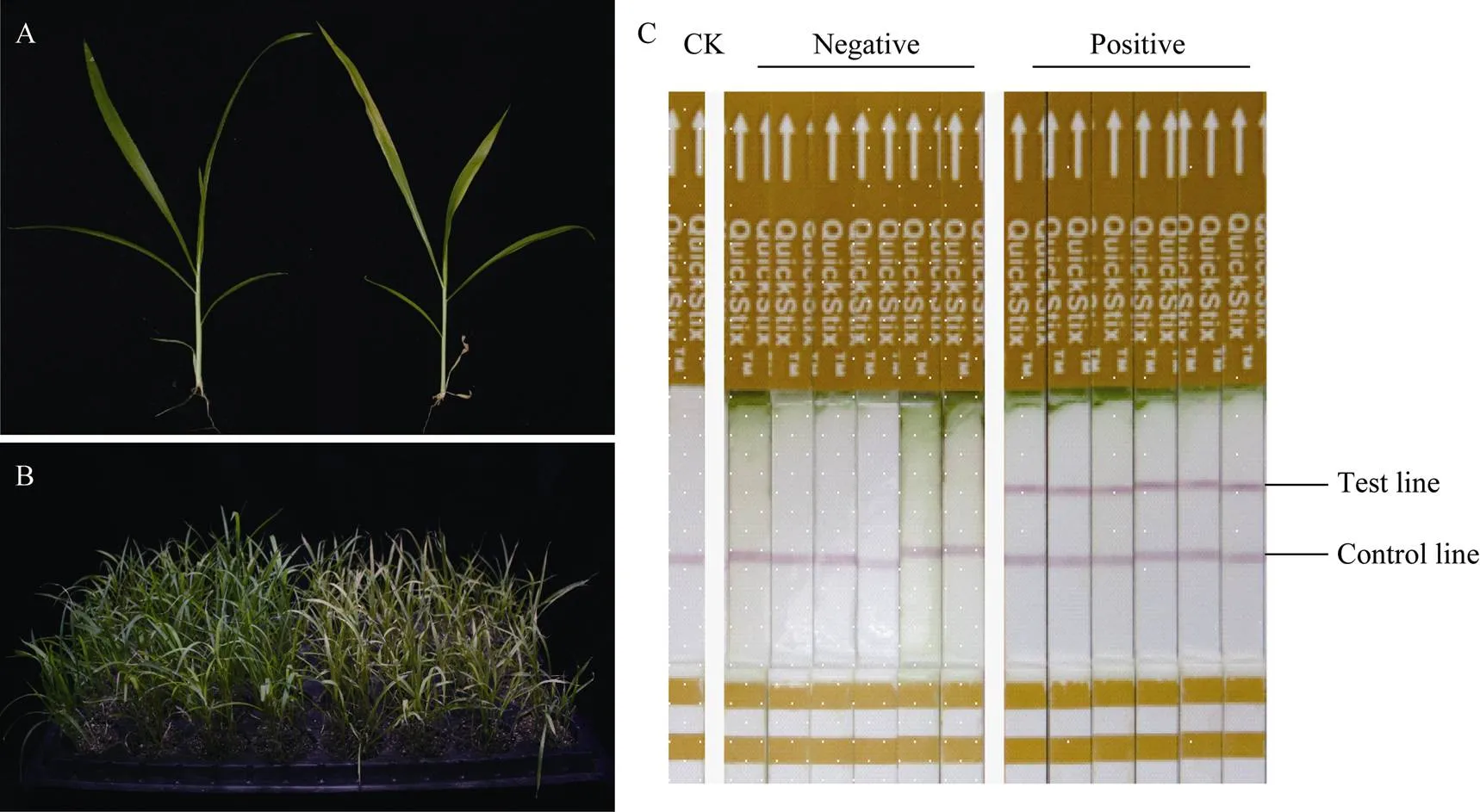
图5 T3代转基因株bar基因抗性试验
A: 2.5 g L–1PPT溶液涂抹叶片; B: 2.5 g L–1PPT 溶液喷洒叶片, 左侧转化株, 右侧未转化株; C: Bar蛋白抗体试纸条鉴定结果。 CK: 未转化阴性对照; Vegative: 转基因阴性株; Positive: 转基因阳性株。
A: 2.5 g L–1PPT solution coated leaves; B: 2.5 g L–1PPT solution sprayed leaves in transgenic lines (left) and in CK (right); C: Bar protein test results. CK: wild type control; Negative: negative transgenic lines; Positive: positive transgenic line.
本研究表明, 热激对农杆菌介导的谷子愈伤组织瞬时遗传转化效率的提高有显著作用。结合Hiei等[31]的试验结果, 农杆菌介导的侵染受体的遗传转化效率的提高需要一定的温度条件, 在受体材料存活所需的其他条件都可以满足的情况下, 在一定的温度范围内, 温度和遗传转化效率正相关, 并且要积累到一定的温度总量。徐游[32]采用42°C 3 min和38°C 5 min的处理方式处理玉米幼胚,染色结果表明, 瞬时转化效率分别提高9.43%和8.80%, 也证实了热激温度高, 需要的热激时间短, 热激温度低, 需要的热激时间长的推论。本试验中45°C 3 min的热激处理就可以显著提高谷子愈伤组织瞬时转化效率, 而37°C 3 min的热激时间未能提高转化效率, 延长37°C下的热激时间是否可以提高愈伤组织的瞬时转化效率需要进一步的试验验证。
3.2 谷子愈伤组织稳定遗传转化效率需进一步提高
董云洲等[6]用基因枪法轰击豫谷2号谷子幼穗,基因瞬时转化效率为0.15%, 最终只获得了0.05%的转基因频率。刘颖慧等[33]通过农杆菌介导法将带有基因的pBI121载体转化到谷子愈伤组织中, 经50 mg L–1卡那霉素筛选得到了转基因阳性株, 但转基因株后代不育。Lambe等[34]在谷子转化过程中使用潮霉素作为选择标记, 结果不能形成再生植株, 随后又选用潮霉素B作为选择标记, 获得了可再生植株。Martins等[12]利用农杆菌介导法进行青狗尾草的转化, 成功将其遗传转化效率提高到了29%。Martins等[13]和Saha等[14]通过蘸花法浸染孕穗期的青狗尾草, 转化效率可达到0.6%~0.8%。本研究中, 我们将基因转化谷子并成功获得了转基因植株, 通过分析验证, 表明该基因已经整合到谷子基因组中, 且在后代中表现单基因分离。利用优化后的方法开展谷子遗传转化, 稳定的遗传转化效率可达到1.2%~1.5%, 较前人的研究有显著提升, 但与模式作物水稻的遗传转化效率相比仍然存在较大差距。农杆菌介导的谷子遗传转化体系是多因素综合效应, 不同的方法对转基因效率影响不同, 其原因有待进一步探讨, 谷子瞬时转化效率高, 但是难以高效率整合到基因组中, 是我们后续待解决的问题。
3.3 抗除草剂转基因谷子培育对生产实践的意义
利用或者培育抗除草剂品种是目前控制作物田间杂草的重要措施之一, 也是提高作物产量、减少农药施用量、保护环境的重要举措。育种工作者用抗拿捕净谷子材料“WRl”与综合性状优良的常规谷子品种杂交, 在杂种自交后代中选育分离的抗除草剂单株, 已获得性状优良的抗除草剂品种[24]。但是, 若同时筛选多个不同抗性品种或一个抗多种除草剂的品种, 工作量繁重, 耗时较长, 急需一种快速简便的选育方法。目前, 在谷子中也克隆出抗除草剂基因, 如抗拿捕净除草剂基因, 并开发了相应的分子标记[35], 由于除草剂拿扑净对单子叶作物不具有选择性, 目前在单子叶植物上的应用并不广泛。草丁膦是农业生产中广泛使用的高效低残留除草剂,获得草丁膦的抗性基因, 并通过基因工程手段在其他单子叶作物中表达, 将对农业生产具有重要意义。本研究通过优化的遗传转化体系, 将外源抗草丁磷基因转入谷子植株, 得到稳定持久的谷子抗除草剂品系, 将该品系与其他品种配制杂交组合, 秧苗期喷草丁膦药剂可有效清除田间杂草, 而不影响谷子的生长, 从而减轻人工除草的投入, 做到轻简栽培。本研究对于丰富目前缺乏的抗除草剂谷子品种和提高谷子生产效率具有重要意义。
4 结论
本研究探讨了幼穗大小、幼穗愈伤组织的诱导培养时间等对于愈伤组织状态及再生的影响。并通过热激处理的方式显著提高了谷子瞬时遗传转化效率, 确定了谷子抗除草剂基因的筛选浓度。通过已建立的转化体系获得了稳定遗传的抗草丁膦除草剂的谷子转基因材料。为以后谷子功能基因的验证奠定了坚实的基础, 并为谷子基因工程育种提供了良好的资源。
[1] Li H W, Li C H, Pao W K. Cytogenetical and genetical studies of the interspecific cross between the cultivated foxtail millet,(L.) Beauv., and the green foxtail milletL., 1945, 37: 32–54
[2] Zhang C, Zhang H, Li J X. Advances of millet research on nutrition and application., 2009, 22: 51–55
[3] Doust A N, Kellogg E A, Devos K M, Bennetzen J L. Foxtail millet: A sequence-driven grass model system., 2009, 149: 137–141
[4] Brutnell T P, Wang L, Swartwood K, Goldschmidt A, Jackson D, Zhu X G, Kellogg E, Eck J V.a model for C4photosynthesi., 2010, 22: 2537–2544
[5] 董云洲, 段胜军, 赵连元, 杨秀海, 贾士荣. 用基因枪转化花粉获得转基因谷子与玉米. 中国农业科学, 1999, 32(2): 112–115Dong Y Z, Duan S J, Zhao L Y, Yang X H, Jia S R. Production of transgenic millet and maize plants by particle bombardment.1999, 32(2): 112–115 (in Chinese with English abstract)
[6] Dong Y Z, Duan S J. Production of transgenic millet plants via particle bombardment., 2000, 20: 175–178
[7] Diao X M, Chen Z L, Duan S J, Liu Y L, Zhao L Y, Sun J S. Factors influencing foxtail millet embryogenic calli transformation by particle bombardments., 1999, 14: 31–36
[8] Wang Y F, Li W, Diao X M. Genetic transformation of foxtail millet mediated by., 2003, 7: 1–6
[9] Liu Y H, Feng X Y, Xu Y G, Yu J L, Ao G M, Peng Z M, Zhao Q. Overexpression of millet ZIPlike gene () affects lateral bud outgrowth in tobacco and millet., 2009, 47: 1051–1060
[10] Qin F F, Zhao Q, Ao G M, Yu J J. Co-suppression of, a maize pollen specifichomologous gene, results in aberrant anther development in foxtail millet., 2008, 163: 103–111
[11] 李丛. 谷子DREB类转录因子功能及其表达调控研究. 中国农业大学博士学位论文, 北京, 2014 Li C. The Function and Regulation of the Foxtail Millet DREBtype Transcriptional Factor. PhD Dissertation of China Agricultural University, Beijing, China, 2014 (in Chinese with English abstract)
[12] Martins P K, Ribeiro A P, Cunha B A D B, Kobayashi A K, Molinari H B C. A simple and highly efficienttransformation protocol for., 2015, 6: 41–44
[13] Martins P K, Nakayama T J, Ribeiro A P, Cunha B A D B D, Nepomuceno A L, Harmon F G, Kobayashi A K, Molinari H B C.floraldip: a simple and rapidtransformation method.2015, 6: 61–63
[14] Saha P, Blumwald E. Spikedip transformation of., 2016, 86: 89–101
[15] Ortiz J P A, Reggiardo M I, Ravizzini R A, Ahabe S G, Cervigni G D L, Spitteler M A, Morata M M, Elias F E, Valleios R H. Hygromycin resistance as an eficient selectable marker for wheat stable transformation., 1996, 15: 877–881
[16] Bevan M W, Flavell R B, Chihon M D. A chimaeric antibiotic resistance gene as a selectable marker for plant cell transformation., 1983, 304: 184–187
[17] Thompson C J, Mowa N R, Tizard R, Crameri R, Davies J E, Lauwcreys M, Botterman J. Characterization of the herbicideresistance gene bar from Streptomyees hygroseopicus., 1987, 6: 2519–2523
[18] Howe A R, Gasser C S, Brown S M, Padgette S R, Hart J, Parker G B, Fromm M E, Armstrong C L. Glyphosate as a selective agent for the production of fertile transgenie maize (L.) plants., 2002, 10: 153–164
[19] 孙敬三, 陈维伦. 植物生物技术和作物改良. 北京: 中国科学技术出版杜, 1990. pp 5–14 Sun J S, Chen W L. Plant Biotechnology and Crop Improvement. Beijing: China Science and Technology Press, 1990. pp 5–14 (in Chinese)
[20] 王天宇. 抗除草剂基因在作物杂种优势中的利用及进展. 作物杂志, 1998, (5): 33–34 Wang T Y. Utilization and progress of herbicide resistant genes in crop heterosis., 1998, (5): 33–34 (in Chinese)
[21] 张晓东, 李冬梅, 徐文英, 蒋有绎, 胡道芬, 韩立新. 利用基因枪将谷蛋白亚基基因与除草剂抗性基因导入小麦不同外植体获得转基因植株. 遗传, 1998, (增刊1): 5–10 Zhang X D, Li D M, Xu W Y, Jiang Y Y, Hu D F, Han L X. Transgenic plants were obtained by introducing theglutenin subunit gene and the herbicideresistance gene into different explants of wheat using gene gun., 1998, (suppl-1): 5–10 (in Chinese)
[22] 傅荣昭, 曹光诚, 马江生, 李文彬, 孙勇加, 陈占宽, 易明林, 郅玉宝, 林作辑. 用基因枪法将人工雄性不育基因导入小麦的研究初报. 遗传学报, 1997, 24: 358–361Fu R Z, Cao G C, Ma J S, Li W B, Sun Y J, Chen Z K, Yi M L, Zhi Y B, Lin Z Y. Preliminary study of transferring engineered male sterile gene into wheat via microgrojectile bombardment., 1997, 24: 358–361 (in Chinese with English abstract)
[23] Huang D N, Zhang S Q, Xue R, Hua Z H, Xie X B, Wang X L. A new method to identify and improve the purity of hybrid rice with herbicide resistant gene., 1998, 6: 1
[24] 王天宇, 石云素, 辛志勇, Darmency H. 抗除草剂谷子新种质的创制、鉴定与利用. 中国农业科技导报, 2000, (5): 62–66 Wang T Y, Shi Y S, Xin Z Y, Darmency H. Establishment, identification and utilization of new herbicide-resistant millet germplasm., 2000, (5): 62–66 (in Chinese)
[25] Naciri Y, Darmency H, Belliard J, Dessaint F, Pernès J. Breeding strategy in foxtail millet,L.Beauv. following interspecific hybridization., 1992, 60: 97–103
[26] Wang T Y, Darmency H. Dinitroaniline herbicide crossresistance in resistantlines selected from interspecific cross with., 1997, 49: 277–283
[27] Heap I M, Morrison I N. Resistance to aryloxyphenoxpropionate and cyclohexanedione herbicides in green foxtail ()., 1996, 44: 25–30
[28] Wang T Y, Darmency H. Crossresistance to aryloxyphenoxypropionate and cyclohexanedione herbicides in foxtail millet ()., 1997, 59: 81–88
[29] Maniatis T, Fritsch E F, Sambrook J F E F. Molecular Cloning: A Laboratory Manual, 2nd edn. New York: Cold Spring Harbor Laboratory Press, 1989. pp 304–331
[30] 柳琳. 根癌农杆菌介导的谷子遗传转化体系的构建. 河北师范大学硕士学位论文, 河北石家庄, 2010 Liu L.Mediated Transformation of Millet Genetic System. MS Thesis of Hebei Normal University, Shijiazhuang, China, 2010 (in Chinese with English abstract)
[31] Hiei Y, Ishida Y, Kasaoka K, Komari T. Improved frequency of transformation in rice and maize by treatment of immature embryos with centrifugation and heat prior to infection with., 2006, 87: 233–243
[32] 徐游. 农杆菌介导HiII玉米幼胚遗传转化效率及高效再生体系的研究. 江西农业大学硕士学位论文, 江西南昌, 2013 Xu Y.mediated Maize Immature Embryo HiII Genetic Transformation Efficiency and Efficient Regeneration System. MS Thesis of Jiangxi Agricultural University, Nanchang, China, 2013 (in Chinese with English abstract)
[33] Liu Y H, Yu J J, Zhao Q, Zhu D Y, Ao G M. Genetic transformation of millet () bymediated., 2005, 13: 32–37
[34] Lambe P, Dinant M, Matagne R. Differential long term expression and methylation of the hygromycin phosphotrans pherase () and (β-glucuronidase () genes in transgenic pearl millet () calli., 1995, 108: 51–62
[35] 牛玉红. 谷子抗除草剂基因的分子标记. 河北农业大学硕士学位论文, 河北保定, 2001 Niu Y H. Molecular Tagging of, A Gene Conferring Sethoxydim Resistance in Foxtail Millet ((L.) Beauv.). MS Thesis of Hebei Agricultural University, Baoding, Hebei, China, 2001 (in Chinese with English abstract)
Use ofGene for the Stable Transformation of Herbicide-resistant Foxtail Millet Plants
CHEN Qian-Nan1, 2, WANG Ke1, TANG Sha1, DU Li-Pu1, ZHI Hui1, JIA Guan-Qing1, ZHAO Bao-Hua2, YE Xing-Guo1, and DIAO Xian-Min1,*
1Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China;2College of Life Science, Hebei Normal University, Shijiazhuang 050024, Hebei, China
Efficiency ofgenetic transformation has been the main factor that restricts the study of functional genes and transgenic breeding in foxtail millet. In this study, foxtail millet variety Jigu 11 panicle primordia were used as explants. Young panicles of 0.5–1.0 cm in length were picked and cut into small pieces. The young embryos were cultured in modified MS medium for inducing embryogenic calli, totally forming 3120 embryogenic calli in 15–20 days. Soaking the calli in the infection suspension prior to transformation, and the heat treatment at 45°C for 3 min could effectively improve the transient genetic transformation efficiency by 26.1%. The transformed calli were screened with phosphinothricin (PPT), in which 513 were resistant calli, with the resistant calli rate of 16.4%. Seven herbicide-resistant plants were obtained after resistant calli differentiation and seedling culture. Six T0transgenic positive plants were identified by PCR and Southern blot. PPT resistance analysis was carried out on leaves in T3generation of transformed plants, and combined with Bar protein antibody test strip identification, the results confirmed that thegene stably incorporated into the genome of foxtail millet seedlings. This study established a stable genetic transformation system in foxtail millet, which is of great significance in improving the efficiency of molecular breeding, and prompting foxtail millet as a new model plants.
foxtail millet;; genetic transformation; heat shock; herbicide-resistant
2017-11-23;
2018-07-20;
2018-08-01.
10.3724/SP.J.1006.2018.01423
刁现民, E-mail: diaoxianmin@caas.cn
E-mail: qianying9201@163.com
本研究由国家自然科学基金项目(31501324, 31522040), 中国农业科学院基本科研业务费(Y2017JC15, CAAS-XTCX2016001-5, CAAS-XTCX2016002), 国家现代农业产业技术体系建设专项(CARS-06-13.5-A04)和中国农业科学院创新工程杂粮团队项目资助。
This study was supported by the National Natural Science Foundation of China (31501324, 31522040), the Fundamental Research Funds of CAAS (Y2017JC15, CAAS-XTCX2016001-5, CAAS-XTCX2016002), the China Agriculture Research System (CARS-06-13.5-A04), and the Agricultural Science and Technology Innovation Program of the Chinese Academy of Agricultural Sciences.
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180731.1121.004.html
