芥菜型油菜毛状根诱导体系构建及TTG1基因功能初步研究
2018-10-10伍小方张大为刘丽莉静周美亮张凯旋严明理
李 隆 程 成 伍小方 张大为 刘丽莉 周 静周美亮 张凯旋,* 严明理,*
芥菜型油菜毛状根诱导体系构建及基因功能初步研究
李 隆1,2程 成1,2伍小方1,2张大为1,3刘丽莉1,3周 静1周美亮2张凯旋2,*严明理1,3,*
1湖南科技大学生命科学学院, 湖南湘潭 411201;2中国农业科学院作物科学研究所, 北京 100081;3湖南科技大学重金属污染土壤生态修复与安全利用湖南省普通高等学校重点实验室, 湖南湘潭 411201
黄籽油菜具有种皮薄、出油率高等优点, 研究油菜黄籽的形成具有重要的意义。前期研究表明,(TRANSPARENT TESTA GLABRA 1)基因参与了油菜种皮颜色的形成。本研究利用发根农杆菌A4菌株诱导了芥菜型油菜四川黄籽的毛状根, 并研究了菌液浓度和外植体部位对诱导率的影响。结果表明, 菌液浓度OD值为0.8时, 诱导效率最高, 平均为71.5%; 外植体中下胚轴的发根率最高, 平均为87.3%。在四川黄籽毛状根中过表达基因, 发现原花色素合成途径中的(dihydroflavonol4-reductase)、(anthocyanidin synthase)和(anthocyanidin reductase)基因的表达受到抑制。本研究优化了油菜毛状根的诱导体系, 为利用毛状根体系进行基因功能验证提供了新的思路和方法。
芥菜型油菜; 毛状根; 诱导条件;基因; 原花色素
毛状根用于研究植物次生代谢活性物质在十几年来一直受到了很大关注, 以植物毛状根为反应器, 利用基因工程技术生产生物碱、蒽醌类、类黄酮、皂苷类、萜类等物质成为研究热点[1]。毛状根, 又称发状根、发根, 是发根农杆菌侵染植物后产生的一种病理状态, 具有生长速度快、转化效率高等特点。与毛状根体系相比, 传统的遗传转化体系要经历萌发培养、预培养、共培养、脱分化、生根培养等阶段; 在芥菜型油菜遗传转化体系过程中需要添加2,4-D (2,4-dichlorophenoxyacetic acid)预培养, 6-BA (6-benzylaminopurine)和AgNO3出芽分化, IAA (indole-3-acetic acid)和NAA (1-naphthylacetic acid)等生根培养, 其操作比较繁琐[2-3]。在毛状根中过表达基因或用RNA干扰技术来研究植物次生代谢产物成为一种快速有效的研究方法[4-5]。有研究报道, 转基因油菜毛状根比野生型毛状根富集Cd的能力强[6]。但是目前对油菜毛状根的研究报道较少, 芥菜型油菜毛状根培养还未有报道。
油菜种皮颜色的差异是由于黄酮生物合成途径中原花色素(proanthocyanidins)在种皮内皮细胞中是否沉积所引起的[7]。芥菜型油菜黄籽种皮中关键酶基因(dihydroflavonol4-reductase)、(anthocyanidin synthase)和(anthocyanidin reductase)不表达造成白花色苷、花色素、表儿茶素无法合成, 原花色素所需要的上游产物被阻断, 使色素无法积累, 导致种皮透明[8-10]。在拟南芥中, MYB类型转录因子TT2、bHLH类型转录因子TT8和WD40类型转录因子TTG1形成MBW复合物调控原花色素的生物合成, MBW复合体可以结合在等关键酶基因的启动子上, 控制和酶基因的表达来调控原花色素的生物合成[11-13]。甘蓝型油菜中基因可以调控种皮颜色和脂肪酸的含量[14]。芥菜型油菜基因的自然突变, 使MBW复合体不能结合和启动子而导致原花色素代谢途径不能正常表达, 原花色素无法积累, 种皮透明[15-16]。陈明训等[17]把谷子的基因转入拟南芥中,通过调控类黄酮途径相关酶基因的表达来影响色素积累, 改变了拟南芥的种皮颜色和厚度。在拟南芥突变体中, 类黄酮含量影响了生长素的运输和植物表型, 突变体根的长短、生长方向、花序多少、果角长度、侧根密度等性状都发生了改变[18]。在黄瓜中,参与调控植物的叶毛形成, 对外来生物侵害起到一定的防御作用, 也影响了黄瓜的表型[19]。目前基因参与油菜原花色素代谢途径的功能还未验证, 因此通过在毛状根中过表达基因, 可以分析基因在油菜原花色素代谢途径中的功能。
本研究对芥菜型油菜毛状根诱导体系做了探索,构建过表达载体并转入毛状根中进行功能的初步研究, 为利用和开发油菜种皮颜色基因奠定了基础。
1 材料与方法
1.1 试验材料
以芥菜型油菜四川黄籽(自交系, 种皮为黄色)为材料, 获得油菜组培苗。培养基类型为MS固体培养基; 光照时间为16 h d–1; 光照强度6000 μmol m–2s–1; 培养温度为(25±2)℃; 发根农杆菌A4菌株由中国农业科学院作物科学研究所荞麦基因资源创新研究组提供; 载体为pCAMBIA3301。
1.2 目的基因的克隆
利用TRIzol法提取油菜叶片总RNA, 按全式金生物试剂公司的说明书进行反转录操作, 以cDNA作为PCR模板。反转录反应体系为20 μL, 含2 μL RNase-free Water、10 μL 2×TS Reaction Mix、4 μL总RNA、1 μL gDNA Remover、1 μL Anchored Oligo(dT) Primer (0.5 g μL–1)、1 μL Random Primer (0.1 g μL–1)和1 μL Mixrans Script RT/RI Enzyme Mix。反转录程序为25℃ 5 min, 42℃ 1 h, 75℃灭活5 min, 室温冷却5 min, 反应完成后离心, 作为PCR反应的模板。参考已报道的芥菜型油菜基因CDS序列[20], 利用Primer5.0 软件引物设计, 上游引物序列为5′-ATGGATAACTCAGCTCCGGA-3′, 下游引物序列为5′-CTCAAACTCTAAGGAGCTGC A-3′。PCR反应总体系20 μL, 含1 μL反转录产物、上下游引物各1 μL (10 mmol L–1)、10 μL REMiX和ddH2O (补足到20 μL), 以上试剂购自北京天根生物公司。PCR反应程序为95℃预变性5 min; 94℃变性30 s, 55℃退火45 s, 72℃延伸1 min, 31个循环; 最后72℃延伸10 min。PCR结束后用1%琼脂糖凝胶电泳检测。将PCR产物用TaKaRa MiniBEST Plasmid Purification Kit Ver 4.0进行切胶回收纯化后, 连接到pMD19-T Vector (TaKaRa)上, 热激转化到大肠杆菌DH5α, 进行氨苄(Ampicillin)抗性筛选。挑取单克隆菌株进行液体培养, 用M13引物进行菌液PCR检测。选取含阳性质粒的菌液送北京奥科鼎盛生物科技有限公司用M13引物进行双向测序, 将测序结果进行拼接, 得到序列与文献上进行比对。应用DNAMAN软件将氨基酸序列进行多序列比对, 结果显示氨基酸序列一致。
1.3 载体的构建和转化
根据同源重组的方法在上下游引物前加入15 bp载体同源序列和酶切位点, 上游引物TTG1-F (5′- ACGGGGGACTCTTGACCATGGATGGATAACTCAGCTCCGGA-3′) 和下游引物TTG1-R (5′-GGGAAA TTCGAGCTGGTCACCCTCAAACTCTAAGGAGCTGCA-3′), 酶切位点为I和91 I。以T载体作为模板进行PCR扩增, PCR方法和体系与1.2相同, 切胶回收纯化与1.2相同。对pCAMBIA3301进行I和91 I双酶切。酶切体系为10 µL, 含质粒DNA 6 µL、I和91 I各1 µL、10×buffer Fly 1 µL、ddH2O补至10 µL, 37℃放置2 h。片段与纯化pCAMBIA3301连接。采用同源重组方式进行载体连接, 体系10 µL, 含PCR纯化产物1 µL、5× Ligation-Free Cloning Master Mix 4 μL、pCAMBIA 3301 2 µL、用ddH2O补至10 µL。反应条件为冰浴30 min。热激转化到大肠杆菌的方法和测序与1.2相同。农杆菌制备以及转化, pCAMBIA3301空载体转入农杆菌A4方法参照文献中报道的方法[21]。通过PCR鉴定转基因和基因的发根农杆菌A4。反应程序为95℃预变性5 min; 94℃变性30 s, 55℃退火45 s, 72℃延伸1 min, 31个循环, 最后72℃延伸10 min。PCR结束后用1%琼脂糖凝胶电泳检测。
1.4 油菜毛状根的诱导
用培养7 d的油菜幼苗的子叶和下胚轴作为外植体与发根农杆菌A4共培养。当农杆菌OD值为0.8时, 离心(5000 r min–1) 15 min, 去上清, 用等体积的MS液体培养基将其重悬。将外植体放入A4侵染液中接种5 min, 在无菌滤纸上吸干, 25℃在黑暗条件下MS固体培养基上共培养2 d后, 将外植体用含有头孢噻肟(100 mg L–1)的MS液体培养基漂洗5次, 并在无菌滤纸上吸干, 然后25℃光照条件下在含有100 mg L–1头孢噻肟MS琼脂培养基上培养。接种2~3周后, 切除单一生长根并接种在含有100 mg L–1头孢噻肟的MS培养固体基上。将毛状根在25℃黑暗中培养, 每5周继代一次, 将约100 mg根(3 cm长度)接种到含有40 mL液体MS培养基的150 mL锥形瓶中, 并在25℃的摇床(100 r min–1)上黑暗培养。转和基因的诱导方法与1.2相同, 最后在含Basta抗性的MS培养基上进行抗性筛选, 以获得转基因的无菌毛状根。
1.5 油菜毛状根诱导条件的优化
为寻找发根农杆菌促进芥菜型油菜毛状根发根的最佳菌液浓度, 分别用OD值为0.4、0.6、0.8、1.0的菌液侵染油菜外植体, 侵染方法与1.2相同。用子叶和下胚轴的发根率来评价外植体对毛状根发根率的影响。使用Microsoft Excel软件统计分析。
1.6 转基因毛状根的鉴定
采用CTAB法提取毛状根总DNA,引物设计为5'-AACGGGGAAACTCAGCAAGC-3'和5'-CA AATCGCCGCTTTGGACATA-3', 目的基因285 bp。引物设计为5'-TGACGCACAATCCCACTAT CCTT-3'和5'-CAGAACTCGCTCGTCTTGCTGTT-3'。目的基因488 bp, 通过PCR对转入基因和基因的毛状根进行鉴定, 反应程序为95℃预变性5 min; 94℃变性30 s, 55℃退火45 s, 72℃延伸1 min, 31个循环; 最后72℃延伸10 min。PCR反应结束后用1%琼脂糖凝胶电泳检测。
1.7 GUS染色鉴定转化效率
(1)用预冷的90%丙酮固定10 min, 4℃保存, 待用。用未添加X-Gluc的染色缓冲液润洗; (2)用预冷的染色缓冲液浸泡, 抽真空10 min, 37℃温育; (3)先后用50%、70%和100%的乙醇漂洗样品, 每次浸泡5 min; (4)加入100%乙醇浸泡直至完全脱色; (5)体视显微镜照相记录。
1.8 原花色素合成途径中基因的表达量分析
利用qRT-PCR对转基因的四川黄籽毛状根中的基因进行表达分析。RNA提取和cDNA合成方法同1.2。按照ChamQ SYBR qPCR Master Mix (Low ROX Premixed) (Vazume, Q3301-02)说明书分析表达量, 每个样品3次重复。PCR体系为ChamQ SYBR qPCR Master Mix 10 μL、0.5 μmol上下游引物各1 µL、cDNA 1 µL (50 ng μL–1)、RNase Free ddH2O补足至20 µL。在ABI 7500荧光定量PCR仪上进行反应, 反应程序为95°C预变性60 s; 95°C变性20 s, 55°C退火20 s, 72°C延伸45 s, 40个循环。反应结束后分析荧光值变化曲线和溶解曲线, 采用2–ΔΔCt的方法分析实验结果[22]。qRT-PCR引物相关信息见表1。
2 结果与分析
2.1 毛状根诱导过程
使用不同浓度(OD值分别为0.4、0.6、0.8、1.0) 的野生型农杆菌A4侵染四川黄籽子叶和下胚轴,当菌液OD值为0.8时, 发根率最高, 平均诱导效率为71.5% (图2)。当菌液浓度为0.8时, 使用不同外植体进行侵染时, 其下胚轴发根率明显高于子叶(表2)。未侵染成功的外植体1周以后开始产生褐色, 最终死亡。从诱导毛状根发根到转化培养, 再到生长充满整个培养瓶需要40~60 d。毛状根诱导过程如下, 将四川黄籽种子消毒处理后接种在MS固体培养基, 培养14 d (图1-A); 剪取油菜的无菌苗外植体, 使用A4侵染液侵染, 生长7 d的外植体诱导出的毛状根(图1-B); 继续培养14 d, 外植体上的毛状根长满整个培养基(图1-C); 剪取生长快速的毛状根移入新的培养基, 培养14 d后获得生长旺盛的毛状根(图1-D); 将获得的无菌毛状根接种至MS液体培养基中, 7 d后开始快速生长, 侧枝分支增加(图-E); 培养21 d后, 液体培养基中产生大量毛状根(图1-F)。

表1 qRT-PCR引物表
2.2 过表达载体的构建和转化的检测
载体构建时选用的是pCAMBIA3301载体, 把原始的基因切掉以后连接上基因。载体构建如图3所示, 把pCAMBIA3301载体转入发根农杆菌A4感受态中, 利用PCR对pCAMBIA3301-1的菌液进行阳性检测, 同时鉴定含有阳性质粒的毒性区、以及转移区的左右边界和, 引物序列参考王成龙[23]苦荞毛状根的诱导及高频再生体系的建立。由图4可知, 在转化过的农杆菌A4中检测出基因和基因, 说明pCAMBIA3301-和pCAMBIA3301质粒已经成功转入A4感受态中。
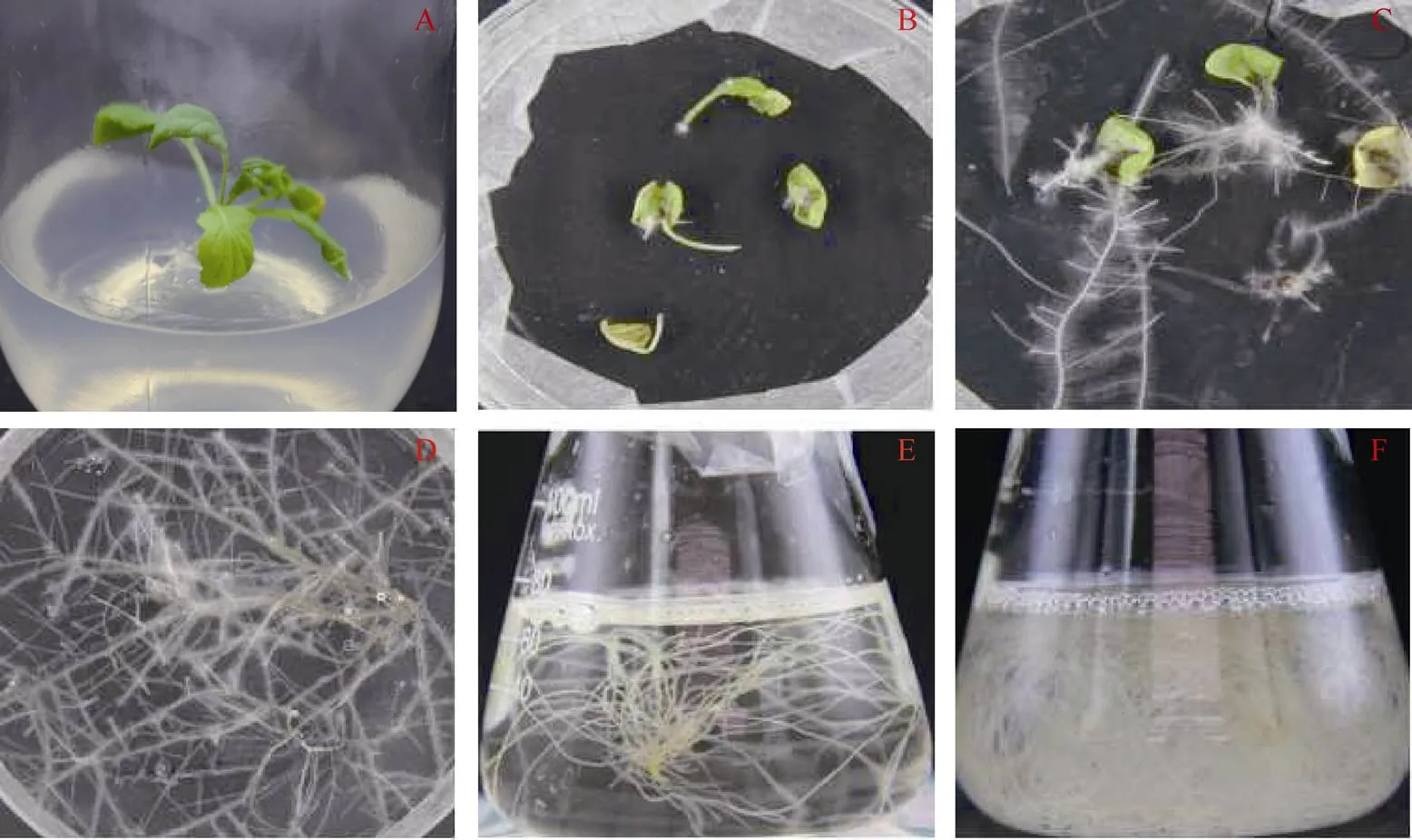
图1 毛状根的诱导过程
A: 14 d的四川黄籽油菜幼苗; B: 诱导7 d发根的外植体; C: 14 d以后的毛状根; D: 21 d以后转移到筛选培养基; E: 28 d在液体培养基上; F: 42 d以后的毛状根。
A: 14 d SY rape sterile seedling; B: 7 d explants with hairy roots; C: 14 d hairy roots; D: 21 d hairy roots on the screening medium; E: 28 d hairy roots in the liquid medium; F: 21 d hairy roots in the liquid medium.
表2 不同外植体对油菜毛状根诱导率的影响

Table 2 Effects of different explants on the induction rate of hairy roots
菌液浓度的OD值为0.8。不同小写字母标识表示差异显著(< 0.05)。
The OD value of the broth concentration was 0.8. Different lowercase letters indicated a significant difference (< 0.05).
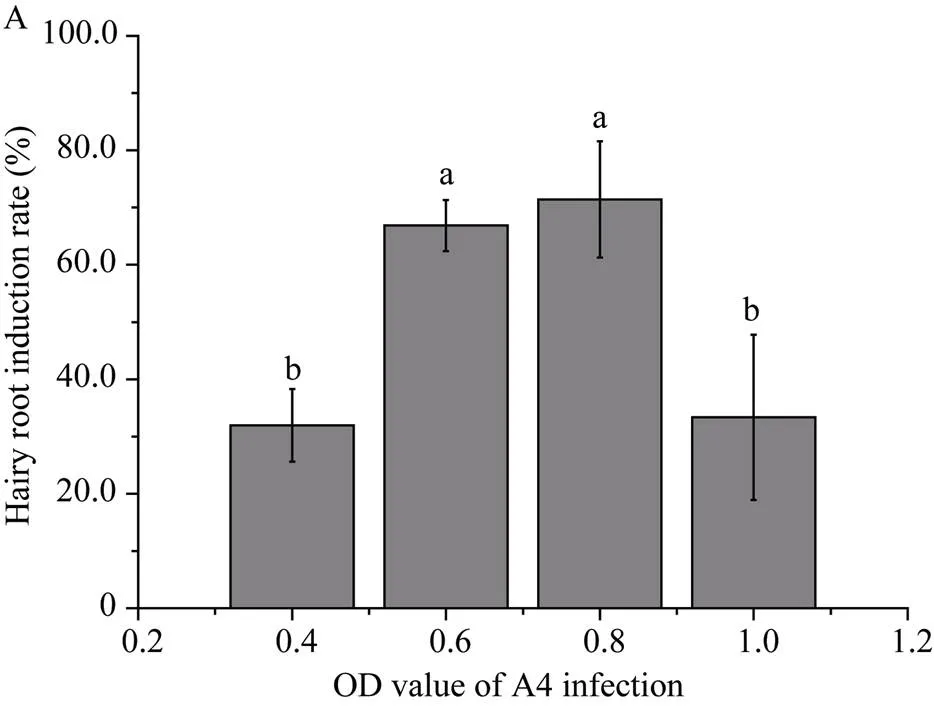
图2 不同浓度菌液对毛状根的诱导效率
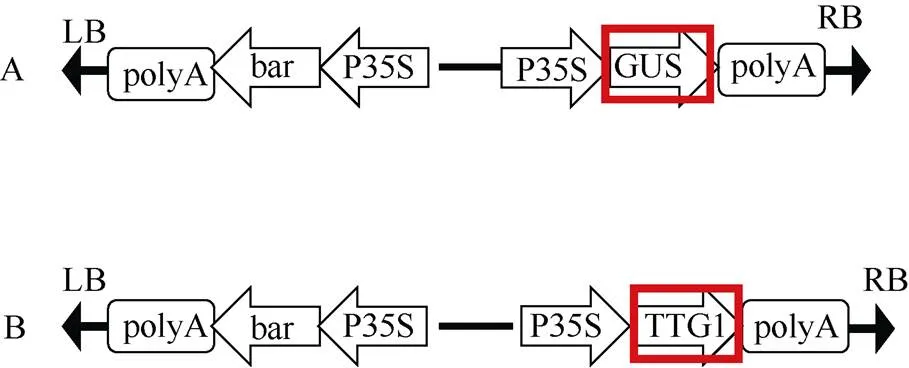
图3 载体构建图
A: pCAMBIA3301载体; B: 改造后的载体。
A: pCAMBIA3301 vector; B: pCAMBIA3301 vector containinggene.
2.3 转基因毛状根的检测
从转化的材料中选择了3个转基因的毛状根分别命名为Z1、Z2、Z3, 3个转基因的毛状根命名为T1、T2、T3, 检测均呈阳性, 由图5-A可知, 转基因毛状根PCR检测条带为285 bp, 说明基因已经成功转入毛状根中。由图5-B可知, 转基因毛状根的目的基因片段条带为488 bp, 说明基因已经成功转入毛状根中。随后对PCR鉴定为阳性的的转基因的Z1、Z2、Z3进行GUS染色(图6)。
2.4 转基因毛状根的生长分析
为进一步对转入和基因对毛状根的形态和生长状况进行分析。分别剪取约0.5 cm野生型四川黄籽油菜(图7-A1)、转基因(图7-B1)和转基因(图7-C1)的毛状根根尖, 置MS固体培养基上。培养2周左右, 分别获得野生型四川黄籽油菜(图7-A2)、转基因(图7-B2)、转基因(图7-C2)的毛状根生长状态。从图中可以看出, B2 (转基因)和C2 (转基因)的毛状根比野生型的A2生长速度快, 出现分枝数多且粗壮。
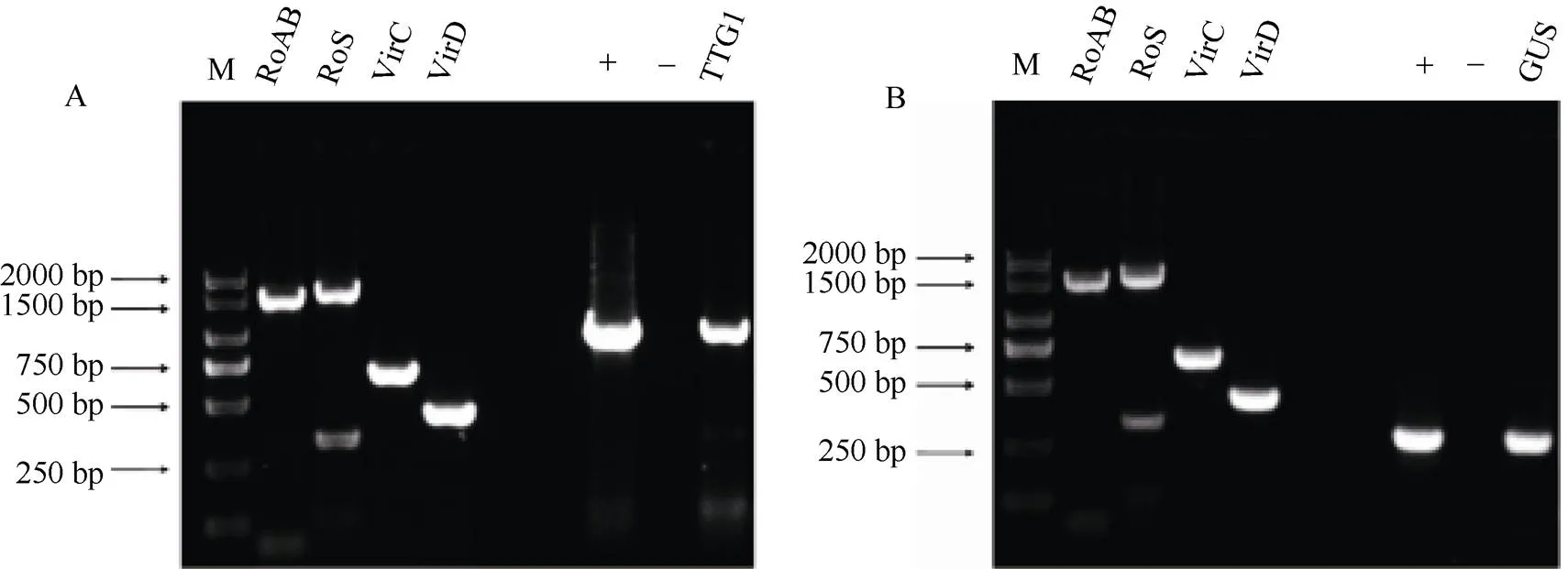
图4 转化菌液的检测
A: 35S-阳性检测结果。+: pCAMBIA3301-,-: H2O; B:阳性检测结果。+: pCAMBIA3301质粒,-: H2O。
A: identification ofgene inA4. +: pCAMBIA3301-,-: H2O; B: identification ofgene inA4. +: pCAMBIA3301 plasmid,-: H2O.

图5 转基因毛状根的鉴定
A: 转基因的3个根系Z1、Z2、Z3的PCR阳性检测。+: pCAMBIA3301质粒;-: 野生型毛状根; B: 转基因的3个根系T1、 T2、T3的PCR阳性检测。+: pCAMBIA3301-;-: 野生型毛状根。
A: three lines of hairy roots overexpressinggene tested by PCR. +: pCAMBIA3301 plasmid;-: wild type hairy roots; B: three lines of hairy roots overexpressinggene tested by PCR. +: pCAMBIA3301-;-: wild-type hairy roots.
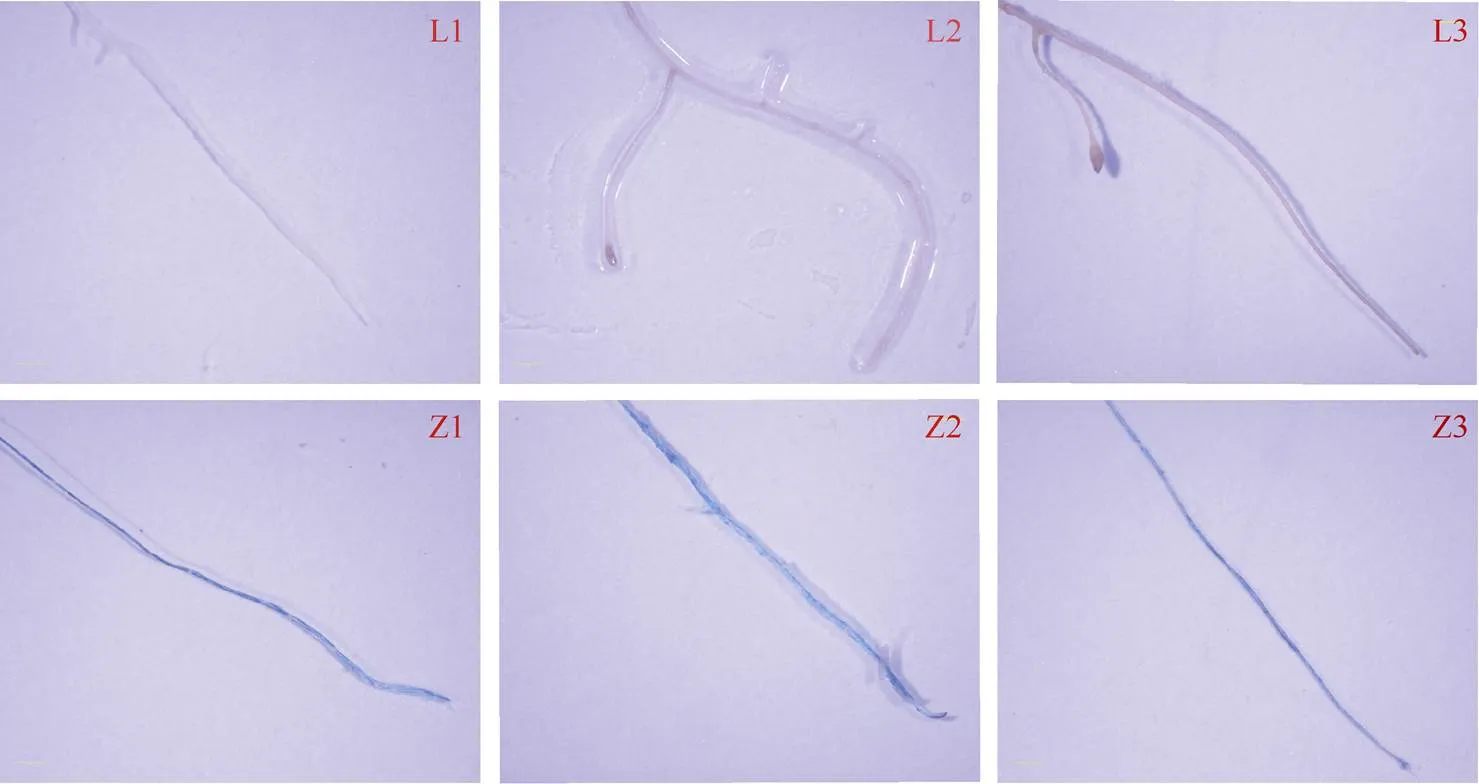
图6 野生型和转GUS基因毛状根的染色结果
L1、L2、L3: 野生型的3个根系; Z1、Z2、Z3: 含有基因的3个根系。
L1, L2, L3: three lines of wild-type hairy roots; Z1, Z2, Z3: three lines of hairy roots overexpressinggenes.

图7 野生型和转基因毛状根生长状况
A1: 野生型毛状根根尖转入0 d状态; B1: 转基因毛状根根尖0 d状态; C1: 转毛状根根尖0 d状态; A2: 野生型毛状根转入14 d状态; B2: 转基因毛状根14 d状态; C2: 转毛状根14 d状态。
A1: wild-type hairy root tip; B1:-overexpression hairy root tip; C1:-overexpressionhairy root tip; A2: 14 d old wild-type hairy roots; B2: 14 d old-overexpression hairy roots; C2: 14 d old-overexpression hairy roots.
2.5 基因表达量的检测
由图8可知, 与野生型相比, 转基因材料的基因表达量提高了1.5倍, 转基因毛状根中、和的表达受到了抑制, 表达量分别为野生型的0.4、0.6和0.3倍, pCAMBIA3301-载体转入毛状根中抑制了、和基因的表达。
A:基因; B:基因; C:基因; D:基因。
A:gene; B:gene; C:gene; D:gene.
3 讨论
3.1 毛状根的诱导条件的优化
建立快速稳定的芥菜型油菜毛状根体系和基因转化体系有助于外源基因的转入, 对转基因功能验证和次生代谢产物合成的研究有着重要的意义。本研究发现, 发根农杆菌A4侵染芥菜型油菜不同的部位, 毛状根诱导率存在很大差别, 下胚轴毛状根生长数明显高于子叶, 推断下胚轴是油菜毛状根产生的合适部位。另外, A4农杆菌OD值在0.8时诱导效率最高, 这个浓度对其他类型的农杆菌诱导油菜发根是不是最佳浓度需要进一步研究。转基因和基因比野生型毛状根粗大, 生长速度快而且分支数要多, 而转和基因之间却没有明显差别, 推断外植体被转化后有利于毛状根的形成。传统的油菜遗传转化体系是通过诱导愈伤组织等费时的操作, 得到T1代转基因苗要6个月以上[4], 本研究40 d就可以诱导出稳定的根系, 且毛状根体系不用加植物生长调节剂, 操作简单, 这为建立油菜快速的转基因体系提供了参考。本研究油菜毛状根体系的建立也可用于快速分析植物次生代谢通路中相关基因的表达。
3.2 TTG1基因表达与DFR、ANS和BAN基因表达的关系
在拟南芥突变体材料中,和基因表达水平会下降, 过表达促进了这3个酶基因的上调[24]。而本研究在黄籽油菜毛状根中, 过表达基因对和基因表达没有起到促进作用, 探究其原因, 可能是由于在四川黄籽中形成MBW复合体时,发生突变, MBW不能和、和启动子相结合, 不能加强这3个酶基因的表达[14-15], 即使在毛状根中过表达了, 也无法促使MBW复合体和这3个酶基因启动子相结合, 促进其下游基因的表达(图9)。正如岳迎春[7]在四川黄籽植株中过表达种皮并未变为黑色, 仍然透明, 而且种子变小败育。而在水稻中直接转入多个原花色素合成途径中的基因, 可以促进水稻胚乳中原花色素的积累, 白色变为紫色[25]。因此推断单独提高在四川黄籽植株中的表达量, 不能促进、和基因的表达。

图9 拟南芥原花青素代谢途径中TT2、TT8和TTG1形成MBW复合体调控DFR、ANS和BAN的示意图
PA代谢途径的酶基因分别为查尔酮合酶()、查尔酮异构酶()、黄烷酮3-羟化酶基因()、类黄酮3’-羟化酶基因()、二氢黄酮醇4-还原酶()、花青素合成酶()、花色素还原酶()、谷胱甘肽S-转移酶()和MATE次级转运子()。
The enzyme genes of the PA metabolic pathway arechalconesynthase (), chalconeisomerase(), flavanone3-hydroxylase(), flavonoid3'-hydroxylase (), dihydroflavonol4-reductase (), anthocyaninsynthase(), anthocyanidinreductase(), MATE secondary transporter(), and glutathione S-transferase().
4 结论
在芥菜型油菜四川黄籽中建立了毛状根发根和基因转化体系, 并利用GUS染色进行转化效率的鉴定。在该体系下过表达基因会导致、和基因下调表达。
[1] Zhou M L, Zhu X M, Shao J R, Tang Y X, Wu Y M. Production and metabolic engineering of bioactive substances in plant hairy root culture., 2011, 90: 1229–1239
[2] Largia M J V, Satish L, Johnsi R, Johnsi R, Shilpha J, Ramesh M. Analysis of propagation of(L.) from hairy roots, elicitation andA contents of Ri transformed plants., 2016, 32: 131
[3] 黄建安, 刘仲华. 毛状根培养与植物次生代谢物的生产. 微生物学杂志, 2003, 23(5): 35–39 Huang J A, Liu Z H. Cultivation of hairy roots and production of plant secondary metabolites., 2015, 23(5): 35–39 (in Chinese)
[4] 袁玉辉. 芥菜型油菜干扰载体的构建及遗传转化. 湖南农业大学硕士学位论文, 湖南长沙, 2013 Yuan Y H. The Construction ofInterference Vector and Genetic Transformation of(L.). MS Thesis of Hunan Agricultural University, Changsha, Hunan, China, 2013 (in Chinese with English abstract)
[5] 谢伶俐, 李加纳, 殷家明, 柴友荣, 许本波, 林呐. 根癌农杆菌介导转化甘蓝型油菜子叶基因瞬表达. 中国油料作物学报, 2007, 29(1): 9–13 Xie L L, Li J N, Yin J M, Chai Y R, Xu B B, Lin N. Transient expression ofgene in cotyledons of rapeseed mediated by., 2007, 29(1): 9–13 (in Chinese with English abstract)
[6] 刘静轶. 发根农杆菌介导基因转化镉超富集植物油菜的研究. 北京交通大学硕士学位论文, 北京, 2014Liu J T. Research on-mediatedGene Transformation in Cd HyperaccumulatorL. MS Thesis of Beijing Jiaotong University, Beijing, China, 2014 (in Chinese with English abstract)
[7] 岳迎春. 芥菜型油菜种皮颜色转录因子基因遗传转化体系优化及种皮色素分析. 湖南农业大学硕士学位论文, 湖南长沙, 2010 Yue Y C. Pigment Analysis of the Seed Coat Color Transcription Factor GeneGenetic Transformation System Optimization inMS Thesis of Hunan Agricultural University, Changsha, Hunan, China, 2010 (in Chinese with English abstract)
[8] 严明理, 刘显军, 刘忠松, 官春云, 袁谋志, 熊兴华. 芥菜型油菜4-二氢黄酮醇还原酶基因的克隆和表达分析. 作物学报, 2008, 34: 1–7 Yan M L, Liu X J, Liu Z S, Guan C Y, Yuan M Z, Xiong X H. Cloning and expression analysis of the dihydroflavonol 4-reductase gene in, 2008, 34: 1–7 (in Chinese with English abstract)
[9] Yan M L, Liu X J, Guan C Y, Chen X B, Liu Z S. Cloning and expression analysis of an anthocyanidin synthase gene homolog from., 2011, 28: 313–322
[10] Liu L L, Huang T, Ding S P, Wang Y, Yan M L.genes fromand: cloning, evolution and involvement in seed coat color., 2016, 155: 421–430
[11] Gonzalez A, Zhao M, Leavitt J M, Lloyd A M. Regulation of the anthocyanin biosynthetic pathway by the TTG1/bHLH/Myb transcriptional complex inseedlings., 2008, 53: 814–827
[12] Albert S, Delseny M, Devic M. BANYULS, a novel negative regulator of flavonoid biosynthesis in theseed coat., 1997, 11: 289–299
[13] Zhang F, Gonzalez A, Zhao M, Payne C T, Lloyd A. A network of redundant bHLH proteins functions in all TTG1-dependent pathways of., 2003, 130: 4859–4869
[14] Zhou L H, Li Y L, Hussain N, Li Z L, Wu D Z, Jiang L X. Allelic variation of BnaC..a and its association with seed coat color and fatty acids in rapeseed (L.)., 2016, 11: e0146661
[15] Padmaja L K, Agarwal P, Gupta V, Mukhopadhyay A, Sodhi Y S, Pental D, Pradhan A K. Natural mutations in two ohomoeologousgenes control yellow seed coat trait in allotetraploid(AABB)., 2014, 127: 339–347
[16] 刘显军. 芥菜型油菜黄籽基因克隆和黄籽形成机制分析. 湖南农业大学博士学位论文, 湖南长沙, 2013 Liu X J. Positional Cloning of the Gene for Seed Color and Molecular Mechanism of Yellow Seed Formation in. PhD Dissertation of Hunan Agricultural University, Changsha, Hunan, China, 2013 (in Chinese with English abstract)
[17] Liu K G, Qi S H, Li D, Jin C Y, Gao C H, Duan S W, Feng B L, Chen M X. TRANSPARENT TESTA GLABRA 1 ubiquitously regulates plant growth and development fromto foxtail millet ()., 2017, 254: 60–69
[18] Buer C S, Djordjevic M A. Architectural phenotypes in the transparent testa mutants of.2009, 60: 751–763
[19] Liu X W, Bartholomew E, Cai Y L, Ren H Z. Trichome-related mutants provide a new perspective on multicellular trichome initiation and development in cucumber (L)., 2016, 7: 1187
[20] 严明理. 芥菜型油菜黄籽形成的分子机理研究. 湖南农业大学博士学位论文, 湖南长沙, 2007 Yan M L. Studies on the Molecular Mechanism of Yellow- seeded Formation inPhD Dissertation of Hunan Agricultural University, Changsha, Hunan, China, 2007 (in Chinese with English abstract)
[21] 朱宽鹏. 芪合酶基因在何首乌毛状根中过量表达与dsRNA干扰. 华南理工大学硕士学位论文, 广东广州, 2012 Zhu K P. Double-stranded RNA-mediated Gene Silencing and Over-expression ofinThunb Hairy Roots. MS Thesis of South China University of Technology, Guangzhou, Guangdong, China, 2012 (in Chinese with English abstract)
[22] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-delta delta C(T)) method., 2001, 25: 402–408
[23] 王成龙. 苦荞毛状根的诱导及高频再生体系的建立. 四川农业大学硕士学位论文, 四川雅安 2015 Wang C L. Induction Hairy Roots and Established High- Frequency Plant Regeneration System of Tartary Buckwheat (Gaertn.), Ya’an, Sichuan, China, 2015 (in Chinese with English abstract)
[24] Hichri I, Barrieu F, Bogs J, Kappel C, Delrot S, Lauvergeat V. Recent advances in the transcriptional regulation of the flavonoid biosynthetic pathway., 2011, 62: 2465
[25] Zhu Q L, Yu S Z, Zeng D C, Liu H M, Wang H C, Yang Z F, Xie X R, Shen R X, Tan J T, Li H Y, Zhao X C, Zhang Q Y, Chen Y L, Guo J X, Chen L T, Liu Y G. Development of “purple endosperm rice” by engineering anthocyanin biosynthesis in the endosperm with a high-efficiency transgene stacking system., 2017, 10: 918–929
Construction of Hairy Root Induction System and Functional Analysis ofGene in
LI Long1,2, CHENG Cheng1,2, WU Xiao-Fang1,2, ZHANG Da-Wei1,3, LIU Li-Li1,3, ZHOU Jing1, ZHOU Mei-Liang2, ZHANG Kai-Xuan2,*, and YAN Ming-Li1,3,*
1College of Life Science, Hunan University of Science and Technology, Xiangtan 411201, Hunan, China;2Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China;3Key Laboratory of Ecological Remediation and Safe Utilization of Heavy Metal-Polluted Soils, Hunan University of Science and Technology, Xiangtan 411201, Hunan, China
Yellow seed rape has the advantages of thin seed coat and high oil yield. It is of great significance to study the formation of yellow seed in rapeseed. Previous studies showed that(TRANSPARENT TESTA GLABRA 1) gene was involved in the formation of seed coat color. In this study,A4 strain was used to induce hairy roots of Sichuan yellow, and investigate the effects of bacterial concentration and different sources of explants on hairy root induction. The highest average rooting rate was 71.5% when the OD value ofA4 reached to 0.8. The average rooting rate of hypocotyls was significantly higher than that of cotyledons and up to 87.3% after the infection. Overexpression ofgene in Sichuan yellow hairy roots inhibited the expression of(Dihydroflavonol4-reductase),(Anthocyanidin synthase), and(Anthocyanidin reductase) genes, encoding key enzymes of the proanthocyanidins biosynthesis. In this study, we optimized the induction system of hairy roots in, and analyzed the function ofin the regulation of proanthocyanidins synthesis pathway, which provide a new idea and method for the functional analysis of genes in the hairy root system.
; hairy root; inducing condition;gene; proanthocyanidins
2018-02-14;
2018-06-12;
2018-07-02.
10.3724/SP.J.1006.2018.01468
严明理, E-mail: ymljack@126.com; 张凯旋, E-mail: zhangkaixuan@caas.cn
E-mail: 297478443@qq.com
本研究由国家重点研发计划项目(2016YFD0100202), 湖南省自然科学基金项目(2016JJ1010), 国家自然科学基金项目(31572457)和湖南省教育厅项目(17K035)资助。
This study was supported by the National Key Research and Development Program (2016YFD0100202), the Natural Science Foundation of Hunan Province (2016JJ1010), the National Natural Science Foundation of China (31572457), and the Foundation of Hunan Education Department (17K035).
URL:http://kns.cnki.net/kcms/detail/11.1809.S.20180629.1901.012.html
