UV-B胁迫下Ca2+对颠茄生理特性与次生代谢产物的调控研究
2018-10-10卢克欢廖志华吴能表
卢克欢 刘 兴 杨 怡 廖志华 吴能表,*
UV-B胁迫下Ca2+对颠茄生理特性与次生代谢产物的调控研究
卢克欢1刘 兴1杨 怡1廖志华2吴能表1,*
1西南大学生命科学学院/ 三峡库区生态环境教育部重点实验室, 重庆 400715;2西南大学生命科学学院, 重庆 400715
有害中波紫外线(Ultraviolet B, UV-B; 280~320 nm)辐射影响植物的生长和发育, Ca2+是植物生长发育所必须的大量元素之一, 外源Ca2+不但可以提高植物抗胁迫能力, 还对次生代谢具有调控作用。以颠茄(L.)实生苗为材料, 在UV-B辐射(10 μW cm–2)背景下, 研究不同浓度外源Ca2+、不同处理时间对颠茄生理特性、氮代谢、次生代谢产物含量以及托品烷类生物碱代谢途径中3个关键酶基因表达量的影响。结果表明, 随着UV-B辐射时间的延长(4 ~12 d), 对颠茄的光合作用、氮代谢以及生物碱的积累产生抑制作用, 加剧了膜脂氧化程度; 经外源Ca2+处理, 叶片初始荧光(o)、丙二醛(malondialdehyde, MDA)含量呈下降趋势, 叶片最大光化学效率(vm)、光合色素(总叶绿素、类胡萝卜素)含量、抗氧化酶(SOD、POD、CAT)活性均呈上升趋势, 说明Ca2+有利于缓解UV-B辐射的抑制, 加强对UV-B胁迫的抗性; 在Ca2+处理下, 叶片中硝态氮含量显著降低, 游离氨基酸、可溶性蛋白含量和氮代谢关键酶(NR、GS、GDH)的活性显著提高, 叶片中莨菪碱含量和东莨菪碱含量显著提高; qRT-PCR分析显示, 在外源Ca2+的诱导下, 托品烷类生物碱合成途径中3个关键酶基因(、、)表达量均有不同程度上调趋势。本研究结果可为田间种植提供理论参考。
UV-B胁迫; 颠茄; 生理特性; 氮代谢; 托品烷类生物碱
颠茄(L.), 茄科颠茄属, 多年生草本植物, 全草可入药, 是我国药典规定的托品烷类生物碱(tropane alkaloids, TAs)药源植物[1]。TAs包括莨菪碱和东莨菪碱, 是一类重要的抗胆碱药物, 提取自茄科植物的次生代谢产物, 具有多方面的药用价值, 广泛用于麻醉、镇痛、止咳、平喘、抗晕动病, 也可用于控制帕金森病的僵直和震颤[2-3]。颠茄中的TAs含量极低, 有着较高的药用价值, 且市场需求量巨大。颠茄作为托品烷类生物碱的重要药源植物, 如何提高其次生代谢产物莨菪碱和东莨菪碱的合成具有十分重要的医药应用价值。
地球的大气臭氧层是抵抗紫外辐射的保护层, 它能够有效吸收强烈的太阳光带来的紫外线辐射, 保护地球上的生物免受伤害。随着工业化发展的进程, 氟氯烷烃和氮氧化物的大量排放, 导致地球臭氧层变薄甚至出现空洞, 到达地表的有害中波紫外线逐渐增强, 对植物的生长极为不利[4-5]。UV-B不仅作为一种环境胁迫导致植物DNA损伤、细胞分裂停滞、细胞死亡以及生长受抑制, 也能够调控植物形态建成与营养生长, 同时影响包括类黄酮、单宁等多种次生代谢物合成。
钙是植物体内不可或缺的矿物质元素, 同时也是维持植物细胞正常生长代谢的重要离子, 作为偶联细胞外信号的第二信使, 在维持细胞膜结构及细胞膜结合蛋白稳定性、调控多种酶活性方面都具有重要作用[6-7]。Ca2+和钙调素参与胁迫信号的感受、传递、响应与表达等过程, 以增强植物抗逆性[8]。Ca2+在逆境条件下可以保持植物细胞壁、细胞膜的稳定性[9], 激活或抑制细胞内特定酶的活性, 调节逆境中植物体内的生理生化反应[10-11]。外施Ca2+可以增强盐胁迫下唐古特白刺氮代谢中关键酶的活性,促进对无机氮源的吸收, 保护氮代谢途径不受盐胁迫的破坏[12]; 在干旱胁迫下, Ca2+可以促进黄瓜幼苗的生长, 提高叶片的叶绿素的含量、净光合速率、蒸腾速率以及水分利用率, 降低膜脂过氧化程度及脯氨酸和可溶性蛋白的积累量, 缓解干旱对黄瓜幼苗的不利影响, 从而增强植株对干旱胁迫的抗性[13]; 适宜浓度的外源Ca2+能明显改善低温胁迫对玉米幼苗生长的抑制作用, 提高玉米幼苗在低温胁迫下的适应能力[14]。此外, 外源Ca2+对植物的次生代谢也起着显著作用, 外源Ca2+可以影响水蓼细胞中黄烷醇[15]、曼陀罗细胞中莨菪碱[16]、田七细胞中人参皂苷Rb1[17]和咖啡细胞中生物碱[18]等次生代谢物的生物合成与积累。Ca2+对于提高植物逆境适应性及次生代谢调控具有重要的生理作用, 其是否参与调控颠茄在UV-B胁迫条件下的逆境适应性和次生代谢产物的合成还有待探究。本试验旨在探究UV-B胁迫条件下, 外源Ca2+对颠茄光合及耐逆生理特性、次生代谢产物积累方面的功能, 对于提高颠茄次生代谢产物托品烷类生物碱的合成具有一定指导意义。
1 材料与方法
1.1 材料
颠茄(L.)种子购自湖南芝茵农业开发有限责任公司, 并经西南大学生命科学学院吴能表教授鉴定。
挑选颗粒饱满的颠茄种子, 充分浸润后置湿润滤纸上, 待萌发后移栽至盛有混匀介质(泥炭土∶珍珠岩∶蛭石= 3∶1∶1)的营养盆(12 cm×13 cm)中, 每盆3株, 共300盆, 于25°C温室内培养, 每7 d浇灌一次稀释10倍的MS营养液, 2个月后, 挑选200盆长势一致的颠茄幼苗, 开始试验处理。以颠茄叶片中MDA含量和抗氧化酶(SOD、POD、CAT)活性的变化为参考标准, 经预实验确定UV-B胁迫所用的辐照强度为10 μW cm–2, 参照杨卫星等[19]研究中的处理浓度并结合预实验结果, 选取5个CaCl2溶液梯度浓度, 每天12:00—12:40进行相同强度的UV-B照射, 同时以CaCl2喷施叶片至溶液欲滴, 处理方式见表1。
分别在第4、第8和第12天采集颠茄叶片, 存放于-80°C冰箱, 用于各项指标的测定。另采集颠茄根、叶组织材料, 一部分冻存于液氮中, 用于基因表达量的测定; 另一部分于70°C烘箱中烘干, 用于生物碱含量的测定。设置每处理组3次重复。
1.2 方法
1.2.1 叶绿素荧光动力学参数o和vm的测定
将颠茄植株暗处理2 h, 选择长势一致且较为平展的叶片(避开主叶脉)用叶绿素荧光仪PAM-2100 (WALZ, 德国)测定初始荧光(o)和最大光化学效率(vm), 取3次数据的平均值。
1.2.2 光合色素与MDA含量的测定 参照张宪政[20]的方法, 称取0.2 g新鲜的颠茄叶片, 去中脉, 剪成细丝状, 置黑暗条件下浸泡于20 mL丙酮-乙醇混合液(1∶1) 72 h至白色。取上清液3 mL于石英比色皿中, 测吸光值663、645和470, 计算叶绿素含量和类胡萝卜素含量。参照Velikova等[21]的硫代巴比妥酸(thiobarbituric acid, TBA)法测定MDA含量。

表1 颠茄幼苗的处理组合
1.2.3 抗氧化酶活性的测定 参照Giannopolitis和Ries[22]的方法测定超氧化物歧化酶(superoxide dismutase, SOD)活性, 通过观察NBT的光还原抑制程度, 将能够抑制反应酶量的50%定义为1个SOD活力单位(U); 采用愈创木酚法[23]测定过氧化物酶(peroxide, POD)活性, 将每分钟470值升高0.01定义为1个酶活力单位(U); 参照高俊凤[24]的方法测定过氧化氢酶(catalase, CAT)活性, 将每分钟240下降0.1定为一个酶活力单位(U)。
1.2.4 硝态氮、游离氨基酸和可溶性蛋白含量的测定 参照高俊凤[24]的方法测定硝态氮含量。NO3–与水杨酸生成硝基水杨酸, 在碱性条件下(pH > 12)呈黄色, 检测410值反映硝态氮的含量; 参照李合生[25]的茚三酮溶液显色法测定游离氨基酸含量; 参照高俊凤[24]的考马斯亮蓝法测定可溶性蛋白含量。
1.2.5 GS、NR和GDH活性的测定 采用汤绍虎等[26]的方法测定谷氨酰胺合成酶(glutamine synthetase, GS)活性。在ATP和Mg2+存在下, GS催化植物体内谷氨酸形成谷氨酰胺, 谷氨酰胺转化为γ-谷氨酰基异羟肟酸, 进而在酸性条件下与铁形成红色络合物, 在540 nm处有最大吸收峰, 即以γ-谷氨酰基异羟肟酸与铁络合物的生成量来表示GS酶活性; 采用南京建成生物工程研究所生产的试剂盒分别测定硝酸还原酶(nitrate reductase, NR)活性与谷氨酸脱氢酶(glutamic dehydrogenation enzyme, GDH)活性。
1.2.6 莨菪碱与东莨菪碱的提取与测定 参照Zárate等[27]的方法, 略有改动, 提取颠茄叶片中莨菪碱和东莨菪碱; 用HPLC测定其含量, 色谱仪为日本岛津(Shimadzu) LC-60A高效液相色谱仪(泵: LC-20AD, 控制器: SPD-20A, 柱温箱: CTO-10AS vp); 色谱柱为Ultimate XB-C18液相色谱柱(5 µm, 4.6 mm×250.0 mm); 流动相为甲醇∶醋酸缓冲液(20 mmol L–1醋酸铵, 0.1%甲酸, pH 4.0) = 1∶4; 检测波长226 nm; 流速1.0 mL min–1; 柱温40°C; 进样量10 µL。
1.2.7 总RNA的提取及cDNA的合成 按照Biospin多糖多酚植物总RNA提取试剂盒使用说明提取总RNA。按照TIANGENFastQuant RT Kit (with gDNase)说明书操作步骤进行颠茄根、叶RNA的反转录, gDNA去除反应体系10 μL, 分别为5×gDNA buffer 2 μL, 17.5 ng μL–1Total RNA 8 μL, 反应条件为42°C孵育3 min, 冰浴暂存; 反转录反应体系10 μL, 分别为10×Fast RT buffer 2 μL、RT Enzyme Mix 1 μL、FQ-RT Primer Mix 2 μL、RNase-Free ddH2O 5 μL; 将10 μL反转录反应体系加入到去基因组DNA污染的Total RNA, 反应条件为42°C 15 min, 95°C 3 min, 冰浴5 min, 获得cDNA。
1.2.8 引物设计与qRT-PCR、、和基因引物根据NCBI上公布的序列设计及参照强玮等[28-29]的引物序列, 由英潍捷基(上海)贸易有限公司合成(表2)。采用Promega GoqPCR Master Mix试剂盒使用说明检测, 反应体系20 µL, 分别为GoqPCR Master Mix 10.0 µL、各基因上游引物 (10 µmol L–1) 0.4 µL、各基因下游引物(10 µmol L–1) 0.4 µL、cDNA模板2.0 µL、ddH2O 7.2 µL。反应条件为Stage 1 预变性, 95°C 10 min; Stage 2扩增循环, 95°C 15 s, 60°C 1 min, 共40循环; Stage 3溶解曲线, 95°C 5 s, 60°C 15 s, 95°C 15 s。依制造商的操作说明在Bio-Rad IQ5荧光定量PCR仪(Bio-Rad, USA)上完成, 以为内参基因, 实验数据采用Pfaffl Method法计算得出结果。
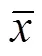

表2 荧光定量PCR所需引物
2 结果与分析
2.1 UV-B胁迫下不同浓度Ca2+对颠茄叶片Fo和Fv/Fm的影响
叶绿素荧光参数可以较为灵敏地反映光合作用的变化情况, 被称为研究植物光合功能的快速、无损伤探针[30]。初始荧光o表示PS II反应中心处于完全开放时的荧光产量。在UV-B胁迫下, 在各处理时间段内, T1组比T0组的o显著升高, 并随着处理时间的增加逐渐增大; 喷施不同浓度Ca2+处理后, 不同处理组较T1有不同程度的回落现象, 且当处理时间为12 d、浓度为6 mmol L–1时缓解效果最为显著(图1-A)。
v/m代表PS II的最大光化学效率, 是较为常用的叶绿素荧光指标之一, 此指标在胁迫条件下通常会降低[31], 同时也可以表明PS II遭受到破坏[32]。在UV-B胁迫下, T1处理组的v/m相对T0组显著降低, 随着处理时间的延长, T1处理组的vm呈下降趋势, 经不同浓度Ca2+处理后, 在各时间段均呈现出先升高后降低趋势, 在处理第12天中, 当Ca2+浓度为4 mmol L–1时, 与T1相比大幅提高, 缓解效果最显著(图1-B)。
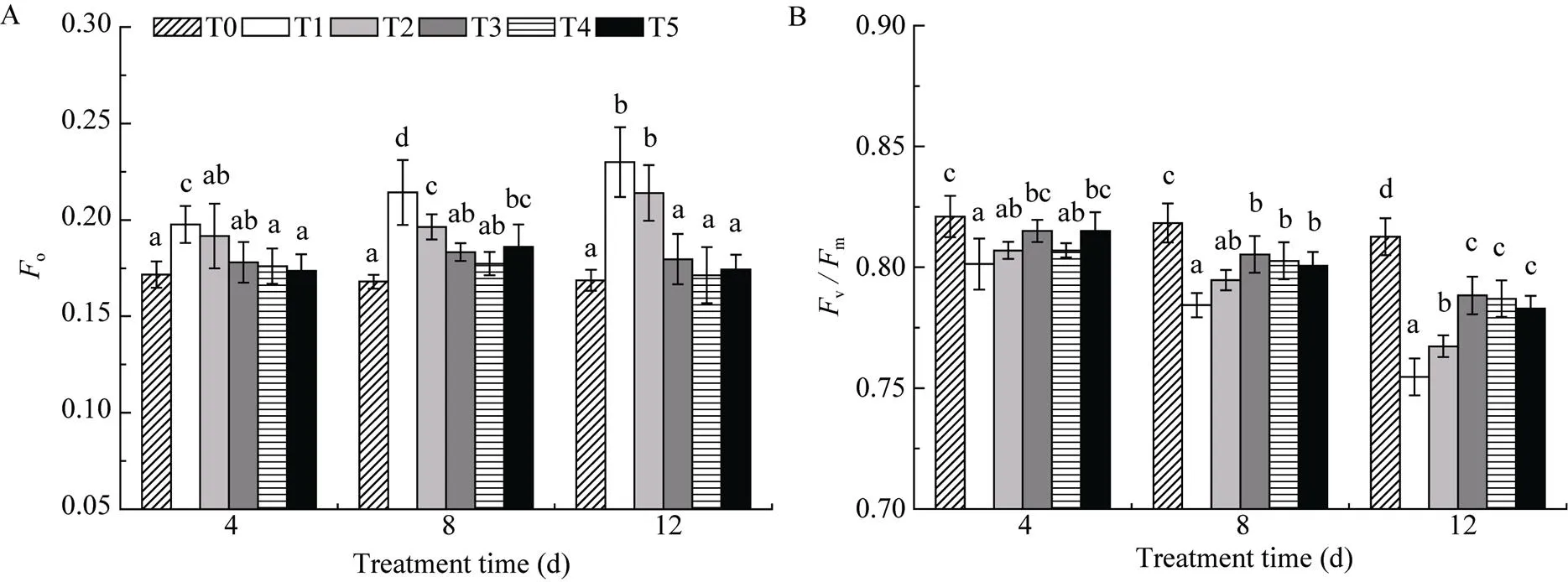
图1 UV-B胁迫下不同浓度Ca2+对颠茄初始荧光(A)和最大光化学效率(B)的影响
不同小写字母表示相同处理时间不同浓度Ca2+处理间差异显著(<0.05)。T1至T5分别代表UV-B胁迫下不同浓度Ca2+处理组, 分别为0 mmol L–1、2 mmol L–1、4 mmol L–1、6 mmol L–1和8 mmol L–1。T0表示未进行任何处理, 即空白对照组。
Bars superscripted by different letters are significantly different among different treatments of Ca2+concentration in the same treating days at the 0.05 level. T1 to T5 indicate different treatments of Ca2+concentration (0, 2, 4, 6, and 8 mmol L–1) under UV-B stress. T0 indicates untreated blank control groups.
2.2 UV-B胁迫下不同浓度Ca2+对颠茄叶片中光合色素含量的影响
在植物叶片中, 叶绿素含量与类胡萝卜素含量是表征植物体光合能力的重要指标。由图2可知, T1组随着UV-B处理时间的延长, 颠茄叶片中的叶绿素含量与类胡萝卜素含量逐渐降低; 在各处理时间段内, T1组的叶绿素含量和类胡萝卜素含量比T0对照组显著降低, 经过喷施不同浓度Ca2+溶液处理后, 二者均有不同程度的上升趋势。当Ca2+溶液浓度为6 mmol L–1时效果最显著, 如在处理12 d时, T4组相比T1组, 总叶绿素含量与类胡萝卜素含量分别提高了64.8%和56.1%。说明适宜浓度的外源Ca2+有助于促进叶绿素和类胡萝卜素的合成, 有效缓解UV-B辐射对光合膜的破坏, 从而有利于颠茄在UV-B迫下增强其光合能力。
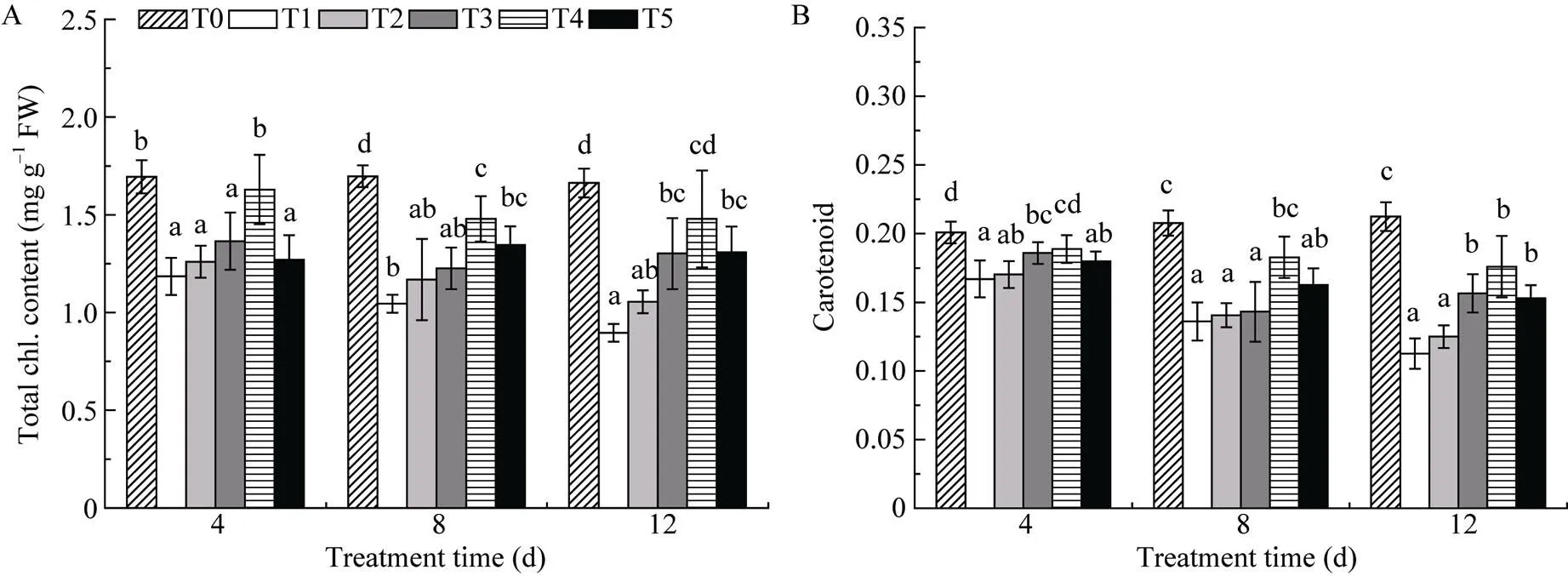
图2 UV-B胁迫下不同浓度Ca2+对颠茄叶片中总叶绿素含量(A)与类胡萝卜素含量(B)的影响
不同小写字母表示相同处理时间不同浓度Ca2+处理间差异显著(< 0.05)。T1至T5分别代表UV-B胁迫下不同浓度Ca2+处理组, 分别为0、2、4、6和8 mmol L–1。T0表示未进行任何处理, 即空白对照组。
Bars superscripted by different letters are significantly different among different treatments of Ca2+concentration in the same treating days at the 0.05 probability level. T1 to T5 indicate different treatments of Ca2+concentration (0, 2, 4, 6, and 8 mmol L–1) under UV-B stress. T0 indicates untreated blank control groups.
2.3 UV-B胁迫下不同浓度Ca2+对颠茄抗氧化酶活性和MDA含量的影响
植物体中抗氧化酶活性的变化在一定程度上可反映出植物体抗逆性的强弱[33]。对于T1处理组, SOD和POD活性的变化基本一致, 均随UV-B处理时间的增加呈先升后降趋势(图3-A, B)。CAT的活性在T1处理下, 随处理时间的延长持续下降(图3-C)。UV-B处理的第8天和第12天, T1组中SOD、POD和CAT三种酶的活性比T0对照组均显著降低, 说明UV-B辐射对颠茄的抗氧化系统产生了胁迫效应, 且随着处理时间的增加其胁迫效应愈加严重。在不同浓度Ca2+处理下, 3种抗氧化酶的活性均有不同程度提高, 在各处理时间范围内, 当Ca2+浓度为4 mmol L–1和6 mmol L–1时缓解效果较为显著。
MDA是膜脂过氧化的产物, 可以作为衡量植物膜脂过氧化的程度。在UV-B辐射处理下, MDA含量比T0对照组大幅升高, 且随着UV-B处理时间的延长呈逐渐升高趋势。在UV-B辐射背景下, 经不同浓度外源Ca2+处理后发现, 在3个不同的处理时间段内, MDA含量均显著降低。表明外源Ca2+可缓解UV-B辐射对颠茄膜系统的损害程度。其中, 在处理12 d, T4组MDA含量比T1组降低了52.2%, 缓解效果最显著(图3-D)。
2.4 UV-B胁迫下不同浓度Ca2+对颠茄氮代谢的影响
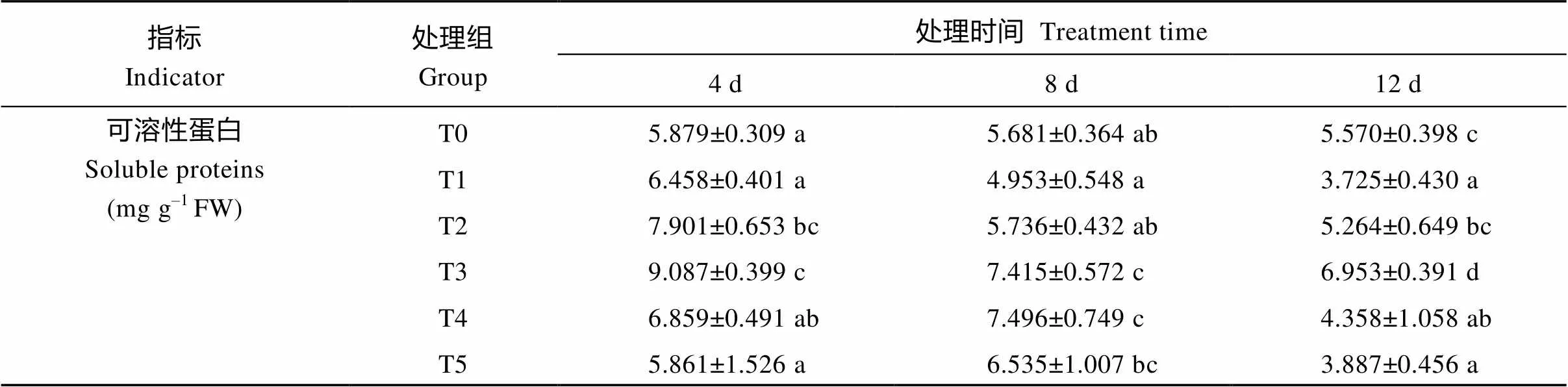
硝态氮是能够被植物根部直接吸收的氮源, 植物吸收的无机氮源经一系列的还原与同化作用后形成游离氨基酸、可溶性蛋白等有机含氮化合物[34], 它们的含量是氮代谢的重要指标, 直接反映氮代谢的基本进程。由表3可知, 随着UV-B处理时间的延长, T1处理组硝态氮含量逐渐增加, 经喷施Ca2+溶液后, 各处理组的硝态氮含量随着处理时间的增加呈先降低后升高的趋势, 同时在相同处理时间下, 其含量也随着Ca2+浓度的升高而降低。在UV-B辐射下, T1组游离氨基酸含量和可溶性蛋白含量比T0组显著降低, 且随着UV-B处理时间的延长, 游离氨基酸含量逐渐降低, 可溶性蛋白含量在处理第4天有所升高, 随后开始持续降低, 经不同浓度Ca2+处理后, 对于相同的处理时间, 两者含量相对T1组升高显著。表明UV-B辐射有利于颠茄叶片中硝态氮的积累, 但不利于对硝态氮的利用, 从而使游离氨基酸和可溶性蛋白等含氮化合物含量降低, 不利于氮代谢的进行。在Ca2+处理下, 加速了硝态氮的同化, 使游离氨基酸和可溶性蛋白含量显著升高, 表明外源Ca2+可以有效缓解UV-B胁迫对氮代谢进程的抑制, 有利于氮代谢的进行。
在氮代谢途径中, 硝酸还原酶(NR)是催化硝态氮转化为NH4+-N的酶, 而NH4+-N与α-酮戊二酸在谷氨酸脱氢酶(GDH)的催化下进一步形成Glu; 同时, 谷氨酰胺合成酶(GS)是氮代谢过程中的另一个关键酶, 能催化NH4+-N和Glu合成谷氨酰胺, 对于高等植物同化NH4+-N具有重要的作用[35]。由表4可知, UV-B辐射处理使叶片中NR、GS和GDH酶活性显著降低。T1处理组中, 在UV-B胁迫下NR和GS活性随着处理时间的延长逐渐降低, 而GDH则是先增大后减小的趋势。经过不同浓度的Ca2+处理后, 相同处理时间内, 3个关键酶的活性均有不同程度的升高趋势。对于NR和GS, 当Ca2+浓度为6 mmol L–1时效果最显著, 对于GDH则是4 mmol L–1效果最佳。以上结果表明, 短期UV-B辐射可以激活GDH活性的增大, 但是总体来看, UV-B辐射抑制了NR、GS和GDH的活性, 不利于颠茄氮代谢的进行。在适宜浓度外源Ca2+处理下, 可显著提高3种关键酶的活性, 缓解UV-B胁迫对颠茄氮代谢关键酶活性的抑制作用, 从而加速颠茄对无机氮源的同化作用。

图3 UV-B胁迫下不同浓度Ca2+对颠茄抗氧化酶活性(A, B, C)、丙二醛含量(D)的影响
不同小写字母表示相同处理时间不同浓度Ca2+处理间差异显著(< 0.05)。T1至T5分别代表UV-B胁迫下不同浓度Ca2+处理组, 分别为0、2、4、6和8。T0表示未进行任何处理, 即空白对照组。
Bars superscripted by different letters are significantly different among different treatments of Ca2+concentration in the same treating days at the 0.05 probability level. T1 to T5 indicate different treatments of Ca2+concentration (0, 2, 4, 6, and 8 mmol L–1) under UV-B stress. T0 indicates untreated blank control groups.
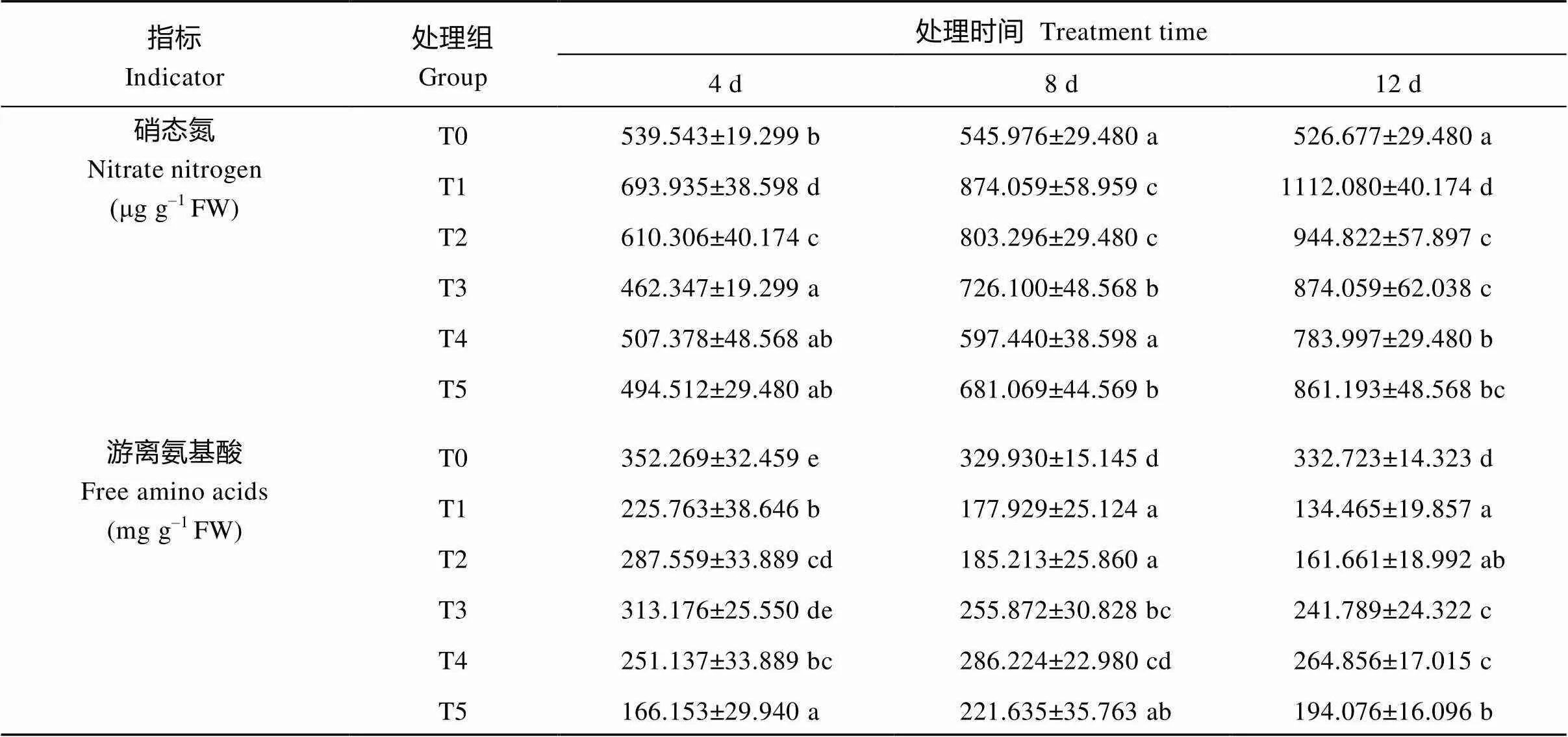
表3 UV-B胁迫下不同浓度Ca2+对颠茄硝态氮、游离氨基酸和可溶性蛋白含量的影响
(续表3)
表中同一列数据上标以不同小写字母表示差异显著(< 0.05)。T1至T5分别代表UV-B胁迫下不同浓度Ca2+处理组, 分别为0、2、4、6和8 mmol L–1。T0表示未进行任何处理, 即空白对照组。
Figures followed by different letters in each column are significantly different (< 0.05). T1 to T5 indicate different treatments of Ca2+concentration (0, 2 , 4 , 6, and 8 mmol L–1) under UV-B stress. T0 indicates untreated blank control groups.
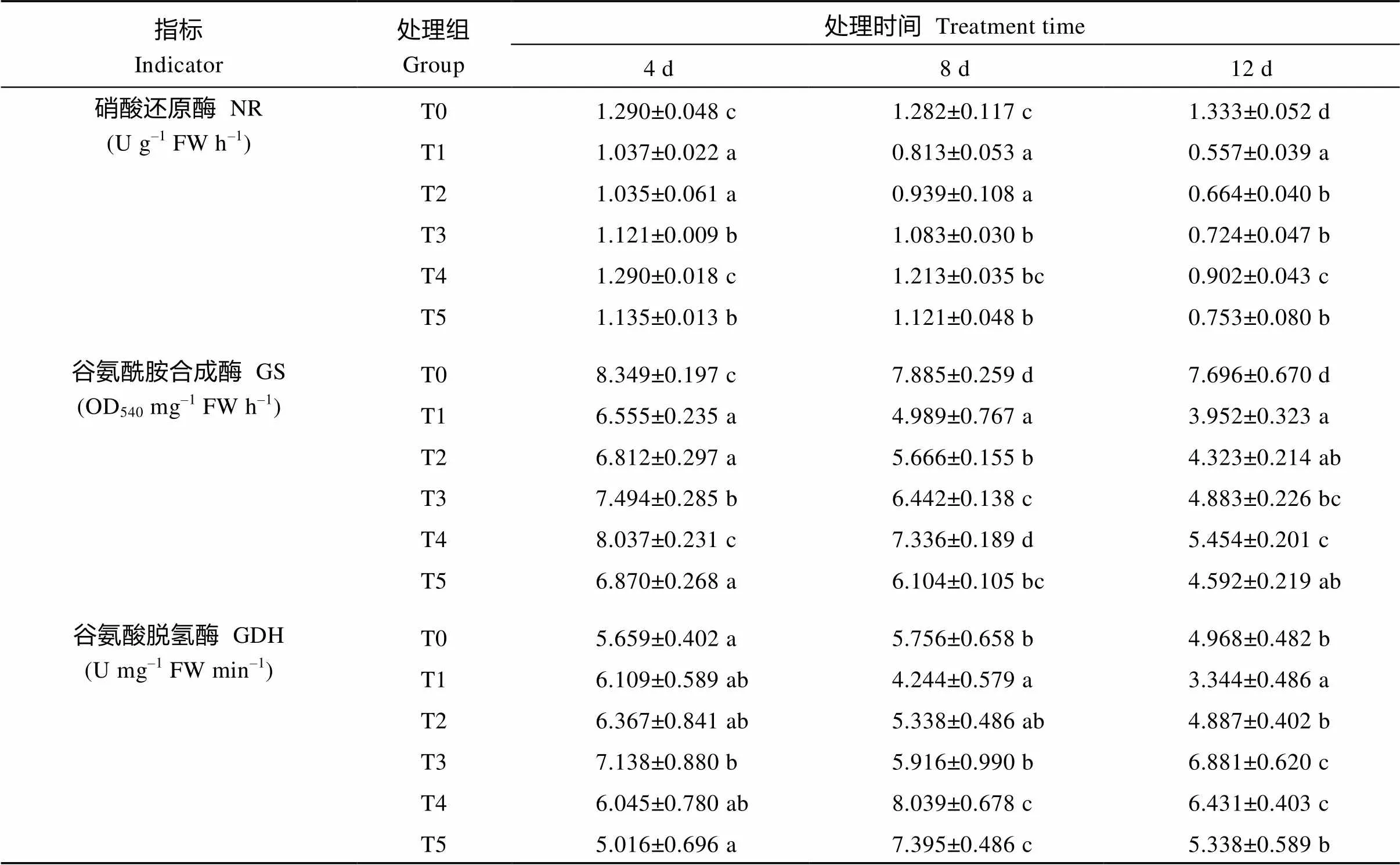
表4 UV-B胁迫下不同浓度Ca2+对颠茄硝酸还原酶、谷氨酰胺合成酶和谷氨酸脱氢酶活性的影响
表中同一列数据上标以不同小写字母表示差异显著(< 0.05)。T1至T5分别代表UV-B胁迫下不同浓度Ca2+处理组, 分别为0、2、4、6和8 mmol L–1。T0表示未进行任何处理, 即空白对照组。
Figures followed by different letters in each column are significantly different (< 0.05). T1 to T5 indicate different treatments of Ca2+concentration (0, 2, 4, 6, and 8 mmol L–1) under UV-B stress. T0 indicates untreated blank control groups.
2.5 UV-B胁迫下不同浓度Ca2+对颠茄叶片中托品烷类生物碱含量的影响
莨菪碱和东莨菪碱是托品烷类生物碱最主要的两种生物碱, 也是药用价值最高的两种成分。由表5可知, 在UV-B辐射处理第8天和第12天时, 颠茄叶片中莨菪碱和东莨菪碱含量相比T0对照组均显著降低, T1处理组中, 随着UV-B处理时间的增加, 莨菪碱的含量先升高后降低, 东莨菪碱含量则是持续降低, 表明短期UV-B辐射可以促进莨菪碱的积累,但中长期辐射不利于托品烷类生物碱的积累。外施不同浓度Ca2+处理后, 在相同处理时间下, 莨菪碱与东莨菪碱的含量均比T1组有所提高, 随着Ca2+浓度的升高呈先升后降的趋势。处理12 d时, T4组的莨菪碱与东莨菪碱含量较T1组显著提高, 分别提高了15.7%和31.9%。以上结果表明, 短期UV-B辐射可以促进莨菪碱的积累, 中长期辐射不利于托品烷类生物碱的积累, 总体而言, UV-B辐射不利于颠茄对莨菪碱与东莨菪碱的积累, 而适宜浓度的外源Ca2+可以有效缓解UV-B辐射对TAs积累的抑制。
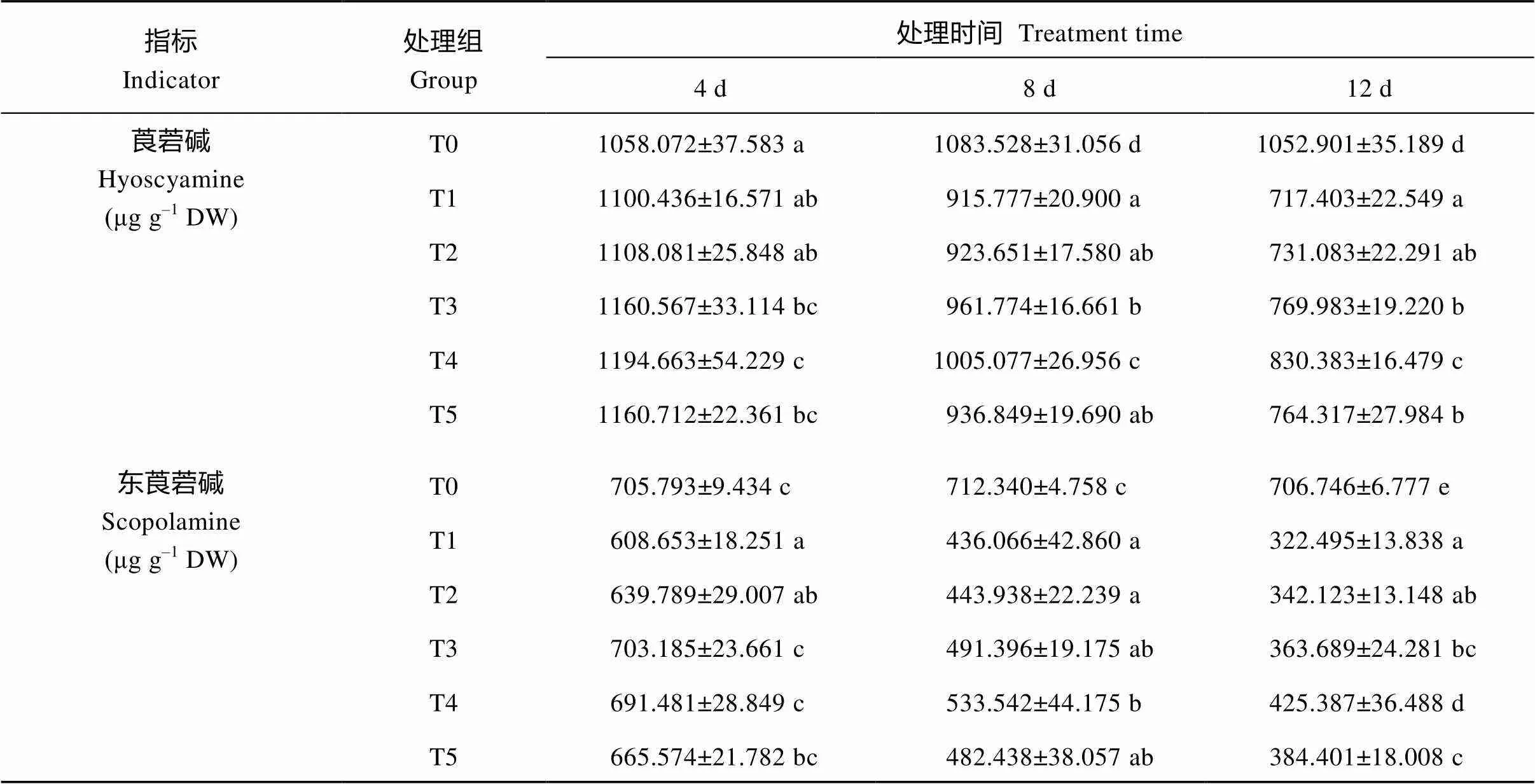
表5 UV-B胁迫下不同浓度Ca2+对颠茄叶片莨菪碱和东莨菪碱含量的影响
表中同一列数据上标以不同小写字母表示差异显著(< 0.05)。T1至T5分别代表UV-B胁迫下不同浓度Ca2+处理组, 分别为0、2、4、6和8 mmol L–1。T0表示未进行任何处理, 即空白对照组。
Figures followed by different letters in each column are significantly different (< 0.05). T1 to T5 indicate different treatments of Ca2+concentration (0, 2, 4, 6, and 8 mmol L–1) under UV-B stress. T0 indicates untreated blank control groups.
2.6 UV-B胁迫下不同浓度Ca2+对颠茄根、叶中PMT、TR I、H6H相对表达量的影响
腐胺N-甲基转移酶(putrescine N-methyltransferase, PMT)、托品酮还原酶Ι (tropinone reductase Ι, TR Ι)、莨菪碱-6-β-羟化酶(hyoscyamine-6-β-hydroxylase, H6H)是托品烷类生物碱合成途径中的3个关键酶, 其相应编码基因的表达量直接决定合成途径的中间产物流向以及生物碱的产量[36]。以为内参基因, 采用qRT-PCR检测了UV-B胁迫下处理12 d中T0组、T1组和T4组的颠茄根、叶中、和基因相对表达量。和在根中表达量较高,的表达量相对较低, 由T1组和T0组相比可知, 在UV-B处理12 d后,和的表达量均显著降低, 而则有所升高, 但不显著; 由T4组和T1组对比可知, 同样在UV-B处理下, 经6 mmol L–1外源Ca2+处理后, 显著促进了、和的表达(图4-A)。在叶中几乎不表达, 而明显表达, 且表达水平较高; 在UV-B处理12 d后,的表达量较T0组有所升高但不显著, 经6 mmol L–1外源Ca2+处理后, 显著促进了的表达(图4-B)。

图4 UV-B胁迫下不同浓度Ca2+对颠茄根(A)、叶(B)中PMT、H6H、TR I相对基因表达量的影响
标以不同小写字母的柱值在同一个基因不同处理组间差异显著(< 0.05)。T0组表示未进行任何处理的空白对照, T1组表示UV-B辐射处理12 d, T4组表示UV-B辐射背景下外施6 mmol L–1Ca2+处理12 d。
Bars superscripted by different letters are significantly different among different treatments in the same gene at the 0.05 probability level. T0 group indicates untreated blank control groups; T1 group indicates UV-B radiation treatment for 12 days; T4 group indicates exogenous 6 mmol L–1Ca2+treatment for 12 days under UV-B stress.
3 讨论
光合作用的强弱对植物的生长、产量以及抗逆性都具有十分重要的影响[37], 植物光合作用受到伤害的最初部位是与PS II紧密联系的, 而逆境胁迫往往会导致叶绿体光合机构的破坏, 降低PS II原初光能转换效率、抑制PS II潜在活性, 导致PS II功能下降[38]。本试验结果显示, UV-B辐射下, 相比T0对照组,o显著升高,vm显著降低, 且随着UV-B辐射时间的延长, 初始荧光o逐渐增大, 最大光化学效率vm逐渐减小, 而在适宜浓度外源Ca2+处理下, 相比T1组,o显著降低,vm明显增大。表明颠茄在UV-B辐射条件下, 叶片中PS II反应中心受到伤害, 导致其原初能量转换发生紊乱, 其叶绿素分子在吸收光能后, 激发态分子多以发出荧光的形式释放能量, 而参与到光合作用的能量有所减少, 不利于光合作用的进行。在此基础上, Ca2+可以有效地抵御UV-B对PS II反应中心的伤害, 缓解了叶片产生的光抑制, 可提高PS II的光能转换效率, 使颠茄在UV-B胁迫下依然保持较高的光化学效率。这与秦舒浩等[39]提出的外源Ca2+有利于缓解高温强光对西葫芦幼苗叶片的光抑制和温光破坏现象, 有效保护光合机构的观点相一致。对光合作用而言, 叶绿素与类胡萝卜素是参与光能吸收、传递和转化的重要色素, 因此叶绿素含量会直接影响植物的生长。叶绿素含量的高低直接影响着光合速率和光合产物的形成, 类胡萝卜素除吸收传递光能外, 还可起保护作用[40]。试验结果显示, UV-B胁迫下, 颠茄叶片中总叶绿素与类胡萝卜素含量都显著下降, 经不同浓度Ca2+处理下其含量有所上升。表明UV-B辐射加速了叶绿素和类胡萝卜素的分解, 不利于颠茄进行正常的光合作用。而适当浓度的外源Ca2+有助于缓解UV-B辐射对叶绿体膜的破坏, 维持较高的光合色素含量, 保护叶绿体膜结构的完整性。
抗氧化酶(SOD、POD、CAT)是植物体内保护酶系统的主要成员, 是防御活性氧及其他自由基对细胞膜系统伤害的最重要的酶[41]。MDA是膜脂过氧化作用的主要产物之一, 其量的高低是膜脂过氧化强弱和质膜破坏程度的重要指标[42]。本试验中, SOD和POD活性在UV-B胁迫下先升高后降低, CAT活性则是持续降低, 表明颠茄在UV-B照射初期可以通过自身调节SOD和POD活性的升高抵御逆境胁迫, 但随着UV-B照射时间的推移, SOD、POD和CAT的活性均有所降低, 表明长时间UV-B辐射加剧了颠茄细胞的氧化程度, 不利于正常的生理活动。在外源Ca2+处理下, 相比同期处理下的T1组, 3种抗氧化酶的活性呈现出显著升高趋势。同时, 在UV-B胁迫下, 相比T0对照组, 膜脂过氧化主要产物MDA含量大幅上升, Ca2+处理后相比同期处理的T1组显著降低, 且当Ca2+浓度为6 mmol L–1时最为显著。以上结果表明, UV-B辐射会导致颠茄细胞膜脂过氧化程度增强, 膜透性增加, 加剧了氧化损伤; SOD、POD和CAT活性的显著降低, 打破了在其共同作用下维持细胞内活性氧的代谢平衡, 无法及时清除体内的超氧自由基和H2O2等有害物质。而外源Ca2+则有助于刺激颠茄细胞产生更多的抗氧化酶或者提高抗氧化酶的活性, 从而降低活性氧水平, 抑制膜脂过氧化, 有利于提高颠茄在逆境条件下的抗性。这与邢建永等[43]提出的Ca2+能够提高半夏类原球茎的抗氧化性, 提高其抗逆性的观点相一致。
植物的次生代谢是以初生代谢为基础, 初生代谢中氮代谢尤为重要。硝态氮是可被植物根系直接吸收的无机氮源, 经氮代谢途径中相关酶的催化作用合成植物自身需要的含氮有机物, 如氨基酸和蛋白质等。本试验结果表明, 在UV-B胁迫下, 随着处理时间的延长, 颠茄叶片组织内的硝态氮含量逐渐增加, 游离氨基酸与可溶性蛋白含量逐渐降低。在外源Ca2+处理下, 游离氨基酸和可溶性蛋白含量显著提高, 有效缓解了UV-B辐射对含氮有机物合成的抑制, 适宜浓度的Ca2+有助于提高UV-B胁迫下氮代谢关键酶的活性, 加速颠茄对硝态氮的同化, 从而提高自身含氮有机物的积累, 尤其是促进氨基酸的合成与转化。这与高彦博[12]提出的外源Ca2+可以有效提高唐古特白刺氮代谢中关键酶的活性促进对硝态氮的利用的观点相一致。同时, 通过促进氮代谢的进程, 有利于鸟氨酸和精氨酸的合成, 从而有利于生物碱的前体物质腐胺的积累。
莨菪碱和东莨菪碱是颠茄次生代谢的产物, 主要在根中合成, 存贮积累在地上部分的幼嫩组织中[28]。钙盐对半夏类原球茎总生物碱的合成具有显著影响,适宜浓度的Ca2+提高半夏类原球茎有用次生代谢产物的量[19,43]。UV-B辐射可以诱导生物碱含量的增加, 温泉等[44]研究发现随着UV-B辐射时间的增加, 黄连中小檗碱含量逐渐增加。本试验结果显示, 在UV-B辐射处理下, 随着辐射时间的增加, 颠茄叶片中东莨菪碱含量逐渐降低, 莨菪碱含量则是先增后降, 不利于总生物碱的积累。随着Ca2+浓度的增加, 相同处理时间下莨菪碱与东莨菪碱的含量先增后降,当Ca2+浓度为4 mmol L–1和6 mmol L–1时效果较为显著。以为内参基因, 经qRT-PCR检测发现,和在根中均有表达, 在叶片中只有表达,和几乎不表达。这与强玮等[28-29]提出的、、均只在颠茄根中大量表达,在成熟叶片中强烈表达, 其次在花苞和根中少量表达的观点相似。除此之外, 结果显示, UV-B辐射抑制了和的表达水平, 却可以促进的表达, 但不显著; 而外源Ca2+可以有效激活和的表达, 有助于缓解UV-B辐射对和表达的抑制作用。表明Ca2+通过激活的高效表达, 促进腐胺从多胺代谢转向TAs合成,的高表达有利于托品酮生成托品的支流方向, 进而提高莨菪碱和东莨菪碱的产量。
4 结论
UV-B辐射不利于颠茄的正常生长与次生代谢物的积累, 外源Ca2+可有效缓解UV-B辐射对颠茄的胁迫效应, 有利于颠茄光合作用, 促进无机氮源的同化, 加速无机氮源转化为自身所需的含氮化合物, 进而有利于颠茄次生代谢途径中前体物质合成。虽然UV-B辐射可促进基因的表达, 但不利于和基因的正常表达, 降低了莨菪碱和东莨菪碱的合成效率, 而适宜浓度的外源Ca2+可有效解除UV-B对颠茄次生代谢的抑制效应。
[1] Chinese Pharmacopoeia Commission. Chinese Pharmacopoeia. Beijing: China Medical Science and Technology Press, 2010. pp 262–264
[2] Liu Y, Zhang J T, Yang J H. Comparative study on the pharmacological effects of some scopolia alkaloid derivatives., 1987, 22: 725–729
[3] Facchini P J. ALKALOID BIOSYNTHESIS IN PLANTS: biochemistry, cell biology, molecular regulation, and metabolic engineering applications., 2001, 52: 29–66
[4] 徐佳妮, 雷梦琦, 鲁瑞琪, 赵杨阳, 黄萱. UV-B辐射增强对植物影响的研究进展. 基因组学与应用生物学, 2015, 34: 1347–1352 Xu J N, Lei M Q, Lu R Q, Zhao Y Y, Huang X. Research progress on the effect of enhanced UV-B radiation on plants., 2015, 34: 1347–1352 (in Chinese with English abstract)
[5] 卢克欢, 苏贝贝, 郭双, 张翠平, 韦悦, 吴能表. UV-B辐射对颠茄氮代谢及次生代谢产物含量的影响. 中国生物化学与分子生物学报, 2017, 33: 1062–1069 Lu K H, Su B B, Guo S, Zhang C P, Wei Y, Wu N B. Effects of UV-B on the activities of nitrogen metabolism and secondary metabolites of., 2017, 33: 1062–1069 (in Chinese with English abstract)
[6] Bush D S. Calcium regulation in plant cells and its role in signaling., 1995, 46: 95–112
[7] 余叔文, 汤章城. 植物生理与分子生物学(第2版). 北京: 科学出版社, 1998. pp 123–133 Yu S W, Tang Z C. Plant Physiology and Molecular Biology, 2nd edn. Beijing: Science Press, 1998. pp 123–133 (in Chinese)
[8] Braam J, Davis R W. Rain-, wind-, and touch-induced expression of calmodulin and calmodulin-related genes in., 1990, 60: 357–364
[9] 梁颖, 王三根. Ca2+对低温下水稻幼苗膜的保护作用. 作物学报, 2001, 27: 59–64 Liang Y, Wang S G. The protective function of Ca2+on the membrane of rice seeding under low temperature stress., 2001, 27: 59–64 (in Chinese with English abstract)
[10] 王立安, 王源超, 李昌文, 郑小波. Ca2+信号途径参与稻瘟病菌分生孢子萌发及附着胞形成的调控. 菌物系统, 2003, 22: 457–465 Wang L A, Wang Y C, Li C W, Zheng X B. Ca2+signaling pathway involved inconidium germination and appressorium formation., 2003, 22: 457–465 (in Chinese with English abstract)
[11] Pandey G K, Cheong Y H, Kim K N, Grant J J, Li L G, Hung W, D’Angelo C. The calcium sensor calcineurin B-like 9 modulates abscisic acid sensitivity and biosynthesis in., 2004, 16: 1912–1924
[12] 高彦博. 外源Ca2+对盐胁迫下唐古特白刺光合作用及氮代谢的影响. 东北农业大学硕士学位论文, 黑龙江哈尔滨, 2016 Gao Y B. Effects of Exogenous Ca2+on Photosynthesis and Nitrogen Metabolism ofBobr. under Salt Stress. MS Thesis of Northeast Agricultural University, Harbin, Heilongjiang, China, 2016 (in Chinese with English abstract)
[13] 陈露露, 王秀峰, 刘美, 杨凤娟, 史庆华, 魏珉, 李清明. 外源钙对干旱胁迫下黄瓜幼苗叶片膜脂过氧化和光合特性的影响. 山东农业科学, 2016, 48(4): 28–33 Chen L L, Wang X F, Liu M, Yang F J, Shi Q H, Wei M, Li Q M. Effects of exogenous CaCl2on membrane lipid peroxidation and photo-synthetic characteristics of cucumber seedling leaves under drought stress., 2016, 48(4): 28–33 (in Chinese with English abstract)
[14] 赵娟, 王芳, 李永生, 姚海梅, 张同祯, 方永丰, 王汉宁. 钙对低温胁迫下玉米种子萌发及幼苗生长的影响. 甘肃农业大学学报, 2016, 51(6): 30–35 Zhao J, Wang F, Li Y S, Yao H M, Zhang T Z, Fang Y F, Wang H N. Effects of calcium on maize seed germination and seeding growth under low temperature stress., 2016, 51(6): 30–35 (in Chinese with English abstract)
[15] Nakao M, Ono K, Takio S. The effect of calcium on flavanol production in cell suspension cultures of Polygonum hydropiper., 1999, 18: 759–763
[16] Piñol M T, Palazón J, Cusidó R M, Ribó M. Influence of calcium ion-concentration in the medium on tropane alkaloid accumulation inhairy roots., 1999, 141: 41–49
[17] Yue C J, Zhong J J. Impact of external calcium and calcium sensors on ginsenoside Rb1 biosynthesis bycells., 2005, 89: 444–452
[18] Bramble J L, Graves D J, Brodelius P. Calcium and phosphate effects on growth and alkaloid production in: experimental results and mathematical model., 1991, 37: 859–868
[19] 杨卫星, 黑刚刚, 李姣姣, 张红敏, 李琳琳, 吴能表. 外源Ca2+对高温胁迫下半夏光合参数及有效成分积累的影响. 中国中药杂志, 2014, 39: 2614–2618 Yang W X, Hei G G, Li J J, Zhang H M, Li L L, Wu N B. Effects of Ca2+on photosynthetic parameters ofand accumulations of active components in heat stress., 2014, 39: 2614–2618 (in Chinese with English abstract)
[20] 张宪政. 植物叶绿素含量测定: 丙酮乙醇混合液法. 辽宁农业科学, 1986, (3): 26–28 Zhang X Z. Determination of chlorophyll content in plants: acetone ethanol mixture method., 1986, (3): 26–28 (in Chinese without English abstract)
[21] Velikova V, Yordanov I, Edreva A. Oxidative stress and some antioxidant systems in acid rain 2-treated bean plants protective role of exogenous polyamines., 2000, 151: 59–66
[22] Giannopolitis C N, Ries S K. Superoxide dismutases: I. Occurrence in higher plants., 1977, 59: 309–314
[23] Omran R G. Peroxide levels and the activities of catalase, peroxidase, and indoleacetic acid oxidase during and after chilling cucumber seedlings., 1980, 65: 407–408
[24] 高俊凤. 植物生理学实验指导. 北京: 高等教育出版社, 2006. pp 214–215 Gao J F. Experimental Guidance of Plant Physiology. Beijing: Higher Education Press, 2006. pp 214–215 (in Chinese)
[25] 李合生. 植物生理生化实验原理和技术. 北京: 高等教育出版社, 2000. pp 192–194 Li H S. Principles and Techniques of Plant Physiological and Biochemical Experiments. Beijing: Higher Education Press, 2000. pp 192–194 (in Chinese)
[26] 汤绍虎, 罗充. 植物生理学实验教程. 重庆: 西南师范大学出版社, 2013. pp 57–58 Tang S H, Luo C. Experimental Course of Plant Physiology. Chongqing: Southwestern Normal University Press, 2013. pp 57–58 (in Chinese)
[27] Zárate R, Hermosin B, Cantos M, Troncoso A. Tropane alkaloid distribution inplants., 1997, 23 : 2059–2066
[28] 强玮, 王亚雄, 张巧卓, 李金弟, 夏科, 吴能表, 廖志华. 颠茄托品烷生物碱合成途径基因表达分析与生物碱积累研究. 中国中药杂志, 2014, 39: 52–58 Qiang W, Wang Y X, Zhang Q Z, Li J D, Xia K, Wu N B, Liao Z H. Expression pattern of genes involved in tropane alkaloids biosynthesis and tropane alkaloids accumulation in., 2014, 39: 52–58 (in Chinese with English abstract)
[29] 强玮. 颠茄基因的克隆、功能验证及超量表达对颠茄托品烷生物碱合成的影响. 西南大学硕士学位论文, 重庆, 2012 Qiang W. Cloning and Characterization of Tropinone Reductase I fromand Its Overexpression for Enhancing the Tropane Alkaloids Production in. MS Thesis of Southwest University, Chongqing, China, 2012 (in Chinese with English abstract)
[30] 张守仁. 叶绿素荧光动力学参数的意义及讨论. 植物学通报, 1999, 16: 444–448 Zhang S R. A discussion on chlorophyll fluorescence kinetics parameters and their significance., 1999, 16: 444–448 (in Chinese without English abstract)
[31] 马伏英. 黄连等中药抗实验性小鼠柯萨奇B3病毒性心肌炎的实验研究. 武警医学, 1998, 9(4): 187–190 Ma F Y. Experimental study ofFranch etc. against coxsackievirus B3myocarditis of rats., 1998, 9(4): 187–190 (in Chinese with English abstract)
[32] Xu C, Li D, Zou Q, Zhang J. Effect of drought on chlorophyll fluorescence and xanthophyll cycle components in winter wheat leaves with different ages., 1999, 25: 29–37
[33] 尹永强, 胡建斌, 邓明军. 植物叶片抗氧化系统及其对逆境胁迫的响应研究进展. 中国农学通报, 2007, 23(1): 105–110 Yin Y Q, Hu J B, Deng M J. Latest development of antiosidant system and responses to stress in plant leaves., 2007, 23(1): 105–110 (in Chinese with English abstract)
[34] 郝敬虹, 易旸, 尚庆茂, 董春娟, 张志刚. 水杨酸处理对干旱胁迫下黄瓜幼苗氮素同化及其关键酶活性的影响. 园艺学报, 2012, 39: 81–90 Hao J H, Yi Y, Shang Q M, Dong C J, Zhang Z G. Effect of exogenous salicylic acid on nitrogen assimilation of cucumber seedling under drought stress., 2012, 39: 81–90 (in Chinese with English abstract)
[35] 宋子健, 李良霞, 李建龙, 张强. 高温胁迫对高羊茅草坪草氮代谢的影响. 贵州农业科学, 2007, 35(6): 15–19 Song Z J, Li L X, Li J L, Zhang Q. The effect of high temperature stress on nitrogen metabolism of tall fescue turfgrass., 2007, 35(6): 15–19 (in Chinese with English abstract)
[36] Zhang L, Ding R X, Chai Y R, Bonfill M, Moyano E, Oksman-Caldentey K M, Xu T F, Pi Y, Wang Z N, Zhang H M, Kai G Y, Liao Z H, Sun X F, Tang K X. Engineering tropane biosynthetic pathway inhairy root cultures.,2004, 101: 6786–6791
[37] 张春平, 周慧, 何平, 胡世俊, 段静雨, 李岩, 么焕开. 外源5-氨基乙酰丙酸对盐胁迫下黄连幼苗光合参数及其叶绿素荧光特性的影响. 西北植物学报, 2014, 34: 2515–2524Zhang C P, Zhou H, He P, Hu S J, Duan J Y, Li Y, Yao H K. Effect of exogenous 5-aminolevulinic acid on photosynthesis and chlorophyll fluorescence characteristics ofFranch. seedlings under NaCl stress., 2014, 34: 2515–2524 (in Chinese with English abstract)
[38] Lu C M, Zhang J H. Effects of water stress on photosystem II photochemistry and its thermostability in wheat plants., 1999, 50: 1199–1206
[39] 秦舒浩, 李玲玲, 陈娜娜. 外源Ca2+对高温强光下西葫芦幼苗形态特征、光合特性及荧光参数的影响. 应用生态学报, 2010, 21: 2830–2835 Qin S H, Li L L, Chen N N, Effects of exogenous Ca2+on morphological and photosynthetic characteristics and chlorophyll fluorescent parameters of squash seedlings under high temperature and strong light stress., 2010, 21: 2830–2835 (in Chinese with English abstract)
[40] 白志英, 李存东, 孙红春, 吴同燕. 干旱胁迫对小麦叶片叶绿素和类胡萝卜素含量的影响及染色体调控. 华北农学报, 2009, 24(1): 1–6 Bai Z Y, Li C D, Sun H C, Wu T Y. The effect and chromosomal control on chlorophyll content and corticoid content under drought stress in wheat (L.)., 2009, 24(1): 1–6 (in Chinese with English abstract)
[41] 罗广华, 王爱国, 邵从本, 郭俊彦. 超氧物歧化酶(SOD)在大豆下胚轴线粒体内的定位. 植物学报, 1987, 29: 171–177 Luo G H, Wang A G, Shao C B, Guo J Y. The intramitochondrial localization of superoside dismutase from hypocotyl of etiolated soybean seedlings., 1987, 29: 171–177 (in Chinese with English abstract)
[42] 韩蕊莲, 李丽霞, 梁宗锁, 薛智德, 杜正科. 干旱胁迫下沙棘膜脂过氧化保护体系研究. 西北林学院学报, 2002, 17(4): 1–5 Han R L, Li L X, Liang Z S, Xue Z D, Du Z K. Seabuck thorn membrane-lipid peroxidation system under drought stress., 2002, 17(4): 1–5 (in Chinese with English abstract)
[43] 邢建永, 王康才, 汤兴利, 刘海琴. Ca2+对悬浮培养半夏类原球茎生长及次生代谢物累积的影响. 中草药, 2011, 42: 376–379 Xing J Y, Wang K C, Tang X L, Liu H Q. Effect of Ca2+on growth in protocorm-like bodies ofand accumulation of secondary metabolites during suspension culture., 2011, 42: 376–379 (in Chinese with English abstract)
[44] 温泉, 张楠, 曹瑞霞, 周心渝, 唐娟, 吴能表. 增强UV-B对黄连代谢及小檗碱含量的影响. 中国中药杂志, 2011, 36: 3063–3069 Wen Q, Zhang N, Cao R X, Zhou X Y, Tang J, Wu N B. Effect of enhanced UV-B radiation on metabolism and berberine content of., 2011, 36: 3063–3069 (in Chinese with English abstract)
Effect of Exogenous Ca2+on Physiological Characteristics and Secondary Metabolites accumulation ofL. Seedlings under UV-B Stress
LU Ke-Huan1, LIU Xing1, YANG Yi1, LIAO Zhi-Hua2,and WU Neng-Biao1,*
1Key Laboratory of Eco-environments in Three Gorges Reservoir Region, Ministry of Education / School of Life Science, Southwest University, Chongqing 400715, China;2School of Life Science, Southwest University, Chongqing 400715, China
Ultraviolet B (UV-B) radiation does harm to plant, for which growth and development. Ca2+is one of the most necessary elements. Exogenous Ca2+can enhance plant abilities to resist stress and regulate secondary metabolism. In this research, we usedL. seedlings to investigate the effects of different concentrations of exogenous Ca2+and different treatment days on the physiological characteristics, nitrogen metabolism, secondary metabolites content and relative genes expression levels of three key enzymes in secondary metabolism under the background of UV-B radiation. The UV-B radiation not only caused inhibitory effect on theL. photosynthesis, nitrogen metabolism, alkaloid content, but also increased peroxidation of membrane lipid. Theo, MDA content gradually decreased, but thevm, photosynthetic pigment content, antioxidant enzyme activity gradually increased under Ca2+treatment, showing that Ca2+is propitious to relieve inhibitory effect on photosynthesis and enhance resistance to UV-B stress. Moreover, Ca2+reduced the content of nitrate nitrogen significantly, promoted the contents of free amino acids, soluble proteins, atropine alkaloids, and raised the activities of key enzymes in nitrogen metabolism. Using real-time fluorescence quantitative PCR, we found that exogenous Ca2+increased the relative gene expression levels of three key enzymes in secondary metabolism in different degrees. This research could provide a theoretical references for plantation in the field.
UV-B stress;L.; physiological characteristics; nitrogen metabolism; tropane alkaloids
2018-01-15;
2018-07-20;
2018-08-01.
10.3724/SP.J.1006.2018.01527
吴能表, E-mail: wunb@swu.edu.cn, Tel: 023-68252147
E-mail: lukehuan@163.com
本研究由国家自然科学基金项目(30500041)和重庆市科技攻关计划项目(cstc2012gg-yyjs80013)资助。
This study was supported by the National Natural Science Foundation of China (30500041) and the Science Technology Breakthrough Plan Project of Chongqing (cstc2012gg-yyjs80013).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180731.1057.002.html
