免疫抑制BALB/c小鼠系统性白假丝酵母菌感染生物指标模型的建立
2018-10-10李继红邓洁华赵宜乐王刚生
李继红, 邓洁华, 赵宜乐, 王刚生
(河北医科大学第二医院, 河北 石家庄 050000)
近年来,系统性假丝酵母菌感染发病率呈升高趋势,多数由白假丝酵母菌(Candidaalbicans)引起,其病死率高达40%以上,故引起临床广泛关注[1]。目前对系统性白假丝酵母菌感染的发病机制研究尚不清楚,药物治疗远远达不到临床需求;通过建立系统性白假丝酵母菌感染的动物模型,不但能从整体上探讨白假丝酵母菌感染的致病机制,且对研究新型抗真菌药物的体内药效具有重要的意义[2]。动物模型具有体外实验不可比拟的优势,可在整体上模拟病源与宿主间的复杂关系[3]。故本实验采用BALB/c小鼠腹腔注射环磷酰胺造成小鼠免疫抑制后,再经腹腔注射白假丝酵母菌建立系统性白假丝酵母菌感染的生物指标模型。现将结果报告如下。
1 材料与方法
1.1 实验材料
1.1.1 菌株与动物 白假丝酵母菌(ATCC 90028)由中国科学院微生物研究所提供,经动物实验提取致病菌株;菌株采用Vitek2 YST(由法国生物梅里埃公司提供)进行鉴定。雄性BALB/c小鼠6~8 W,体重22~25 g,SPF级,由北京维通利华实验动物技术有限公司提供,实验动物生产许可证编号为SCXK(京)2012-0001。
1.1.2 药物与试剂 环磷酰胺由江苏恒瑞药业有限公司提供,(1, 3)-β-D-葡聚糖试剂盒由湛江安度斯生物有限公司提供,LKM型动态试管检测仪由Lad Kinetics Ltd公司提供。BECKMAN COULTER HMX全自动五分类血细胞分析仪由美国Beckman Coulter公司提供。
1.1.3 实验地点 动物实验地点为河北医科大学第二医院动物实验中心,饲养条件为IVR层流柜、温度22 ℃、湿度50%~70%。本研究经河北医科大学第二医院伦理委员会审批。
1.2 实验方法
1.2.1 建立免疫抑制小鼠模型的方法 40只BALB/c小鼠随机分为免疫抑制组(30只)和免疫抑制对照组(10只)。免疫抑制组小鼠经腹腔注射环磷酰胺(200 mg/kg·d),连续2 d;在用药前1 d及用药后第2、4、6、8天,取小鼠尾静脉血,采用BECKMAN COULTER HMX全自动五分类血细胞分析仪进行白细胞和中性粒细胞计数,同时观察小鼠生活状态。免疫抑制对照组小鼠经腹腔注射0.9%生理盐水0.25 mL,1次/d,连续2 d。
1.2.2 建立白假丝酵母菌感染模型的方法 60只BALB/c小鼠随机分为感染组(30只)和对照组(30只)。感染组小鼠经腹腔注射环磷酰胺(200 mg/kg·d,连续2 d),在用药第3天时,经腹腔注射白假丝酵母菌0.25 mL(浓度为1×107CFU/mL),分别对注射真菌后第2~14天死亡小鼠以及第14天存活小鼠(采取颈椎脱臼法处死)进行解剖,即刻取小鼠组织进行真菌镜检、培养和病理检查,同时对肺、肾组织进行(1, 3)-β-D-葡聚糖测定。对照组小鼠经腹腔注射环磷酰胺(200 mg/kg·d,连续2 d),在用药第3天时,经腹腔注射0.9%生理盐水0.25 mL。
1.2.3 菌悬液制备 将白假丝酵母菌(ATCC 90028)制备成1×107CFU/mL菌悬液,以0.25 mL注射到免疫抑制组用药第3天的BALB/c小鼠腹腔内,于注射真菌菌悬液后第7天取肾组织置于葡萄糖蛋白胨培养基内,37℃孵育箱培育5 d,经Vitek 2 YST鉴定为白假丝酵母菌,然后再将此白假丝酵母菌制备成菌悬液,重复上述方法3次后,最后获取的白假丝酵母菌为增强毒力菌株,将增强毒力菌株用0.1%吐温80生理盐水制备成浓度为1×107CFU/mL的菌悬液备用。将菌悬液用0.1%吐温80生理盐水稀释10倍,取100 μL接种于葡萄糖蛋白胨培养基内,37 ℃培养2 d,计算白假丝酵母菌菌株的存活率[4-5]。
1.2.4 (1, 3)-β-D葡聚糖检测方法 采用速率比浊法检测(1, 3)-β-D葡聚糖:(1)取小鼠肺、肝组织匀浆500 mg,以400 g离心10 min;(2)取上清100 μL,加入样品稀释瓶中,在旋涡混合器上轻轻混匀,然后插入75 ℃试管恒温仪中加热10 min;(3)取0.25 mL试剂复溶液加入(1, 3)-β-D葡聚糖检测试剂中;(4)取本试剂盒所配的专用反应试管,先取已制备好的样品供试溶液100 μL加入反应试管中,然后再加入50 μL(1, 3)-β-D葡聚糖检测试剂溶液,每个样品供试溶液平行两管;(5)加样完毕,依次拿起试管在旋涡混合器上轻点一下,使试管中的溶液混合均匀,然后把各试管逐一插到LKM型动态试管检测仪中,反应开始,37℃反应75 min,读取结果。
1.3 统计方法 应用SPSS 21.0软件进行统计学分析。计量资料采用均数±标准差表示,计数资料比较采用卡方检验,组间比较采用两独立样本t检验。以P≤0.05为差异具有统计学意义。
2 结果
2.1 免疫抑制小鼠模型建立情况 免疫抑制组小鼠在用药后第4天白细胞计数和中性粒细胞计数均下降至最低值,低于其对照组,两组白细胞和中性粒细胞计数比较,差异均有统计学意义(均P<0.05);免疫抑制组小鼠在用药后第4天平均体重为(18.00±2.05)g,同期其对照组平均体重为(25.00±2.06)g,两组体重比较,差异有统计学意义(t=-8.557,P<0.01)。免疫抑制组小鼠均出现饮水和饮食明显减少、喜静、少动、消瘦、毛发稀疏等现象,用药后第8天白细胞计数、中性粒细胞计数及生活状态逐渐恢复正常,观察28 d无小鼠自然死亡现象。见表1。

表1 环磷酰胺对小鼠白细胞和中性粒细胞影响的实验室检测结果(×109/L)
2.2 白假丝酵母菌感染模型建立情况
2.2.1 生存率 白假丝酵母菌感染组小鼠于注射白假丝酵母菌第2天后开始出现死亡,于第8天死亡率达70.00%(21/30)。白假丝酵母菌感染组生存率为30.00%,对照组生存率为100.00%,两组生存率比较,差异有统计学意义(χ2=32.308,P<0.05)。见表2。

表2 白假丝酵母菌感染组与对照组小鼠注射真菌后不同时间死亡情况(只)
2.2.2 组织镜检与培养结果 对注射真菌后第2~14天死亡小鼠以及第14天存活小鼠进行解剖,发现肺、肝、肾组织出现多处脓肿,肉眼可见肾组织≥10处的脓肿坏死灶,其余组织脓肿及坏死灶均<10处,见图1。取小鼠组织直接镜检发现肾、肺、肝、肠组织均可见大量菌丝和芽生孢子,见图2。对小鼠组织进行真菌培养发现心、肺、肝、肾、肠、胸膜组织均有白假丝酵母菌生长,见图3。

A:肾;B:肺;C:肝

A:肾;B:肺;C:肝;D肠

图3 小鼠组织培养结果图
2.2.3 组织病理学结果 白假丝酵母菌感染组小鼠经PAS染色电镜下(10×40)可见肺、肝、肾、肠组织中均可见大量菌丝和芽生孢子、组织坏死及炎性细胞浸润。见图4。
2.2.4 肾、肺组织(1, 3)-β-D-葡聚糖检测结果 小鼠肺、肾组织行(1, 3)-β-D-葡聚糖检测结果显示,白假丝酵母菌感染组肺、肾组织(1, 3)-β-D-葡聚糖均增高,与对照组比较,差异均有统计学意义(均P<0.05)。见表3。
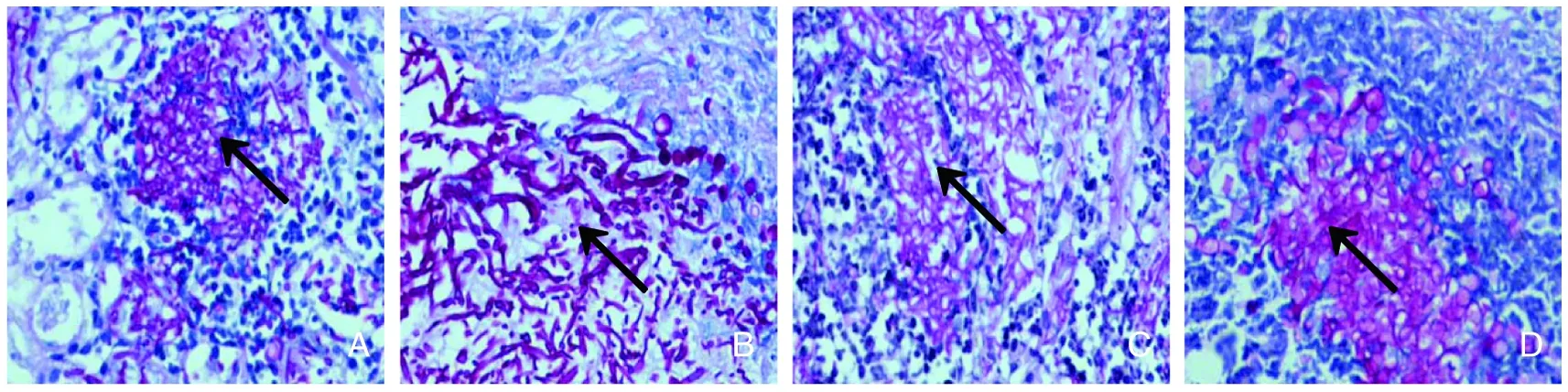
A:肾;B:肺;C:肝;D肠
表3白假丝酵母菌感染组与对照组肺、 肾组织(1, 3)-β-D-葡聚糖检测结果(pg/mL)
Table3Detection results of (1,3)-β-D-glucan in lung and kidney tissue ofC.albicansinfection group and control group (pg/mL)

组别肺组织肾组织感染组5 930.83±236.525 181.33±223.67对照组76.69±20.3475.62±18.34t70.35471.486P0.0000.000
3 讨论
系统性白假丝酵母菌感染是导致免疫力低下患者死亡的重要原因之一,其感染能力与菌株毒力、宿主免疫力密切相关[6],BALB/c小鼠是常用实验动物,是假丝酵母菌耐受鼠[7],国内外关于建立系统性假丝酵母菌感染动物模型方法的文献报道很多,以往研究多经尾静脉途径注射假丝酵母菌造成血流感染而建立系统性假丝酵母菌感染模型[8-9];Diez-Orejas等[10]用健康雄性BALB/c小鼠以及Calera等[11]用健康雄性昆明小鼠,均经尾静脉途径注射白假丝酵母菌建立系统性白假丝酵母菌感染的动物模型。本实验先通过对雄性BALB/c小鼠腹腔注射环磷酰胺后(200 mg/kg·d,连续2 d),于用药后第4天小鼠血白细胞和中性粒细胞均降至最低,观察28 d小鼠无死亡现象,说明此方法能有效诱导小鼠免疫抑制。然后在免疫抑制小鼠用药后第3天,经腹腔注射白假丝酵母菌增强毒力株0.25 mL(浓度为1×107CFU/mL),成功建立了免疫抑制BALB/c小鼠系统性白假丝酵母菌感染的动物模型,目前国内尚未见通过此方法造模的相关报道。经腹腔注射白假丝酵母菌造成小鼠腹腔器官浸润和肠系膜淋巴吸收进入血液而造成系统感染,这与腹部外科手术造成肠道假丝酵母菌种植腹腔而引起的系统性白假丝酵母菌感染相类似[12-13]。因此,该方法既避免了经小鼠尾静脉注射操作的难度,又模拟了腹部外科手术导致系统性白假丝酵母菌感染的菌株体内播散方式,有利于了解人类常见系统性白假丝酵母菌感染的途径及发病机制。此方法操作简单,成功率较高,适合系统性白假丝酵母菌感染模型的建立。
系统性假丝酵母菌感染具有器官特异性[14]。本研究显示,腹腔注射白假丝酵母菌建立的小鼠感染模型,各脏器感染以肾脏感染最为显著。腹腔注射白假丝酵母菌首先引起肾组织严重损伤,肉眼可见肾组织多处脓肿,组织真菌直接镜检可见大量菌丝体,组织病理可见大量菌丝体、炎细胞及组织坏死;此外肝、肺、心、肠、胸膜等,也是白假丝酵母菌感染的重要靶器官,组织病理均可见菌丝、芽生孢子及炎性细胞浸润。
(1, 3)-β-D-葡聚糖广泛存在于真菌细胞壁中,是真菌细胞壁重要组成部分,几乎所有真菌细胞壁都含有(1, 3)-β-D-葡聚糖,其中以酵母样菌含量最高,当真菌侵入人体血液或组织,经吞噬细胞吞噬消化后,(1, 3)-β-D-葡聚糖可以从胞壁中释放出来,在血液、组织、体液中含量增加,因此,(1, 3)-β-D-葡聚糖已成为检测真菌相关感染的一个有意义的生物指标[15]。目前临床上血清(1, 3)-β-D-葡聚糖的检测方法主要用于诊断曲霉菌、假丝酵母菌感染[16-17]。此实验研究显示,白假丝酵母菌感染组肺、肾组织(1, 3)-β-D-葡聚糖均增高,与对照组比较,差异均有统计学意义(P<0.05),说明(1, 3)-β-D-葡聚糖的检测方法,不但可诊断曲霉菌、假丝酵母菌感染,同样也适用于系统性白假丝酵母菌感染的靶向脏器组织的检测。故可以通过观察药物对脏器组织内真菌细胞壁(1, 3)-β-D-葡聚糖影响的药效及靶位脏器真菌感染的诊断。
总之,系统性白假丝酵母菌感染动物模型的建立,需要考虑被感染动物的易感性或抗性。首先选择合适的动物种类、免疫抑制动物模型的制备、感染菌株的致病性、菌悬液浓度、接种途径等;实验中依据真菌学(直接镜检、组织培养)、病理学、(1, 3)-β-D-葡聚糖测定的方法,制定各项定性生物指标,建立系统性白假丝酵母菌感染的生物指标动物模型。本实验通过对雄性BALB/c小鼠腹腔注射环磷酰胺后(200 mg/kg·d,连续2 d),能有效诱导小鼠免疫抑制;然后在用药后第3天,经腹腔注射白假丝酵母菌增强毒力株0.25 mL(浓度为1×107CFU/mL),可以成功建立免疫抑制BALB/c小鼠系统性白假丝酵母菌感染的动物模型。
