miR-519d在胰腺癌细胞中的表达及其作用
2018-10-10梁治坤程凡天胡走肖蔡常春
梁治坤,程凡天,胡走肖,蔡常春
(华中科技大学同济医学院附属武汉中心医院 肝胆胰外科,湖北 武汉 430014)
胰腺癌是种恶性程度极高的肿瘤,其发病隐匿。在确诊时多数患者已进入晚期,导致能接受手术的患者仅15%~20%,术后患者生存期仅9~11个月[1]。微小RNA(microRNA,miRNA)是一类长度在19~21 nt的短链非编码RNA,其通过靶向结合mRNA调控目的基因的表达[2]。研究[3]表明,miRNA异常表达与包括肿瘤在内的多种疾病密切关联。miR-519d可参与调控细胞周期、分化、衰老和凋亡等过程[4-6],其在多种肿瘤中被发现有抑癌作用,包括卵巢癌[7]、乳腺癌[8]、宫颈癌[9]、肺癌[10]和结肠癌[11]等。然而,鲜见文献报道miR-519d对胰腺癌的关系,本文研究miR-519d对胰腺癌增殖和凋亡的影响及可能的机制。
1 材料与方法
1.1 实验材料
实验所需的细胞系,包括人正常胰腺导管上皮细胞系及4种胰腺癌细胞系均由华中科技大学同济医学院基础医学部馈赠;实验所需的一抗,包括X连锁凋亡抑制蛋白(X-linked inhibitor of apoptosis protein,XIAP)及GAPDH一抗购自Santa cruz公司;羊抗兔二抗购自美国Cell signaling公司;RPMI1640细胞培养基购自北京友康恒业生物科技有限公司;Lipofectamine™ 3000 Transfection Reagent购自美国Thermo Fisher公司;阴性对照序列质粒pcDNA6.2-GW/miRNA随机序列和过表达序列质粒pcDNA6.2-GW/miR-519d模拟物由广州锐博生物技术有限公司合成。
1.2 实验方法
1.2.1 细胞分组 实验所需的细胞系均在37 ℃、5% CO2的条件,培养于RPMI1640细胞培养基,消化传代时间为48 h,对数生长期细胞为实验所采用的细胞。将Panc-1细胞系分成3组,miR-519d过表达组(miR-519d组)、阴性对照组及空白对照组,以每孔2×105个接种于6孔板上,miR-519d组及阴性对照组经LipofectamineTM3000分别转染过表达质粒pcDNA6.2-GW/miR-519d模拟物及阴性对照质粒pcDNA6.2-GW/miRNA随机序列,空白对照组作为空白对照。miR-519d模拟物正 义 链:5'-CAA AGU GCC UCC CUU UAG AGU G-3',反义链:5'-CUC UAA AGG GAG GCA CUU UGU U-3'。阴性对照随机序列正义链:5'-UUC UCC GAA CGU GUC ACG UTT-3',反义链:5'-ACG UGA CAC GUU CGG AGA ATT-3'。
1.2.2 qRT-PCR检测 提取细胞总miRNAs的试剂为提取纯化一体试剂盒(美国Zymoresearch公司),按说明书提取收集待测细胞系和miR-519d组、阴性对照组及空白对照组细胞的总miRNA,采用ABI实时荧光定量PCR仪器,以U6小核为内参,在 95 ℃ 预变性 30 s、95 ℃ 5 s、60 ℃ 20 s 共40个循环的反应条件下,测定miR-519d组、阴性对照组及空白对照组3组样品的循环阈值,采用2−ΔΔCt法定量,计算miR-519p的相对表达量。
1.2.3 细胞增殖能力检测 采用MTT法测定miR-519d组、阴性对照组及空白对照组3组细胞增殖能力,将miR-519d组、阴性对照组及空白对照组每孔按200 µL的体积上样,以2×103个/孔的标准种植,培养 0、24、48、72、96 h 后,将 20 µL MTT加至每个孔中,用DNM-9606酶标分析仪测定3组的吸光度,绘制细胞增殖曲线,纵坐标为吸光度,横坐标为时间。
1.2.4 细胞凋亡检测 将miR-519d组、阴性对照组及空白对照组细胞培养24 h后,用Annexin V/PI染色后,消化后,重悬混匀采用结合缓冲液,随后加入Annexin V抗体,PI染料于避光10 min后加入,采用流式细胞术测定细胞凋亡,计算细胞凋亡率,实验经3次重复,数据取3次的平均值。
1.2.5 细胞侵袭能力检测 将miR-519d 组、阴性对照组及空白对照组三组各以2×104个细胞接种于碳酸磷脂表面,行Transwell实验,在37 ℃条件下培养24 h,用1%多聚甲醛与膜下面的细胞结合,染色采用0.2%结晶紫溶液,在200倍视野下按随机法取10个视野,计算穿膜细胞数,重复3次实验,以3次的平均值为所得数据。
1.2.6 Western blot检测 将miR-519d组、阴性对照组及空白对照组细胞培养24 h后,裂解变性各组细胞,按常规条件行Western blot,条件为:浓缩胶 80 V 60 min,分离胶 100 V 90 min,一抗浓度为1:400,二抗浓度为1:800,经电子发光液显影后分析蛋白灰度值,实验经3次重复后,取均值。
1.3 统计学处理
采用统计软件用SPSS 20.0,计量资料以均数±标准差(±s)表示,两组数据比较采用t检验,P<0.05为差异有统计学意义。
2 结 果
2.1 miR-519d在正常胰腺导管上皮细胞系及胰腺癌细胞系中的表达
q R T-P C R结果显示,A s P C-1、B x P C-3、C a p a n-2及P a n c-1胰腺癌细胞系m i R-5 1 9 d表达量均低于正常胰腺导管上皮细胞系HPDE6-C7,分别为:0.22±0.02vs.1.0±0.04、0.38±0.03vs.1.0±0.04、0.58±0.05vs.1.0± 0.04、0.29±0.03vs.1.0± 0.04,差异均有统计学意义(均P<0.05)(图1)。
2.2 转染效率及细胞增殖检测结果
转染24 h后,miR-519d组miR-519d相对表达量明显高于空白对照组(11.73±0.51vs.1.00±0.08,P<0.001),而阴性对照组miR-519d相对表达量与空白对照组无统计学差异(P>0.05)(图2A)。MTT结果显示,在转染后0、24、48、72、96 h,miR-519d组与空白对照组的OD490nm值比较分别为0.14±0.02vs.0.11±0.03(t=1.224,P=0.288)、0.19±0.02vs.0.22± 0.02(t=-0.961,P=0.391)、0.29±0.03vs.0.39±0.04(t=-2.424,P=0.072)、0.38±0.04vs.0.66±0.07(t=-6.7 6 2,P=0.0 0 2)、0.5 1±0.0 6v s.1.05±0.09(t=-7.366,P=0.002);阴性对照组各对应时间点OD490nm值分别为0.12±0.02、0.2 1±0.0 3、0.3 6±0.0 4、0.6 3±0.0 5、0.97±0.09,各时间点与空白对照组对应时间点差异均无统计学意义(均P>0.05)(图2B)。

图1 miR-519d在正常胰腺导管上皮细胞系及胰腺癌细胞系中的表达Figure 1 The expressions of miR-519d in normal pancreatic duct epithelial cell line and pancreatic cancer cell lines
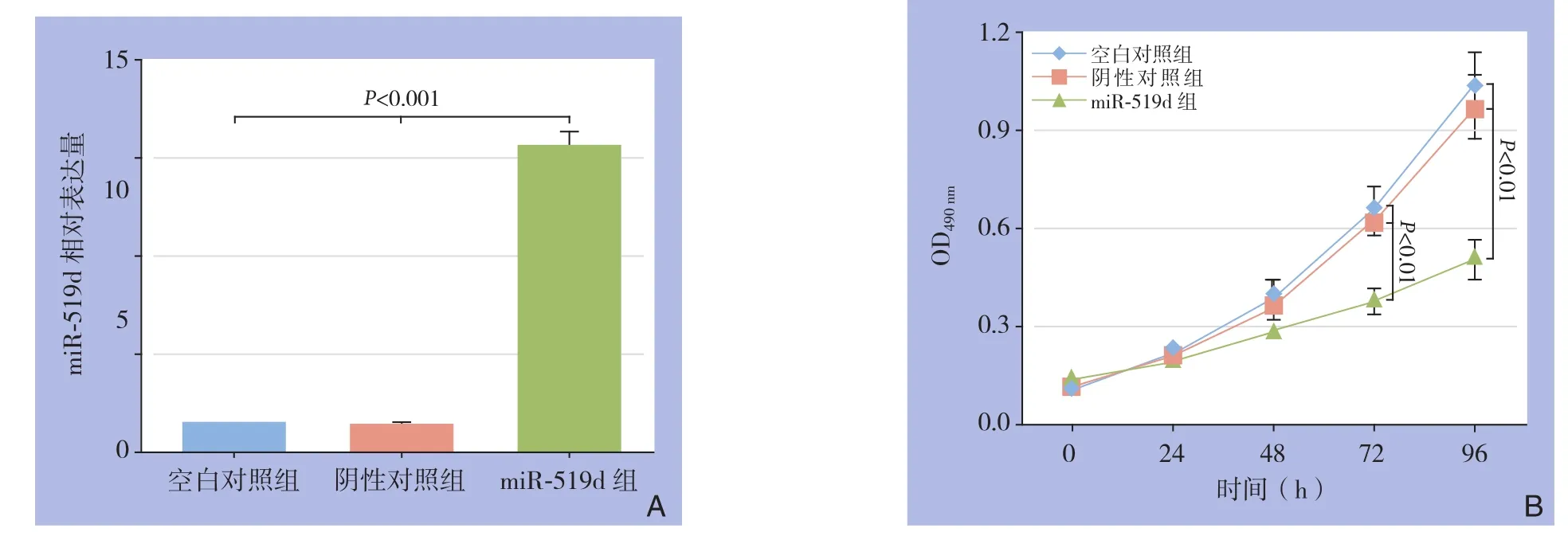
图2 转染效率及细胞增殖检测 A:各组细胞中miR-519d表达量比较;B:各组细胞增殖曲线Figure 2 Examination of transfection efficiency and proliferative ability of the cells A: Comparison of expression levels of miR-519d among groups; B: Proliferative curves of the three groups
2.3 细胞凋亡检测结果
流式细胞检测结果显示,miR-519d组细胞凋亡率高于空白对照组[(23.06±2.46)%vs.(5.46±0.82)%,t=12.468,P=0.006];阴性对照组凋亡率为(4.78±0.63)%,与阴性对照组差异无统计学意义(t=1.139,P=0.337)(图3)。

图3 细胞凋亡检测 A:各组细胞凋亡流式细胞术检测结果;B:各组细胞凋亡率比较Figure 3 Apoptosis measurement A: Results of apoptosis determination of the three groups of cells by flow cytometry; B: Comparison of apoptosis rates among groups
2.4 细胞侵袭 能力检测结果
T r a n s w e l l实验结果显示,2 0 0倍视野下,m i R-5 1 9 d组侵袭细胞数少于空白对照组[(92.3±10.1)个vs.(163.8±17.18)个,P<0.0 1];阴性对照组与空白对照组侵袭细胞数差异无统计学意义[(1 6 3.8±1 7.1)个v s.(151.3±14.8)个,P>0.05](图4)。
2.5 XIAP蛋白表达检测结果
Western blot结果显示,miR-519d组XIAP蛋白表达量低于空白对照组(0.36±0.04vs.1.0±0.07,P=0.006);阴性对照组与空白对照组XIAP蛋白表达量差异无统计学意义(P>0.05)(图5)。
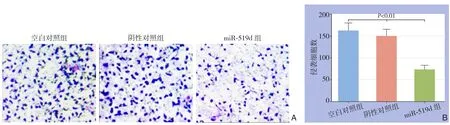
图4 细胞侵袭能力检测 A:Transwell实各组侵袭细胞(×200);B:各组侵袭细胞数比较Figure 4 Invasion ability detection A: Transwell assay for invading cells in each group (×200); B: Comparison of numbers of invading cells among groups

图5 XIAP蛋白表达检测 A:Western blot检测各组XIAP蛋白;B:各组XIAP蛋白表达量的比较Figure 5 XIAP protein expression determination A: XIAP protein expression of each group detected by Western blot; B: Comparison of XIAP protein expression levels among groups
3 讨 论
由于发病隐匿,80%的胰腺癌患者于就诊时已进入中晚期,这使得胰腺癌预后较差[1]。研究[12]表明,特定miRNA的异常表达可作为反映胰腺癌预后的标志物。例如,miR-212和miR-132在胰腺癌中的异常高表达能够作为区分良性还是恶性病变的指标[13]。血清中高miR-196a水平与胰腺癌患者的恶性程度及低生存率相关,可用来筛选适合手术的早期患者[14]。
miR-519d定位于19号染色体C19MC区域,该区域的所有miRNA由RNA聚合酶II转录而来[15]。在本研究中,通过比较胰腺癌细胞系及正常胰腺上皮细胞系,发现miR-519d的表达量在胰腺癌细胞中是显著被抑制的,这提示miR-519d可能在胰腺癌中发挥着类似于抑癌基因的功能。在卵巢癌患者晚期病灶中,miR-519d的表达量是早期患者的1/3,这提示miR-519d可能在卵巢癌患者中发挥抑癌基因的作用[16]。在原发性肝癌中,通过下调Ki-67抗原的表达,miR-519d可对肝癌增殖产生抑制作用,miR-519d扮演着抑癌的作用[17]。但是,也有研究[18]发现在肝癌细胞系中,miR-519d可受到p53低甲基化状态的调控导致表达上调。miR-519d能够通过靶向调控第10号染色体同源缺失性磷酸酶张力蛋白(phosphatase and tensin homolog deleted on chromosome ten,PTEN)、丝氨酸/苏氨酸蛋白激酶(RAC-gamma serine/threonineprotein kinase,Akt3)/蛋白激酶B(protein kinase B,PKB)、细胞周期蛋白依赖性激酶抑制剂1A(cyclin-dependent kinase inhibitor 1A,CDKN1A)和基质金属蛋白酶2(tissue inhibitor of metalloproteinases 2,TIMP2)在肝癌中发挥癌基因的作用[18]。这提示miR-519d在不同的肿瘤类型中可能发挥不同的功能。
在本研究中,相对于正常胰腺上皮细胞系,过表达miR-519d的miR-519d组胰腺癌细胞增殖和侵袭能力被明显抑制了,同时凋亡率升高,提示miR-519d在胰腺癌中扮演着抑癌基因的作用,miR-519d可抑制增殖和侵袭,并促进凋亡,这与卵巢癌[16]中结果类似。
前人通过生物信息学分析和双荧光素酶报告实验证明,XIAP是miR-519d的靶基因之一[19],miR-519d可通过抑制XIAP的表达,进而抑制癌细胞的增殖,并提高癌细胞对顺铂的敏感性[19]。XIAP具有抑制半胱氨酸蛋白酶(caspase)的活性,其在卵巢癌细胞和组织中表达上调,可通过调控磷脂酰肌醇3-激酶/Akt通路、抑制caspase的活性,进而使癌细胞产生凋亡抑制和化疗耐药[20]。XIAP受到NF-κB的调控,直接抑制起始凋亡蛋白caspase-9和效应凋亡蛋白酶caspase-3、caspase-7,其是外源性凋亡途径和内源性凋亡途径的重要节点[21]。同时XIAP也可激活NF-κB,形成一个正反馈通路,能够放大影响效应,NF-κB的激活是多种恶性肿瘤发生化疗耐药的重要原因[22]。在本研究中,发现过表达miR-519d可显著降低XIAP的表达,这提示在胰腺癌中,miR-519d上调表达可能通过下调XIAP表达,进而影响内外源性凋亡信号通路,进而促进胰腺癌细胞凋亡,这可能是miR-519d过表达后胰腺癌细胞凋亡率增加的机制之一,同时也提示miR-519d和XIAP可能作为一个潜在胰腺癌诊疗靶标以及化疗耐药分子靶点。
当然,由于是体外细胞系实验,本研究难免存在一定的不足,比如,miR-519d在动物体内的结果如何,miR-519d与上下游分子的作用机制,都值得进一步研究。
综上,本研究发现miR-519d在胰腺癌细胞系中低表达,上调miR-519d的表达可抑制胰腺癌细胞增殖和侵袭,并促进凋亡,其机制可能与XIAP下调表达有关,miR-519d可能成为胰腺癌治疗中的潜在靶点。
