内质网氧化还原蛋白基因在胰腺癌组织中的表达及其与患者预后的关系
2018-10-10吕波朱新锋蔡常春郑小林
吕波,朱新锋,蔡常春,郑小林
(华中科技大学同济医学院附属武汉中心医院 肝胆胰外科,湖北 武汉 430014)
胰腺癌是起源于胰腺导管上皮的肿瘤,恶性程度较高,5年生存率不到8%[1]。内质网氧化还原蛋白(endoplasmic reticulum oxidoreductin-1-like protein,ERO1L)是一种内质网腔内的糖蛋白,具有氧化酶活性[2-3]。在低氧条件下可诱导其表达[4]。研究[4]显示,ERO1L可调控低氧诱导的氧化蛋白的折叠。ERO1L参与了多种肿瘤的发生发展[5-7]。ERO1L能促进乳腺癌的生长,加速乳腺癌肺转移,高表达ERO1L的乳腺癌患者预后极差[5]。研究[6-7]发现,ERO1L在胃癌组织中高表达,与胃癌患者预后差相关。这些研究结果提示,ERO1L作为一个癌基因可能在肿瘤的发生发展中具有重要功能,然而ERO1L在胰腺癌中的表达情况及与临床病理因素间的关系尚不清楚。本研究通过检测ERO1L基因在胰腺癌组织及癌旁组织中的表达,分析ERO1L基因表达与胰腺癌患者临床病理因素和预后的关系。
1 材料与方法
1.1 组织标本
收集2013年1月—2015年12月在我院行胰腺癌切除手术的患者标本85例,其中行55例行胰十二指肠切除术、30例行胰体尾切除术;68例病理类型为胰腺导管腺癌,14例为黏液癌,2例为腺鳞癌,1例为小细胞癌。另收集12例癌旁组织作为对照。所有病例标本均保存于-80 ℃冰箱。纳入标准:⑴ 术前未经过放化疗治疗,所有标本均具有完整临床和随访资料;⑵ 所有病理样本均由病理确诊,诊断为胰腺癌;⑶ 均行手术治疗。剔除标准:⑴ 随访资料或临床资料不全者;⑵ 术前已行放化疗者;⑶ 伴随其他肿瘤者。剔除3例失访病例,共94例(肿瘤82例,正常组织12例)样本采用液氮研磨法提取中RNA,经实时荧光定量定量RCR(qRT-PCR)法分别检测胰腺癌组织与癌旁组织中ERO1L mRNA表达量。本研究经医院伦理委员会批准同意。
1.2 主要试剂
总RNA提取试剂TRIzol Universal购自天根生化科技(北京)有限公司。反转录试剂盒PrimeScript™ RT Master Mix、荧光定量检测试剂盒TB Green™ Premix Ex Taq™ (Tli RNaseH Plus),Bulk均购自Takara公司;ERO1L和GAPDH基因引物由金斯瑞生物科技有限公司合成。
1.3 ERO1L mRNA检测及分组
采用q R T-P C R法。采用液氮研磨提取总RNA,将组织重液氮去除后迅速于预冷研钵研碎,加入1 mL TRIzol Universal提取试剂。取1 µg总mRNA反转成cDNA。ERO1L上游引物:5'-CCA TTA GTG CTG CCA ACC AGT A-3',下游引物:5'-ATC TGC ATC AGC ATC ACG GTC-3';GAPDH上游引物:5'-GGT GTG GCA TCA GGA TTC AAG-3',下游引物5'-TTT CAT ACC GAT TGC TGT TGG A-3',按说明书进行qRT-PCR扩增反应。以GAPDH基因为内参,归一化计算ERO1L mRNA在组织中的相对表达量。将所有胰腺癌组织中的ERO1L表达量取平均值,小于均值定义为ERO1L低表达组,共35例;大于平均值定义为ERO1L高表达组,共47例。统计分析ERO1L表达水平与胰腺癌患者临床病理因素及预后间的关系。
1.4 随访
所有患者经门诊或电话随访,每半年随访1次,随访内容包括患者的一般情况、复发、转移及死亡情况。共随访85例患者,其中3例失访,失访率3.52%,共计82例入组研究。随访截止时间为2018年5月,平均随访时间(60.4±8.2)个月。
1.5 统计学处理
采用SPSS 20.0统计软件。实验数据以均数±标准差(±s)表示,统计处理采用独立t检验对组间进行比较;计数资料采用χ2检验。患者生存期和无瘤生存期采用Kaplan-Meier分析,单因素和多因素分析采用Cox回归模型。P<0.05为差异有统计学意义。
2 结 果
2.1 ERO1L mRNA在胰腺癌组织中的表达
qRT-PCR检测82例胰腺癌组织及12例癌旁组织中ERO1L mRNA的表达结果显示,ERO1L mRNA在胰腺癌组织中的表达量高于癌旁组织[(2.63±0.23)vs.(1.12±0.21),P<0.01](图1)。
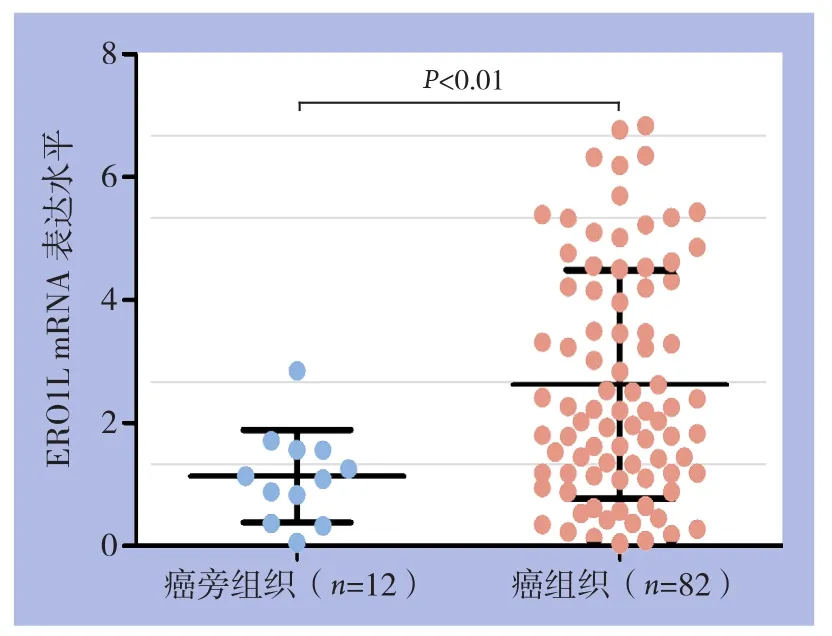
图1 qRT-PCR检测胰腺癌及癌旁组织ERO1L mRNA表达水平Figure 1 ERO1L mRNA expression levels in pancreatic cancer tissue and adjacent normal pancreatic tissue determined by qRT-PCR
2.2 ERO1L mRNA表达与胰腺癌患者临床病理因素的关系
统计分析结果显示,ERO1L mRNA表达与患者性别、年龄、肿瘤大小及肿瘤部位无关(均P>0.05),与肿瘤分化程度、临床分期、远处转移及淋巴结转移有关(均P<0.05)(表1)。
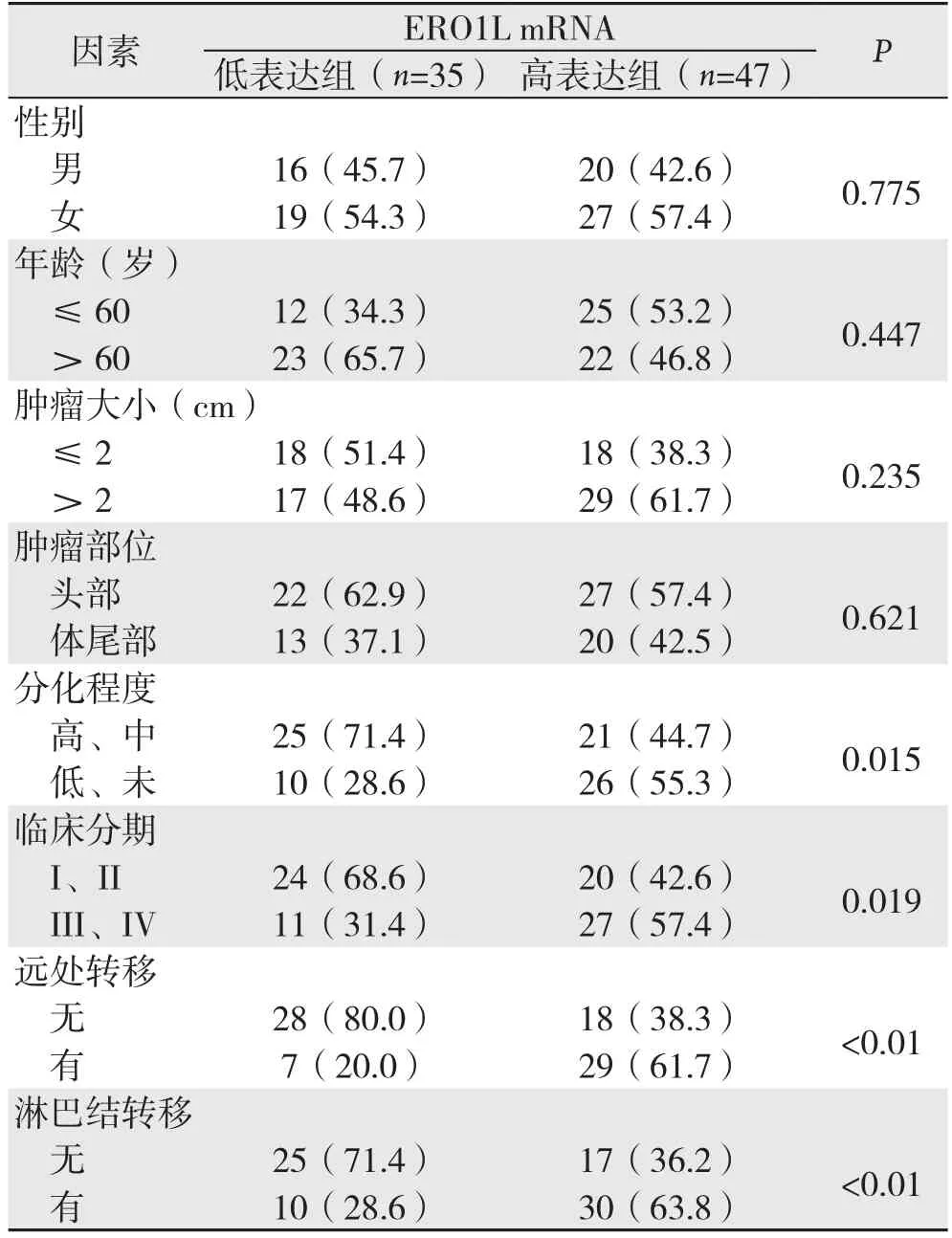
表1 ERO1L mRNA表达与胰腺癌患者临床病理因素的关系[n(%)]Table 1 Relations of ERO1L mRNA expression with clinicopathologic factors in pancreatic cancer patients[n (%)]
2.3 ERO1L mRNA表达水平与胰腺癌患者预后的关系
ERO1L高表达组1年无瘤生存率为50.3%,ERO1L低表达组为71.4%,ERO1L高表达组1年无瘤生存率低于ERO1L低表达组(P<0.01);ERO1L高表达组3年无瘤生存率为3.2%,ERO1L低表达组3年无瘤生存率为21.8%,ERO1L高表达组3年无瘤生存率低于ERO1L低表达组(P<0.01)(图2 A)。E R O 1 L高表达组1年总生存率为57.3%,ERO1L低表达组1年总生存率为86.9%,E R O 1 L高表达组1年总生存率低于E R O 1 L低表达组(P<0.01);ERO1L高表达组3年总生存率为21.6%,ERO1L低表达组3年总生存率为57.1%,ERO1L高表达组3年总生存率低于ERO1L低表达组(P<0.01)(图2B)。
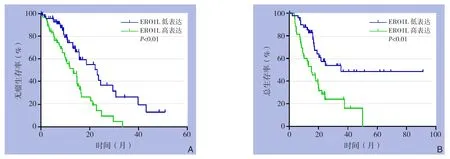
图2 ERO1L高表达与低表达胰腺癌患者的生存曲线 A:无瘤生存曲线;B:总生存曲线Figure 2 Survival curves of pancreatic cancer patients with high or low ERO1L A: Disease-free survival curves; B: Overall survival curves
2.4 ERO1L mRNA表达为影响胰腺癌患者无瘤生存及总生存的危险因素
单因素和多因素风险回归分析显示,除远处转移为胰腺癌患者无瘤生存期(P=0.019)和总生存期(P=0.025)的独立危险因素外,ERO1L表达也为判断胰腺癌患者无瘤生存期(P=0.029)和总生存期(P=0.021)的独立危险因素(表2-3)。
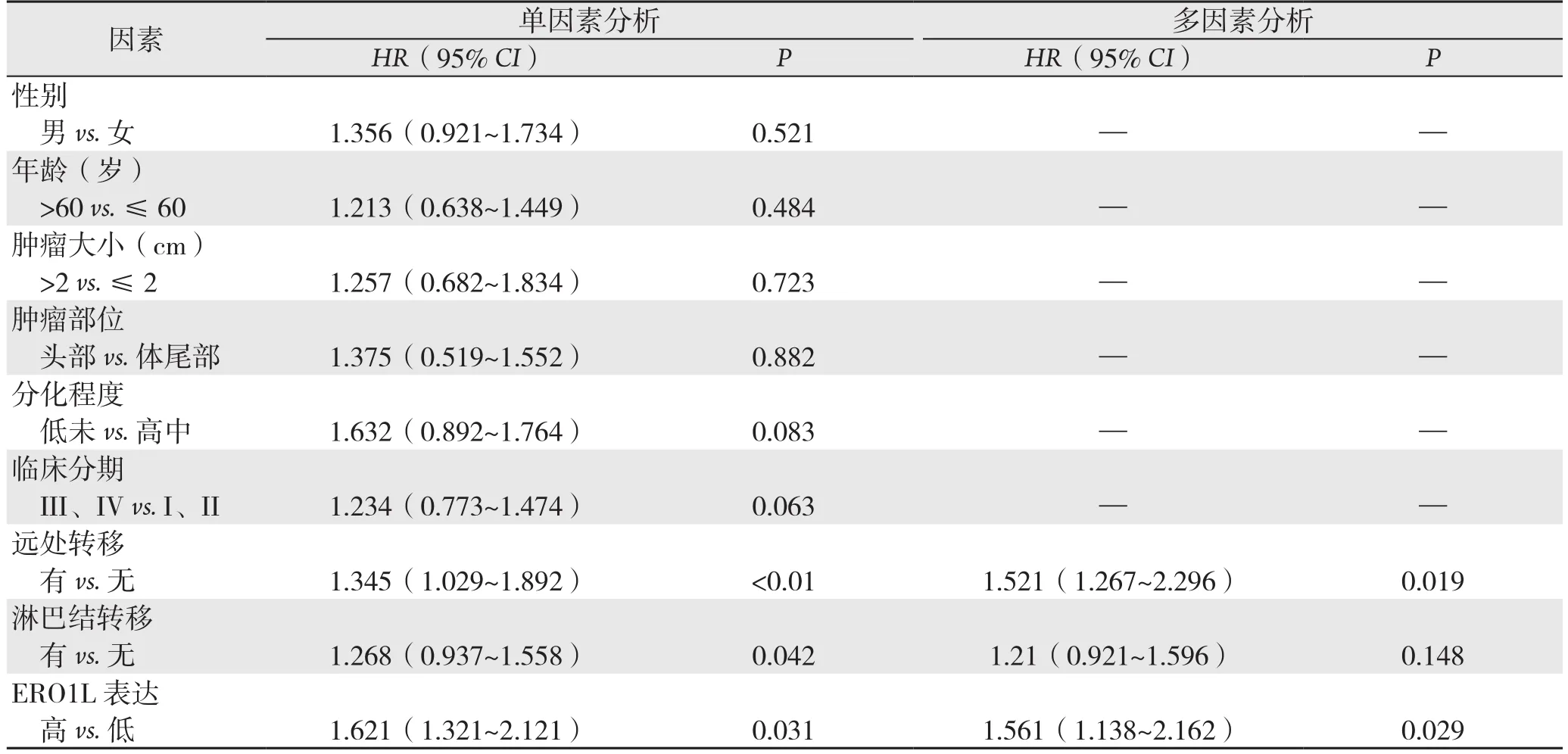
表2 单因素及多因素分析胰腺癌患者无瘤生存期相关的危险因子Table 2 Univariate and multivariate analyses of risk factors for tumor-free survival time in patients with pancreatic cancer
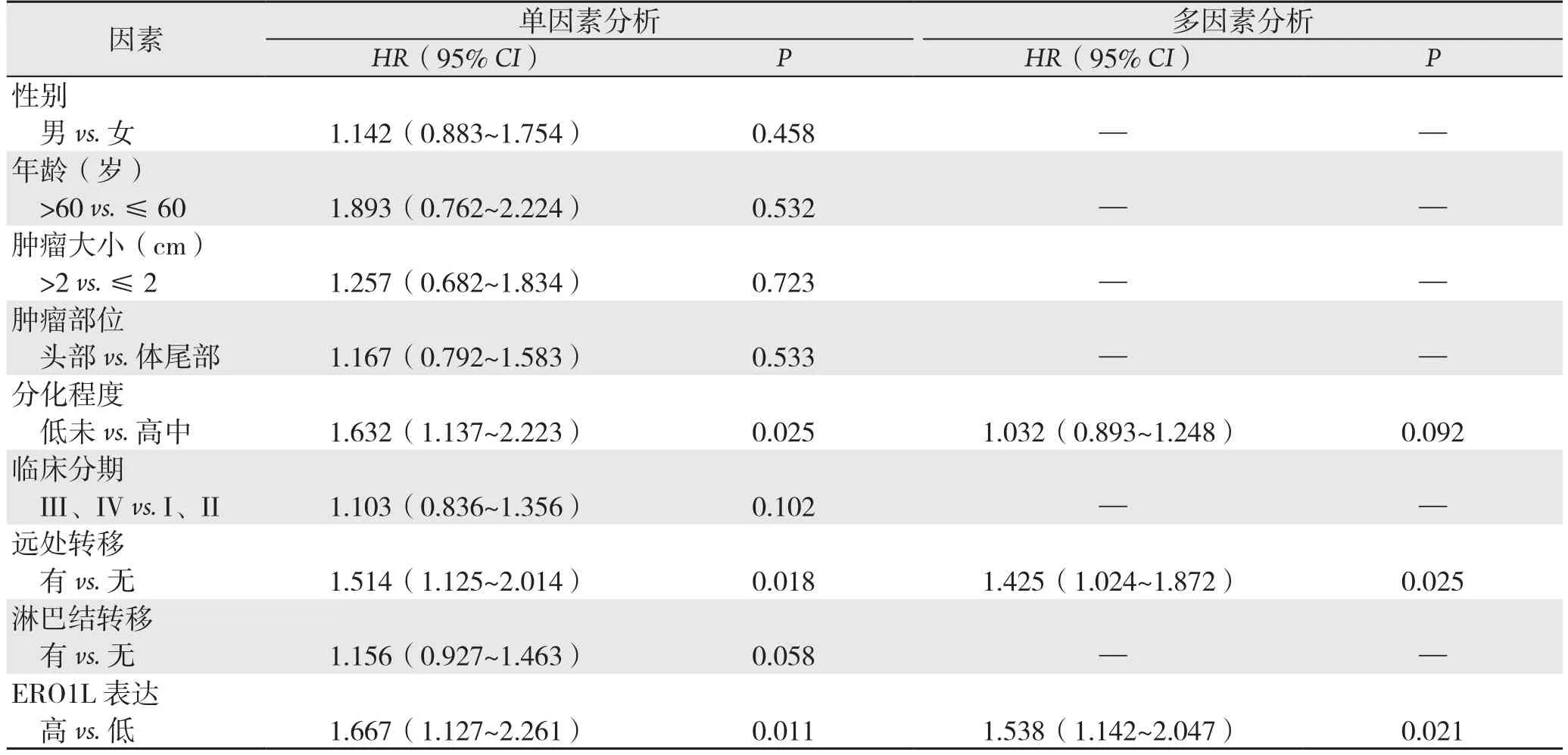
表3 单因素及多因素分析胰腺癌患者总生存期危险因子Table 3 Univariate and multivariate analyses of risk factors for overall survival time in patients with pancreatic cancer
3 讨 论
胰腺癌是一种高致死性肿瘤,预后极差[8-10],流行病学研究[11-12]表明,到2030年胰腺癌将超过乳腺癌、前列腺癌和结肠癌,成为第二大致死性肿瘤。研究胰腺癌的发病机制,寻找诊断治疗胰腺癌的靶标仍是该领域研究的重点。
ERO1L基因定位于人的第14号染色体,其转录翻译后主要定位在内质网腔中,具有氧化还原酶活性,调控由缺氧诱导的蛋白质折叠[13]。ERO1L催化蛋白质二硫键的形成并参与由内质网应激导致的细胞凋亡、炎症及转移过程[14-17]。Kukita等[18]发现ERO1L可通过氧化折叠调控I型MHC分子的表达。Hsu等[19]通过蛋白组学发现ERO1L高表达于肺癌组织中,并与肺癌患者的淋巴结转移和预后差相关。本研究发现,ERO1L mRNA在胰腺癌组织中的表达显著高于的癌旁组织,结合临床病理因素分析发现,ERO1L mRNA高表达的胰腺癌患者与恶性的临床病理因素相关,且ERO1L mRNA高表达的胰腺癌患者其无瘤生存率和总生存时间均显著低于低表达组患者,这与其他肿瘤中的研究结果一致。关于ERO1L在人类肿瘤中的作用机制报道相对较少,Tsutomu等[20]的发现,ERO1L可促进乳腺癌细胞在小鼠体内生长及血管生成,机制研究发现,ERO1L通过影响血管内皮生长因子氧化蛋白折叠进而调控血管内皮生长因子的mRNA表达。在小鼠乳腺癌中的研究发现,过表达ERO1L可抑制免疫T细胞抗肿瘤活性[21]。在胰腺癌[22]的功能研究中,发现ERO1L作为一个癌基因通过激活Wnt/catenin信号通路促进胰腺癌细胞的迁移和侵袭能力,但并没有通过临床病例标本研究ERO1L基因表达水平与胰腺癌患者临床病理参数及预后的关系。
在本研究中,ERO1L mRNA在胰腺癌组织中的表达量与患者临床病理因素,如患者临床分期、远处转移及淋巴结转移均显著相关,这些恶性病理特征正是肿瘤难以治愈,术后易复发、致死率高的主要原因。ERO1L mRNA低表达组患者术后复发几率较小,总生存时间显著长于ERO1L mRNA高表达组患者。ERO1L高表达组1、3年无瘤生存率低于ERO1L低表达组。单因素和多因素分析示ERO1L mRNA高表达可作为判断胰腺癌患者预后不良的独立危险因子,这与ERO1L在其他肿瘤中的报道一致。以上结果提示ERO1L在胰腺癌的发生发展中具有重要作用,其表达水平可作为判断胰腺癌患者预后的重要指标。
本研究也存在一定的不足之处,比如研究仅限于ERO1L基因与胰腺癌患者临床病理特征的关系研究,然而该基因是如何影响患者预后的机制尚不清楚,根据本研究结果,如ERO1L基因高表达的胰腺癌患者更易出现淋巴结转移和远处转移等特点,笔者推测ERO1L可能参与了胰腺癌细胞侵袭转移能力,具体的机制还有待后续基础实验来揭示。
综上,ERO1L mRNA在胰腺癌组织中高表达,ERO1L mRNA高表达与胰腺癌恶性临床病理因素及预后差相关。检测ERO1L基因的表达水平可作为判断胰腺癌患者不良预后的重要指标,进一步深入研究ERO1L在胰腺癌中的作用机制将有待助于指导胰腺癌治疗及开发新的治疗靶点。
