普通小麦品种陕农33矮秆突变体的矮化效应分析
2018-10-09赵秋实李倩倩王超杰蒋宏宝耿皆飞刘录祥张小燕谢彦周王成社
赵秋实,李倩倩,王超杰,蒋宏宝,耿皆飞,杨 媛,刘录祥,张小燕,谢彦周,王成社
(1.西北农林科技大学农学院,旱区作物逆境生物学国家重点实验室,陕西杨凌 712100;2.中国农业科学院作物科学研究所,北京 100081)
小麦是世界上最重要的粮食作物之一,分布广泛,消费量大,在我国是仅次于玉米和水稻的第三大粮食作物[1]。株高是影响小麦产量的关键因素之一,已成为小麦高产育种所需改良的重要目标性状。矮化育种是现代小麦高产育种的一个重要途径,20世纪60年代的“绿色革命”正是基于矮化育种使小麦的产量得到了很大的提高[2-3]。由于矮秆小麦在高产、灌溉和抗倒伏方面的优势,在大部分地区尤其是在半干旱地区,其已逐步取代普通的高秆小麦[4-5]。目前在育种中应用最广泛的矮秆基因有 Rht-B1b(Rht1)、 Rht-D1b(Rht2)、 Rht8和 Rht9;其中, Rht-B1b和 Rht-D1b来源于农林10, Rht8和 Rht9来源于Akakomugi[6-9]。目前小麦育种中矮秆基因的来源比较单一。在我国小麦品种中, Rht-B1b(Rht1)基因的平均分布频率为24.3%, Rht-D1b(Rht2)基因的平均分布频率更高,为46.9%[10];我国小麦中约42.3%的品种含有 Rht8基因[11];杨芳萍等[12]对世界小麦主产区及Guedira等[13]、孙树贵[14]等对美国小麦的矮秆基因来源进行分析,也发现当前矮秆基因的利用较为单一的情况。因此,挖掘创制新的矮源,研究新的矮秆突变体,有助于矮秆基因在小麦遗传育种上的应用并促进小麦产量的提高。
矮秆突变体作为研究矮秆基因和获取新矮源的基础材料已用于水稻[15]、玉米[16]、小麦[17]、大豆[18]、大麦[19]、棉花[20]等作物的遗传育种,以对水稻矮秆突变体的研究最为深入和广泛。目前对于小麦矮秆突变体的研究很多。研究发现,航天诱变的小麦矮秆突变体植株矮化的重要原因是倒一节节间纵向细胞数目的减少和长度的缩短[21];小麦矮秆突变体矮128属于赤霉素(GA)不敏感型突变体,其矮秆性状受一对隐性基因控制[22];经EMS(甲基磺酸乙酯)诱变得到的小麦矮秆突变体NM9对GA不敏感,其茎秆GA含量极显著高于野生型,从而抑制植株伸长[23];辐射诱变得到的小麦矮秆突变体的矮秆基因无不良基因的多效性,可以作为矮源在育种中利用[24]。虽然目前对小麦矮秆突变体的研究取得了一定的进展,但是目前还是不能满足育种的需要。
本试验选用经NaN3(叠氮化钠)处理小麦优质强筋品种陕农33得到的13个性状稳定的矮秆突变体为材料[25],进行农艺性状、赤霉素敏感性、内源激素含量、茎秆细胞学和矮秆基因检测和分析,以期初步了解这些矮秆突变体的矮化原因,为其在遗传育种中的应用奠定基础。
1 材料与方法
1.1 材 料
主要试验材料为小麦优良品种陕农33及陕农33经NaN3诱变得到的13个性状稳定的矮秆突变体,中国春和新麦18作为部分试验对照材料;13个矮秆突变体以田间编号命名为D20、I49、J79、G50、D2、G34、A62、E48-1、A96、B19、F27、I25、H96。所有材料种植于西北农林科技大学北校区试验田,株距10 cm,行长1 m,行宽30 cm。
1.2 DNA提取
在小麦三叶期,用CTAB法[26]提取基因组DNA,并用1%的琼脂糖凝胶电泳检测是否存在DNA降解和RNA污染。
1.3 农艺性状调查
在小麦成熟期分别调查陕农33及其矮秆突变体的株高、穗长及各茎节长度、穗数、穗粒数、每穗小穗数、千粒重等性状,并对野生型和矮秆突变体株高对比拍照。
1.4 细胞学观察
在小麦抽穗后取穗下节作为材料,参考《植物制片技术》[27]中的方法,并稍作修改,在穗下节的中部取5 mm制作组织切片,经过固定、初染、冲洗、脱水、透明、浸蜡、包埋、切片、脱蜡、复水、复染、透明、封固等过程制作石蜡切片,切片在32 ℃左右烘干,经番红固绿染色,在ZEISS(Imager M2)显微镜下观察,用测微尺测量细胞长度和秆壁厚度,记录100 μm2内的细胞数目,并进行统计分析。
1.5 对外源GA3反应的测定
外源GA3苗期处理参照Gale[28]和Worland[29]等的方法,并稍作改动。分别将种子放在湿润的培养基中,在4 ℃环境下萌发。两天后,将发芽一致的种子种植到花盆中。随后将花盆全部放在20 ℃、全黑暗的生长箱中,每天定量浇灌不同浓度的GA3。当植株进入三叶期,开始测量植株的第一片叶长度和胚芽鞘长度,每个浓度测10株。试验中每个材料设4个GA3浓度处理(0、20、50和100 mg·L-1),每个材料每次处理10株小麦苗。最后,将所得结果用SPSS 19.0(http:www.spss.com)进行单因素方差分析,判别植株的GA反应型。
1.6 内源激素含量测定
取小麦抽穗期穗下节中部,分别用赤霉素(GA3)、细胞分裂素(CTK)、生长素(IAA)、油菜素内酯(BR)激素试剂盒测定陕农33及矮秆突变体的内源激素含量(试剂盒由江苏科晶生物科技有限公司提供)。
1.7 分子标记检测矮秆基因 Rht-B1b和 Rht-D1b
Rht-B1b和 Rht-D1b引物序列按照Ellis等[30]提供的序列设计。PCR引物序列由上海生工生物技术有限公司合成。其引物序列如下:
BF:5′-GGTAGGGAGGCGAGAGGCGAG-3′;
DF:5′-CGCGCAATTATTGGCCAGAGATAG-3′;
DF2:5′-GGCAAGCAAAAGCTTCGCG-3′;
MR1:5′-CATCCCCCATGGCCATCTCGAGCTA-3′;
WR1:5′-CATCCCCATGGCCATCTCGAGCTG-3′;
MR2:5′-CCCCATGGCCATCTCGAGCTGCAT-3′;
WR2:5′-GGCCATCTCGAGCTGCAC-3′。
Rht1基因位点野生型( Rht-B1a)和突变型 ( Rht-B1b)的特异性引物中,引物BF与WR1用于检测Rht-B1a基因,BF与MR1用于检测 Rht-B1b基因;Rht2基因位点野生型(Rht-D1a)和突变型( Rht-D1b)的特异性引物中,引物DF2与WR2用于检测Rht-D1a基因,DF与MR2用于检测 Rht-D1b基因。
Rht1检测的PCR反应条件:95 ℃,10 min;94 ℃变性30 s、65 ℃退火30 s、72 ℃延伸30 s,32个循环;最后72 ℃延伸5 min;Rht2检测的PCR反应条件:95 ℃,10 min;94 ℃变性30 s、64 ℃退火30 s、72 ℃延伸10 s,43个循环;最后72 ℃延伸 5 min。Rht1基因和Rht2基因的扩增产物以2%的琼脂糖凝胶电泳检测,缓冲体系均为1×TAE溶液,100 V 电压下电泳,溴化乙锭染色,凝胶成像仪下观察并照相。
2 结果与分析
2.1 矮秆突变体的主要农艺特征
野生型陕农33株高为79.5 cm,矮秆突变体的株高为43.4~66.1 cm,这些矮秆突变体株高较陕农33均有极显著的降低(图1和表1)。13个矮秆突变体千粒重较陕农33均减少,其中11个材料的变化达到极显著水平。有6个矮秆突变体的单株产量较陕农33增加,其中D20增产极显著;7个材料的单株产量较陕农33减少,其中4个材料极显著减产(表1)。矮秆突变体的其他农艺性状较陕农33有降也有升,表明矮秆突变连锁了一些不良农艺性状突变。在这些突变材料中D20、I49、J79和A96农艺性状综合表现相对较好,可作为育种中间材料。
2.2 矮秆突变体的节间长度
小麦株高的降低通常是由于节间的缩短或者是节间数的减少导致。通过测定分析,与野生型陕农33相比,这些矮秆材料的节间数没有发生变化,加上穗下节一共都是5个节间;矮秆突变体株高的降低主要是由于各个节间的缩短所致,其中穗下节和第四节间缩短较为明显。13个矮秆突变体的各节间均较野生型陕农33缩短,且大部分变化显著或极显著,降秆效应较大(表2)。
2.3 矮秆突变体的穗下节间细胞学显微观察结果
小麦株高的变化通常伴随着茎秆细胞数目或者大小的变化。对穗下节进行石蜡切片观察发现,矮秆突变体较陕农33穗下节维管束有增多的趋势(图2a、图2c、图2e);9个矮秆突变体秆壁厚度比野生型陕农33有所减少,其余4个矮秆突变体秆壁厚度有所增加;矮秆突变体的穗下节细胞长度较野生型陕农33极显著缩短,同时穗下节单位面积内的细胞数目增加,表明其细胞变小(图2、表3)。由此可以推断,突变体株高的降低是由于茎秆细胞长度的减少和细胞变小共同造成的,而细胞长度的减少是主要因素。

SN33:陕农33。SN33:Shaannong 33.
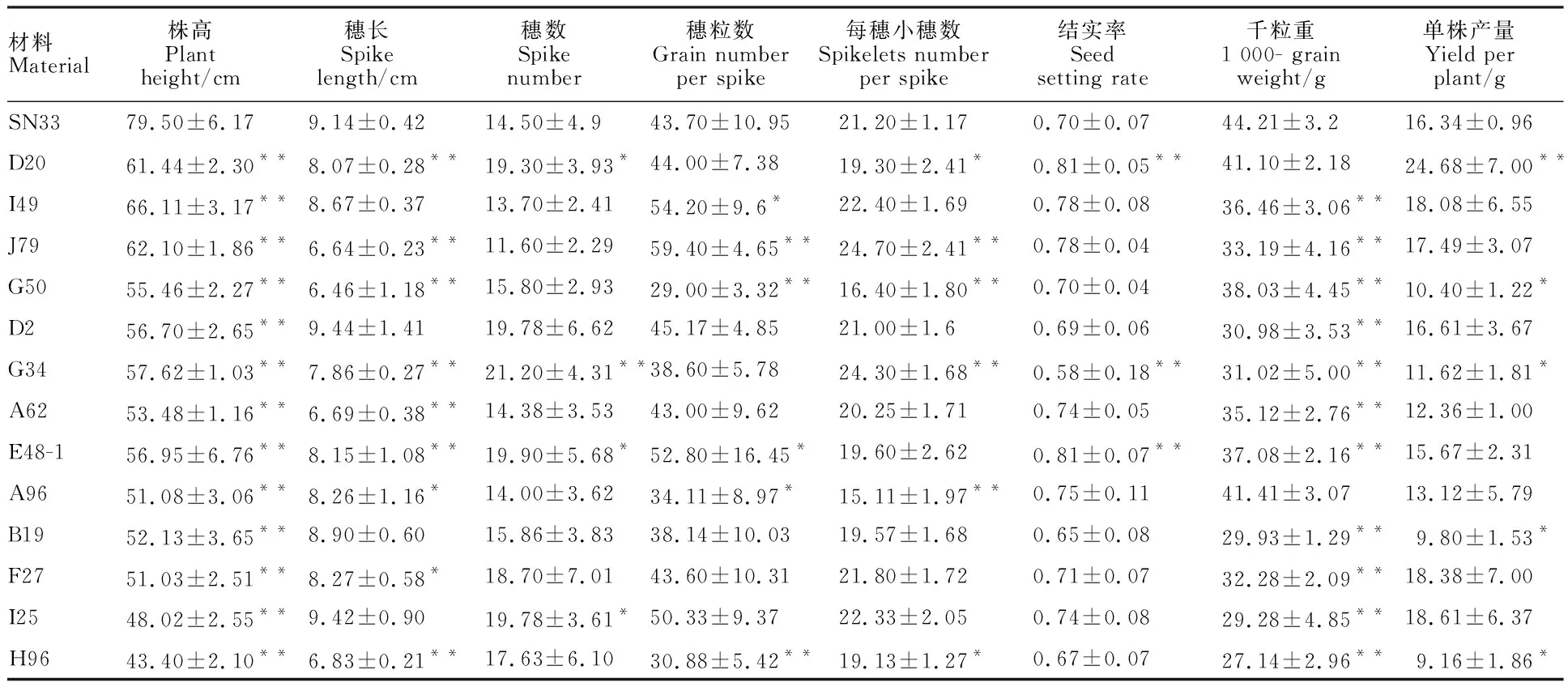
表1 矮秆突变体和陕农33主要农艺性状的比较Table 1 Comparison of main agronomic traits of dwarf mutants and Shaannong 33
2.4 矮秆突变体的对外源GA3的反应
根据赤霉素对幼苗形态的影响,可将矮秆材料划分为赤霉素敏感型和赤霉素不敏感型。与不施GA3处理(0 mg·L-1)相比,经不同浓度的GA3处理后,陕农33和G50、D2、G34、A62、E48-1、A96、B19、H96的胚芽鞘长度均没有发生显著变化(表4),应属于赤霉素不敏感型;I49、J79、D20、F27、I25的胚芽鞘长度在个别的GA3浓度下有显著变化,应属于赤霉素弱敏感型(表4)。中国春(赤霉素敏感型)的胚芽鞘长度随GA3浓度的升高而增加,新麦18(赤霉素不敏感型)则变化不明显(表4)。
2.5 矮秆突变体的内源激素含量差异
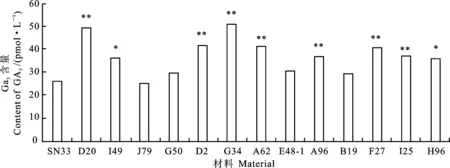
与陕农33相比,12个矮秆突变体穗下节的GA含量增加,其中7个突变体的变化达到极显著水平,只有1个有微弱减少(图3);矮秆突变体CTK含量均降低,其中有12个材料的变化极显著降低(图4);10个矮秆突变体的IAA含量有所升高,3个矮秆材料有所降低(图5);矮秆突变体的BR含量变化不一,其中5个矮秆材料有所升高,8个矮秆材料有所下降(图6)。这说明矮秆突变体株高的降低伴随着内源激素的变化。结合外源激素测定结果分析,这些矮秆材料的矮化可能与内源激素代谢的变化密切相关。

表2 矮秆突变体和陕农33的节间长度Table 2 Internode length of dwarf mutants and Shaannong 33 cm
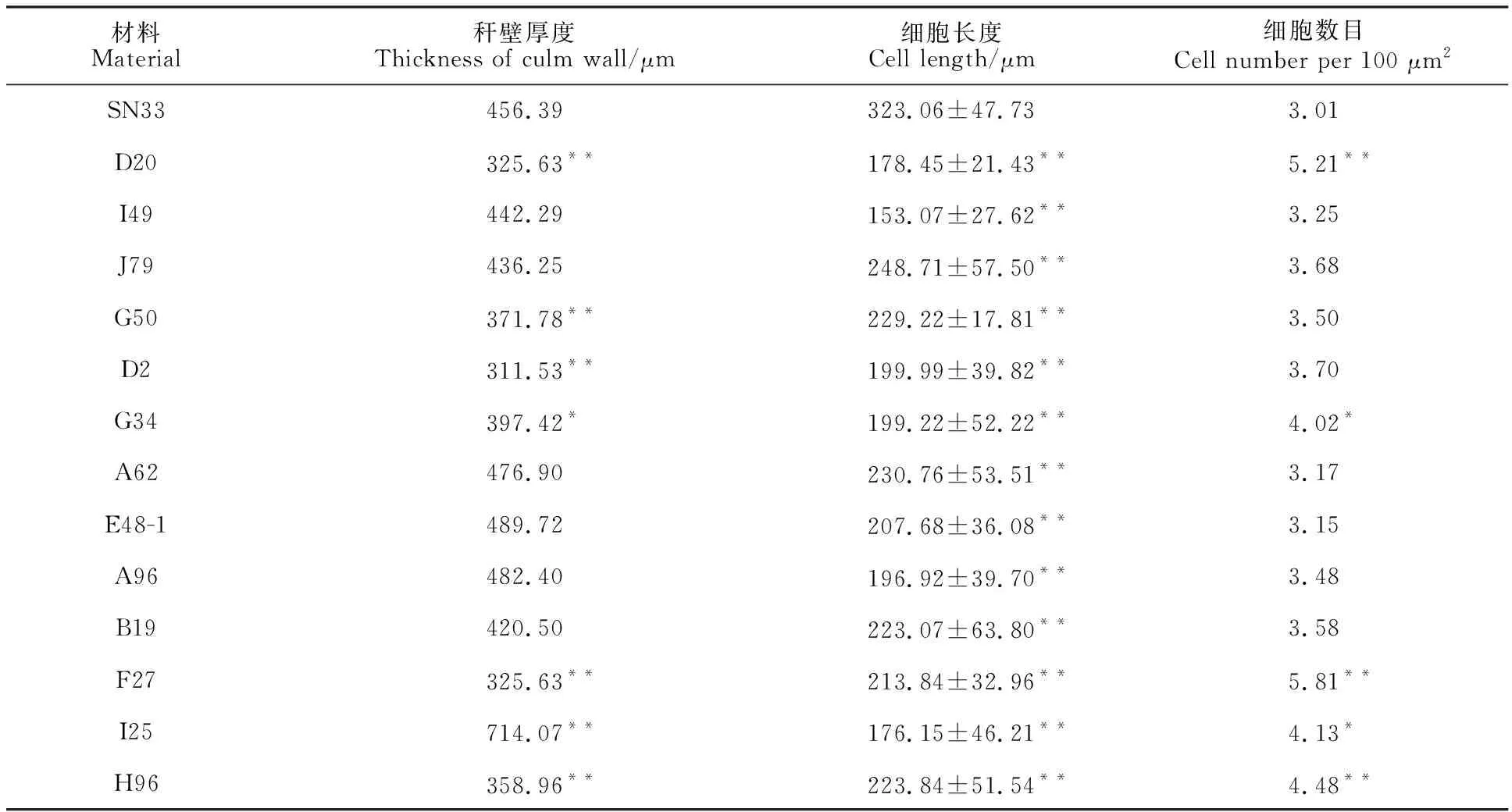
表3 矮秆突变体和陕农33茎秆特征的统计分析Table 3 Statistical analyses of stem characteristics of dwarf mutants and Shaannong 33
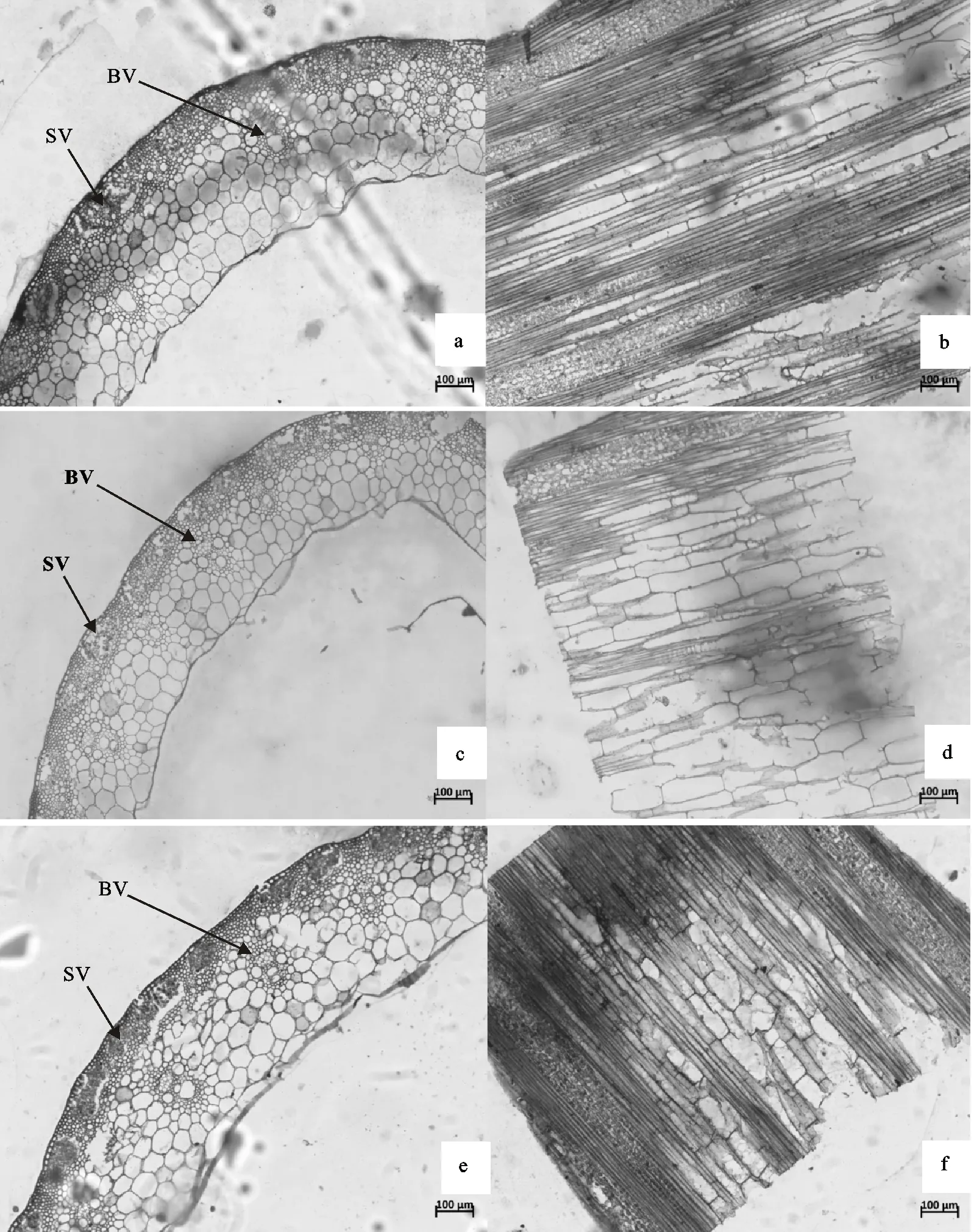
a、b:陕农33穗下节横切、纵切;c、d:矮秆突变体材料D20穗下节横切、纵切;e、f:矮秆突变体材料I49穗下节横切、纵切;SV:小维管束;BV:大维管束。a and b:Transverse and longitudinal sections of the peduncle of Shaannong 33; c and d:Transverse and longitudinal sections of the peduncle of dwarf mutant D20; e and f:Transverse and longitudinal sections of the peduncle of dwarf mutant I49; SV:Small vessels; BV:Large vessels.
2.6 矮秆突变体的矮秆基因检测结果
目前已发现并命名的矮秆基因大概有27个,本试验初步对在育种中应用范围较广的2个矮秆基因 Rht-B1b(Rht1)和 Rht-D1b(Rht2)进行检测,以初步分析陕农33和矮秆突变体是否含有这两个在育种中应用较广的矮秆基因;利用Ellis[30]等设计的引物序列,检测 Rht-B1b基因。如果小麦品种中具有Rht-B1a基因,用引物BF和WR1可以扩增出一条237 bp的片段;如果具有 Rht-B1b基因,用引物BF和MR1也可以扩增出一条237 bp的片段,因此同一品种的两对引物PCR产物可以互补验证(图7)。用引物DF2与WR2检测Rht-D1a基因,DF与MR2检测 Rht-D1b基因。如果小麦品种中具有Rht-D1a基因,可以扩增出一条264 bp的片段;如果具有 Rht-D1b基因,则可以扩增出一条254 bp的片段(图8);在PCR反应和凝胶电泳中,加入无 Rht-B1b和 Rht-D1b基因的CS作为对照。
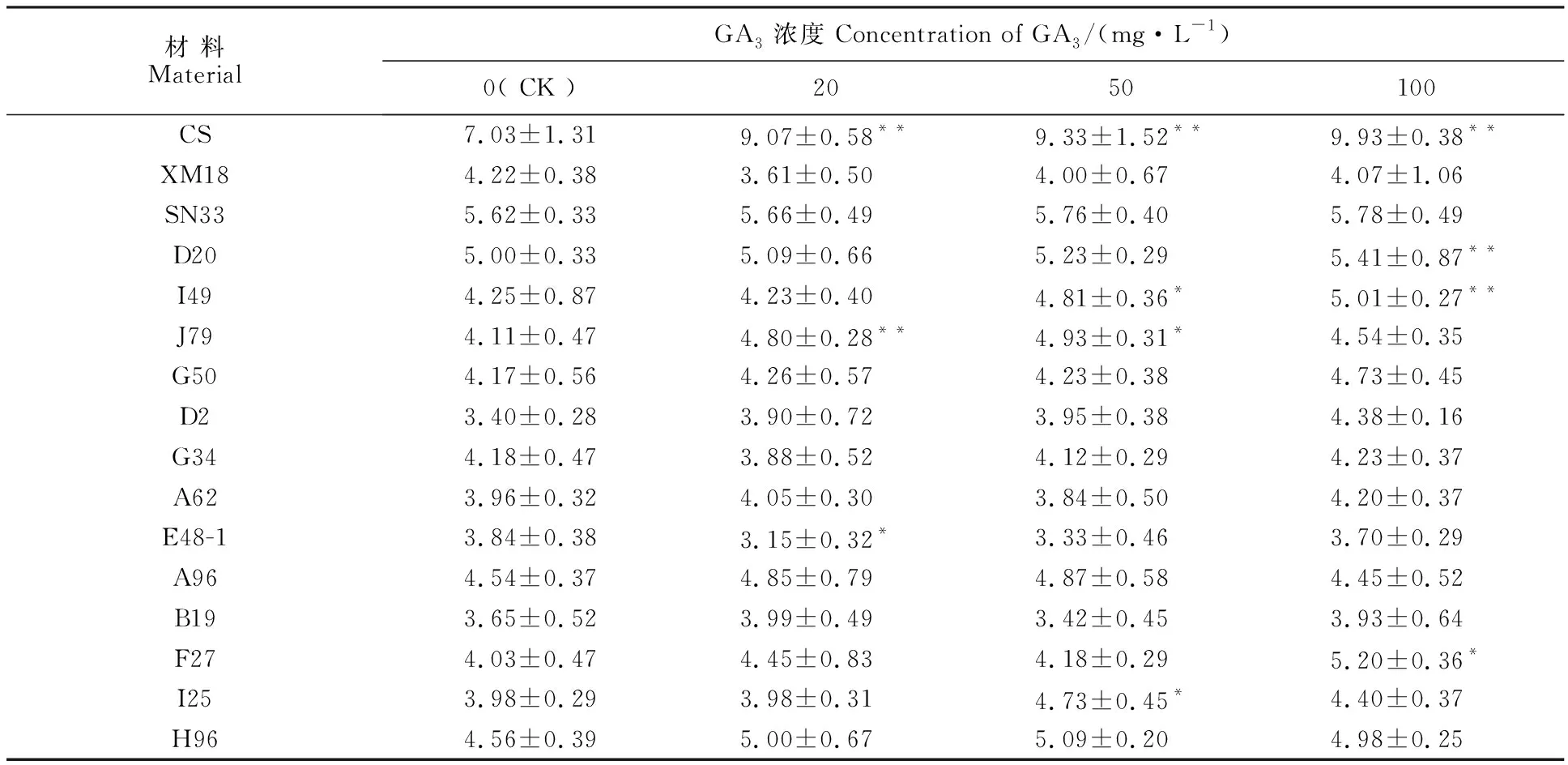
表4 外源赤霉素(GA3)对矮秆突变体和陕农33幼苗胚芽鞘长度的影响Table 4 Effects of gibberellin acid(GA3) on the coleoptile length of dwarf mutants and Shaannong 33 at seedling stage
*和**分别表示矮秆材料和陕农33相比较在0.05和0.01水平上差异显著。SN33:陕农33。图4~图6同。* and ** mean significant difference between dwarf mutants and Shaanong 33 at 0.05 and 0.01 levels, respectively. SN33:Shaannong 33. The same in figure 4-figure 6.
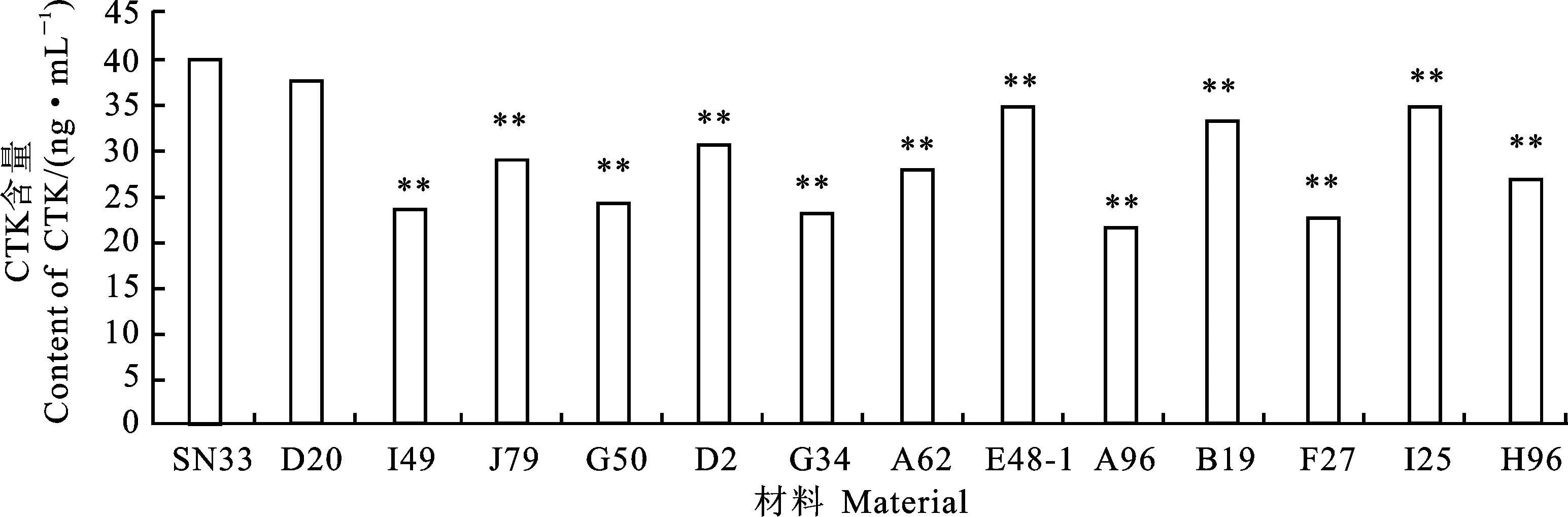
图4 矮秆突变体和陕农33穗下节内源CTK含量

图5 矮秆突变体和陕农33穗下节内源IAA含量

图6 矮秆突变体和陕农33穗下节内源BR含量

M:2 000 bp DNA ladder;1:中国春;2:陕农33;3:D20;4:I49;5:D2;6:I25;a: Rht-B1a 基因特异性引物的PCR扩增;b: Rht-B1b 基因特异性引物的PCR扩增。M:2000 bp DNA ladder;1:Chinese Spring;2:Shaannong 33;3:D20;4:I49;5:D2;6:I25;a:PCR amplification of Rht-B1a gene-specific primers;b:PCR amplification of Rht-B1b gene-specific primers.
经PCR分析,矮秆突变体材料和陕农33中均扩增出254 bp片段(表5),说明其均含有 Rht-D1b基因;而在D2和I25中利用引物BF和MR1扩增出237 bp片段(图8),说明这两个矮秆突变体材料含有 Rht-B1b基因。这表明矮秆突变体材料和陕农33均含有矮秆基因 Rht-D1b,矮秆突变体材料的株高降低表明其体内可能还含有其他致矮相关的基因。
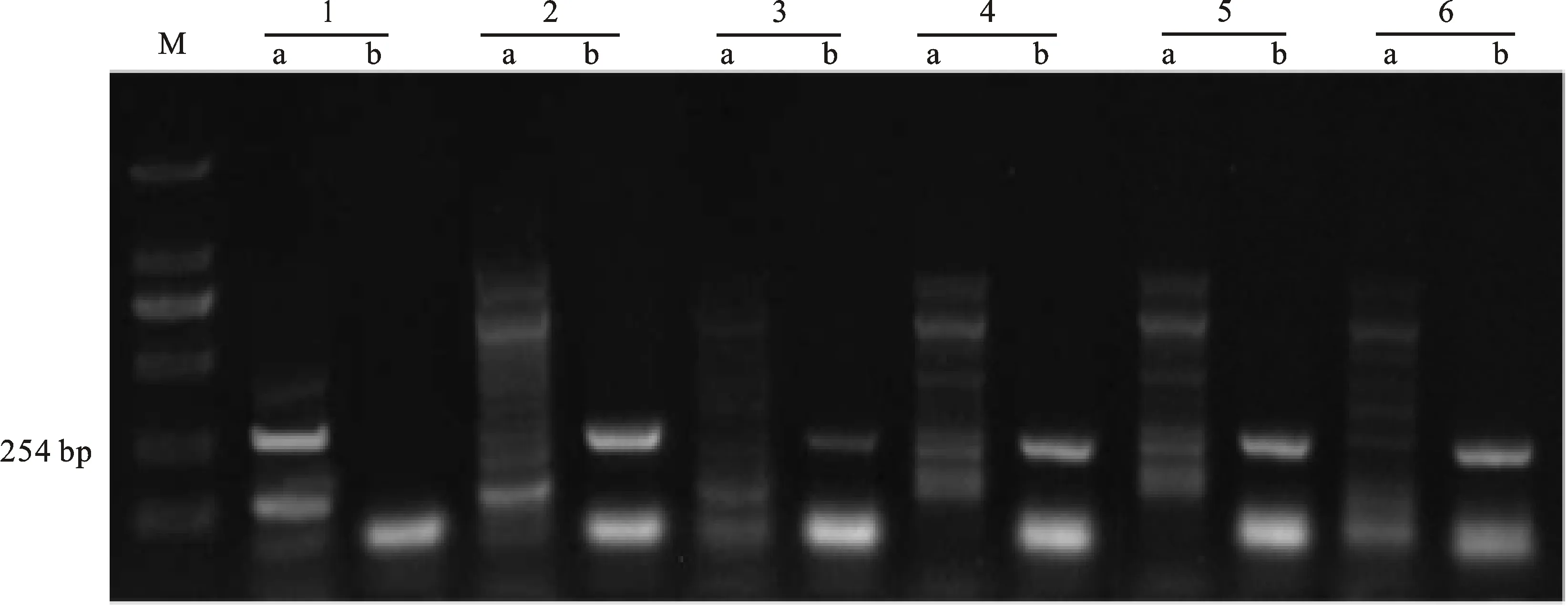
M:DNA ladder 2000;1:中国春;2:陕农33;3:D20;4:I49;5:D2;6:I25; a:Rht-D1a基因特异性引物的PCR扩增,b: Rht-D1b 基因特异性引物的PCR扩增。 M:DNA ladder 2000; 1:Chinese Spring; 2:Shaannong 33; 3:D20; 4:I49; 5:D2; 6:I25; a:PCR amplification with Rht-D1a gene-specific primers; b:PCR amplification with Rht-D1b gene-specific primers.
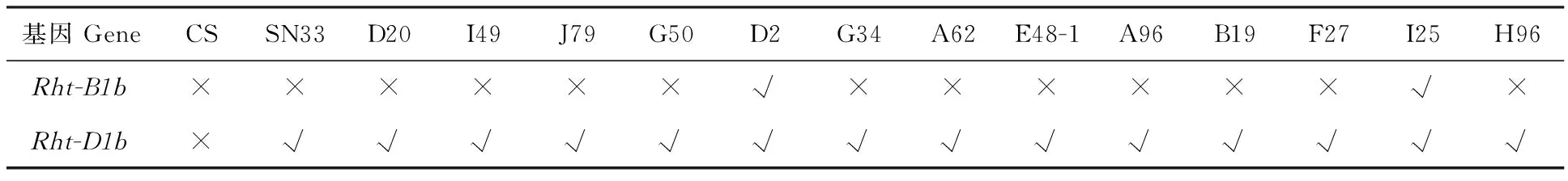
表5 矮秆基因检测结果统计Table 5 Result of dwarf gene test
3 讨 论
自第一次“绿色革命”以来,矮秆材料的利用使小麦的单产和总产得到了大幅提高,株高也成为小麦高产育种的重要目标性状。但目前应用于小麦育种的矮秆基因的来源比较单一,因此需要进一步创制和研究新的小麦矮源。
小麦的矮秆基因主要有赤霉素敏感型和赤霉素不敏感型两种类型。研究表明,赤霉素敏感型的矮秆基因对株高的降秆能力较弱,但是其对重要农艺性状的影响要小一些,适合于干旱和半干旱地区育种利用。赤霉素不敏感型矮秆基因降秆能力较强,但同时也会影响到一些重要的农艺性状如胚芽鞘、籽粒大小等等[31-33]。本研究中的矮秆材料为赤霉素不敏感型或弱敏感型,降秆效果较明显,但同时有一些不良性状的连锁(如千粒重降低、单株产量的降低等),这与前人研究结果一致。这些矮秆材料中综合农艺性状相对较好的D20、I49、J79和A96可作为育种中间材料进行利用。
紫外线[34]、EMS[35]、NaN3[25]等诱变技术都能使作物产生矮秆突变效应,且株高的致矮机理也不尽相同。水稻矮秆突变体MU101的节间数较野生型减少2个,各节间也有所缩短,细胞数目的减少是矮变的主要原因[15];而航天诱变的小麦矮秆突变体的矮化结果主要归因于各节间缩短、细胞长度的变小和细胞数目的减少[21]。本研究中,突变体的致矮原因与前人研究结果有所不同,矮化主要取决于各节间的缩短,而节间数目不变,其中穗下节和第四节间的缩短降低株高的效应最大。细胞学观察发现,穗下节的细胞长度下降,体积变小,共同导致了矮秆突变体的矮化,其中矮秆材料的细胞长度有极显著变短,是株高矮化的主要原因。
植物内源激素通过调节或改变生理活动,对植物的生长发育进程有着很重要的调控作用[36]。在已发现的植物激素中,赤霉素(GA)、细胞分裂素(CTK)、生长素(IAA)、脱落酸(ABA)和油菜素内酯(BR)均参与了植物的株高建成[37-41]。研究表明,赤霉素敏感型矮秆突变体内源赤霉素合成受阻,内源赤霉素缺乏,导致植株变矮[42];而GA不敏感型矮秆突变体内源GA含量变化不大,甚至会显著高于野生型,GA的积累会抑制生长,导致株高降低[43]。小麦矮秆材料NM9对GA的不敏感,其茎秆GA含量较高,使植株矮化[23]。本研究中,13个矮秆材料经鉴定为GA不敏感或弱敏感型,12个矮秆突变体茎秆GA含量较野生型陕农33有所增加,只有1个微弱的降低,并且有9个显著增加,这与前人研究结果一致,推测矮秆材料的GA转导途径受阻,导致GA积累,抑制了植株生长,使株高降低。CTK主要作用是促进细胞分裂和细胞体积扩大。本研究中矮秆材料的CTK含量均降低,其中有12个达到极显著的降低,说明CTK的降低可能也影响了植株的生长发育。IAA和BR主要作用是促进细胞的伸长。在小麦矮秆材料NM9中IAA含量与野生型相比无显著差异[23],而本研究中矮秆材料IAA和BR含量相较于陕农33有升有降,可能是由于每个矮秆突变体都是独立的突变,它们的突变背景有所不同,在致矮突变的同时也引起了其他方面不同的突变,致使它们的内源IAA和BR表达水平有所不同。
目前育种中应用的矮秆基因来源相对比较单一,应用最广泛的有 Rht-B1b(Rht1)、 Rht-D1b(Rht2)、 Rht8和 Rht9;杨松杰等[10]研究发现, Rht-B1b(Rht1)基因在我国小麦中的平均分布频率为24.3%, Rht-D1b(Rht2)基因在我国小麦中的平均分布频率为46.9%;本研究检测分析发现,13个矮秆突变体和陕农33均含有 Rht-D1b基因,有两个矮秆材料D2和I25含有 Rht-B1b基因,这两个材料的株高也比较,但其他矮化材料,却不含有这个基因,因此推测矮秆材料可能还含有突变的致矮基因,后期需要进一步对这些矮秆材料进行遗传模式的分析和主效矮秆基因的定位,从而丰富小麦的矮源并使矮秆基因得到有效利用。
