27-羟基胆甾醇诱导人神经母细胞瘤细胞凋亡的调控机制
2018-10-08朱梦娇黄燕燕曹立唐维国
朱梦娇 黄燕燕 曹立 唐维国
27-羟基胆甾醇(27-OHCH)是一种典型的胆固醇氧化代谢产物,能自由通过血脑屏障而进入脑内,从而影响脑中髓鞘形成及神经退行性疾病的发生[1-2]。痉挛性截瘫5型(SPG5A)的致病基因胆固醇7α羟化酶(CYP7B1)基因发生突变[3],会引起神经中枢神经甾体代谢和肝内胆固醇旁路代谢异常,主要表现在肝脏对27-OHCH、在神经中枢对脱氢表雄酮(DHEA)进行羟化反应异常[4]。Schüle等[5]发现SPG5A患者血清中27-OHCH浓度是对照组的6~7倍,携带者与正常对照者差异无统计学意义;SPG5A患者脑脊液中27-OHCH浓度是对照组的30~50倍,但脑脊液中氧化型胆固醇等指标均正常。此外,动物实验研究表明,CYP7B1基因敲除的3月龄小鼠脑脊液中27-OHCH浓度明显高于野生型小鼠[6]。SPG5A患者和CYP7B1基因敲除小鼠脑脊液中27-OHCH浓度明显升高,提示27-OHCH浓度升高可能是SPG5A发病的重要因素。磷脂酰肌醇3激酶(PI3K)/丝氨酸/苏氨酸蛋白激酶(AKT)信号通路是参与细胞生长、增殖及死亡调控的重要通路之一[7]。中度或不持续的AKT活化能抑制细胞凋亡,通过各种下游效应分子促进细胞生长和血管生成;相反,AKT的过度激活会引发细胞衰老和凋亡[8]。27-OHCH能促使神经细胞生成β-淀粉样蛋白明显增多[9-10],上调Caspase-12,从而影响线粒体膜电位,使得活性氧自由基(ROS)蓄积,引起细胞凋亡[11-13];但具体调控机制目前尚未阐明。本研究将AKT抑制剂LY294002作用于人神经母细胞瘤细胞(SH-SY5Y),封闭PI3K/AKT信号通路,观察27-OHCH的细胞毒效应是否受其影响,进而探索27-OHCH诱导细胞凋亡的机制,为进一步揭示SPG5A的发病机制提供新思路。
1 材料和方法
1.1 细胞来源及培养 SH-SY5Y细胞购于中国科学院上海细胞库。用含10%FBS的RPMI 1640培养基,置37℃、5%CO2孵育箱中传代培养。
1.2 试剂及仪器 27-OHCH(英国Tocris Bioscience公司),以无水乙醇作为溶剂配置成20mM母液,置-20℃保存备用;RPMI 1640培养基、含 FBS的 DMSO、ACCUTASETM细胞消化液(美国Gibco公司);抑制剂LY294002、DAPI染液、CCK-8试剂盒(碧云天生物技术有限公司);0.45μm硝酸纤维素膜(美国Millipore公司);Annexin V-PE/7-AAD试剂盒(美国BD Sciences公司);AKT、磷酸化 AKT(p-AKT)、Caspase-9、β-actin 等抗体(美国Cell Signaling Technology公司)。FACS Calibur流式细胞仪(美国BD公司)。
1.3 CCK-8法检测细胞存活率 取5×104个/ml对数生长期细胞接种于96孔板,设置不同浓度(3.125、6.25、12.5、25.0、50.0μM)27-OHCH 处理组、溶剂对照组(添加与27-OHCH处理组相应浓度的无水乙醇)、空白组(孔内不加细胞,仅加细胞培养液)、阴性对照组(孔内加细胞,但不添加27-OHCH),每组6个复孔,分别作用24、48h后,吸去旧培养基;将培养基与CCK-8试剂按10∶1混匀,每孔加入100μl混合试剂;将培养板置于37℃、5%CO2恒温培养箱中避光孵育2h;利用酶标仪于450nm处测定吸光度(A)值。利用公式计算细胞存活率,细胞存活率=[(A27-OHCH处理组-A空白组)/(A溶剂对照组-A空白组)]×100%。
1.4 细胞形态观察 取1×105个/ml对数生长期细胞接种于φ14mm细胞爬片,次日加入不同药物浓度的27-OHCH。设置不同浓度的27-OHCH处理组,AKT通路抑制剂组(10μM LY294002提前作用2h,再加入不同浓度的27-OHCH)、阴性对照组,其中27-OHCH的浓度为 12.5、25.0μM;作用 48h 后,甲醛固定 10min,DAPI染色,在荧光显微镜下观察细胞核形态。
1.5 Western blot法检测细胞内 p-AKT、cleaved-caspase-9蛋白表达 取1×105/ml对数生长期细胞接种于24孔板,设置27-OHCH处理组、AKT通路抑制组(10μM LY294002提前作用2h,再加入不同浓度的27-OHCH)、空白对照组,其中27-OHCH的浓度为0、3.125、6.25、12.5、25.0、50.0μM。作用 48h 后用细胞裂解液裂解细胞,取蛋白样品约15μl,经12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳,转膜于0.45μm硝酸纤维素膜上,5%脱脂奶粉封闭2h,一抗4℃过夜;TBST缓冲液洗膜3次,10min/次;辣根过氧化物酶标记山羊抗兔IgG二抗(1∶2 000)室温孵育1h;TBST缓冲液洗膜3次,10min/次;将膜置于ECL化学发光剂中,用X线胶片曝光、显影及定影;以β-actin作为内参,应用Quantity one软件计算各WB条带的灰度值。
1.6 Annexin V-PE/7-AAD双染流式细胞仪检测细胞凋亡率 取1×105个/ml对数生长期细胞接种于24孔板,设置不同浓度的27-OHCH处理组、AKT通路抑制组(10μM LY294002提前作用2h,再加入不同浓度的27-OHCH)、无水乙醇溶剂对照组、无水乙醇+DMSO溶剂对照组,其中27-OHCH的浓度为12.5、25.0μM。利用ACCUTASETM细胞消化液消化细胞;800r/5min离心收集细胞,将细胞重悬于100μl结合液中;加入5μl Annexin V-PE和5μl 7-AAD,避光、室温孵育15min;FACS Calibur流式细胞仪上机检测,应用FlowJo软件分析细胞凋亡率。Annexin V-/7-AAD-为活细胞,Annexin V+/7-AAD-为早期凋亡细胞,Annexin V+/7-AAD+为晚期凋亡细胞或坏死细胞;其中Annexin V+/7-AAD-、Annexin V+/7-AAD+为凋亡细胞。
1.7 统计学处理 应用SPSS 18.0统计软件。计量资料用表示,多组间比较采用方差分析,两两比较采用Dunnet-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 27-OHCH对SH-SY5Y细胞存活率的影响 给药24h,12.5、25.0、50.0μM 27-OHCH 处理组 SH-SY5Y 细胞存活率均较阴性对照组明显降低,差异均有统计学意义(均 P<0.05);给药 48h,不同浓度(3.125~50.0μM)27-OHCH处理组SH-SY5Y细胞存活率均较阴性对照组明显降低,差异均有统计学意义(均P<0.05)。提示随着27-OHCH浓度增加或给药时间延长,SH-SY5Y细胞存活率均明显下降,见图1。
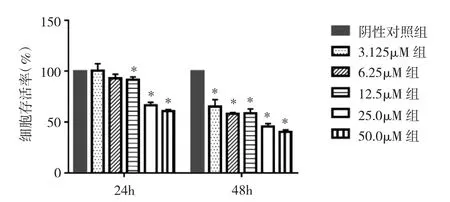
图1 27-OHCH对SH-SY5Y细胞存活率的影响(与阴性对照组比较,*P<0.05)
2.2 AKT抑制剂逆转27-OHCH细胞毒效应的形态学观察 在光学显微镜下,12.5、25.0μM 27-OHCH处理组作用48h后,SH-SY5Y细胞数量较阴性对照组明显减少,细胞形态发生明显变化(细胞皱缩变圆,贴壁能力减弱),随着27-OHCH浓度增加,变化越明显。DAPI染色结果显示,12.5、25.0μM 27-OHCH处理组SH-SY5Y细胞核出现明显的凋亡现象(核内染色质不规则凝集,细胞核破碎成块状或半月状,凋亡小体出现),随着27-OHCH浓度增加,凋亡现象越明显。与相同浓度的27-OHCH处理组比较,在光学显微镜下AKT通路抑制组SH-SY5Y细胞数量增多,细胞形态较好;在荧光显微镜下细胞核凋亡现象有所减弱,见图2。

图2 AKT抑制剂逆转27-OHCH细胞毒效应的形态学观察[a:阴性对照组;b:27-OHCH(12.5μM)处理组;c:27-OHCH(25.0μM)处理组;d:LY294002(10μM)+27-OHCH(12.5μM)组;e:LY294002(10μM)+27-OHCH(25.0μM)组]
2.3 27-OHCH对SH-SY5Y细胞内p-AKT、cleavedcaspase-9蛋白表达的影响 随着27-OHCH处理组浓度的增加,SH-SY5Y细胞内p-AKT(Ser 473)表达逐渐增强,见图 3a;经定量分析,12.5、25.0、50.0μM 27-OHCH处理组SH-SY5Y细胞内p-AKT(Ser 473)表达水平较阴性对照组均明显升高(均P<0.05),见图4。12.5、25.0、50.0μM 27-OHCH 处理组 SH-SY5Y 细胞内cleaved-caspase-9(37/35kD)表达明显增强,见图 3b。经AKT抑制剂预作用后,不同浓度(0~50.0μM)27-OHCH处理组p-AKT(Ser 473)表达均受抑制,见图3c;而12.5、25.0、50.0μM 27-OHCH 处理组 cleaved-caspase-9蛋白表达变化不明显,见图3d。提示27-OHCH能引起SHSY5Y细胞凋亡,AKT通路可能在其中发挥作用。
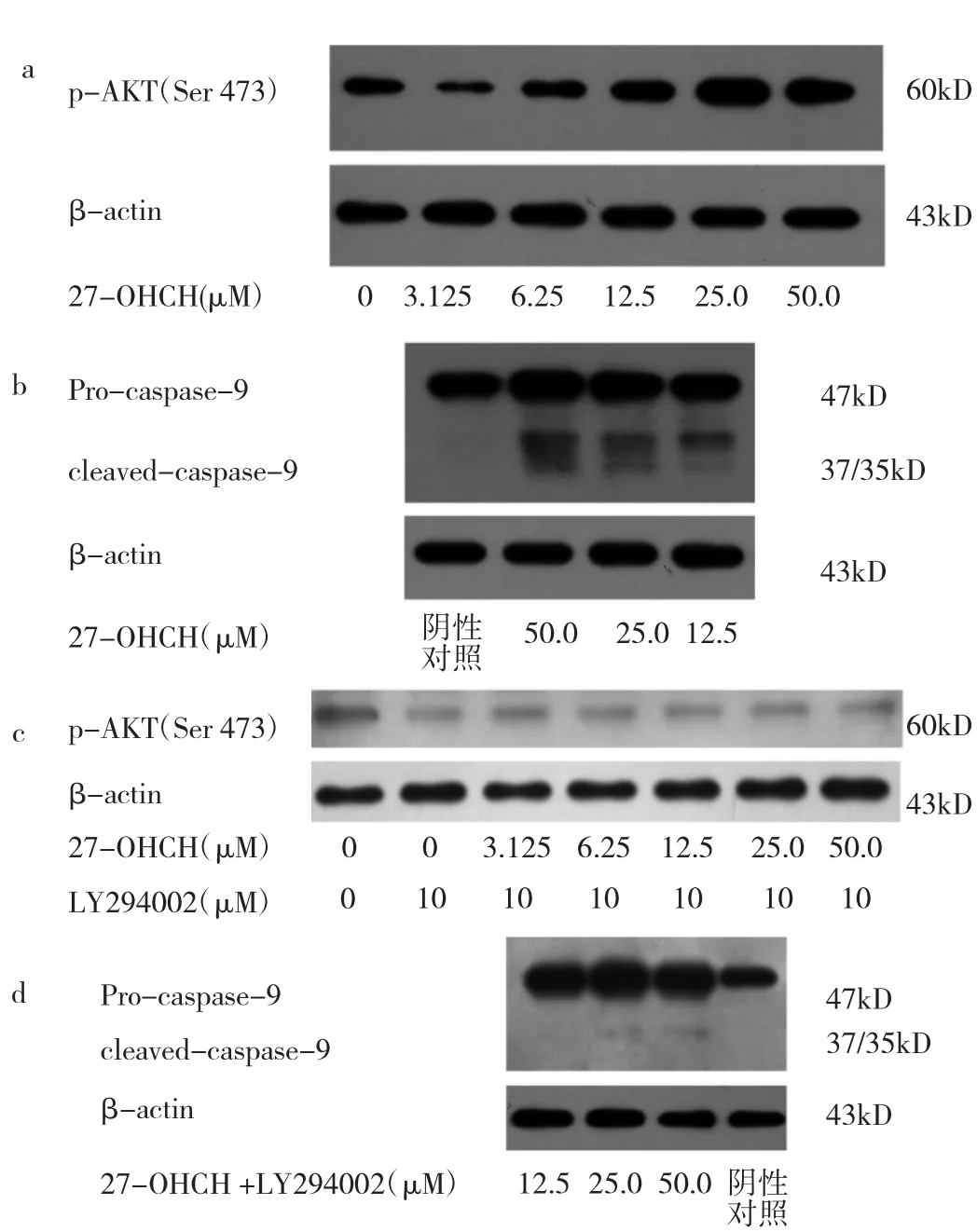
图3 27-OHCH对SH-SY5Y细胞内p-AKT、cleaved-caspase-9蛋白表达的电泳图

图4 不同浓度27-OHCH处理组SH-SY5Y细胞内p-AKT(Ser 473)表达水平(与阴性对照组比较,*P<0.05)
2.4 AKT抑制剂逆转27-OHCH细胞凋亡诱导的作用给药48h,12.5、25.0μM 27-OHCH处理组均能引起SHSY5Y细胞凋亡效应,细胞凋亡率分别为(24.04±0.83)%和(42.95±3.89)%,均高于无水乙醇溶剂对照组的(9.44±0.32)%(均 P<0.05)。AKT 抑制剂预作用 2h能逆转细胞凋亡效应,LY294002(10μM)+27-OHCH(12.5μM)组细胞凋亡率为(16.03±0.39)%,明显低于 12.5μM 27-OHCH 处理组(P<0.05);LY294002(10μM)+27-OHCH(25.0μM)组细胞凋亡率为(22.77±1.83)%,明显高于无水乙醇+DMSO 溶剂对照组的(11.05±0.61)%(P<0.05),但明显低于 25.0μM 27-OHCH 处理组(P<0.05),见图5。提示AKT抑制剂能逆转27-OHCH对SH-SY5Y细胞凋亡的诱导作用。

图5 Annexin V-PE/7-AAD双染流式细胞仪检测细胞凋亡情况
3 讨论
27-OHCH是外周细胞内胆固醇侧链被氧化的主要羟固醇产物之一,可通过血脑屏障入脑。研究发现SPG5A患者脑脊液中的27-OHCH浓度明显升高,经无胆固醇饮食或长期鹅去氧胆治疗,可能降低神经甾体的浓度,从而改善或稳定SPG5A患者症状[5,14]。相关研究发现,阿尔茨海默病(AD)患者大脑27-OHCH浓度较正常对照组急剧升高[15]。血浆胆固醇水平升高能使羟固醇入脑增多,影响神经细胞的正常结构及功能,进而引起β-淀粉样蛋白增多,进一步影响AD的发生、发展[16-17]。可见,27-OHCH浓度异常与中枢系统神经退行性疾病可能有关[3-4]。Prasanthi等[10]发现27-OHCH作用于SH-SY5Y细胞后,该细胞表达增强,与AD发病机制相关蛋白如β-淀粉样蛋白、磷酸化Tau蛋白水平亦明显升高。此外,研究表明27-OHCH作用于SH-SY5Y细胞后,α-突触核蛋白水平明显升高,从而引起ROS蓄积、炎症损伤、细胞凋亡[11-13]。本研究结果发现,27-OHCH能诱导 SH-SY5Y 细胞凋亡,给药 24h,12.5、25.0、50.0μM 27-OHCH处理组细胞存活率均明显降低;给药48h,各药物浓度均可导致SH-SY5Y细胞存活率降低。荧光显微镜下细胞形态学观察与Annexin V-PE/7-AAD双染流式细胞仪检测发现,12.5、25.0μM 27-OHCH处理组能诱导SH-SY5Y细胞凋亡,使细胞数量减少。目前尚无研究涉及27-OHCH的调控机制,因此,笔者就27-OHCH诱导SH-SY5Y细胞毒效应的信号通路作一研究。
PI3K/AKT信号通路是细胞生存的重要信号通路之一,它在细胞增殖、分化及死亡等方面起着重要作用。AKT是PI3K下游的效应分子,PI3K结合AKT的PH结构域能使AKT从细胞质向细胞膜转位,并改变其构象,使得AKT Thr 308或Ser 473位点发生磷酸化,从抑制状态变为激活状态[12]。中度或不持续的AKT活化能抑制细胞凋亡,通过各种下游效应分子促进细胞生长和血管生成[18-19]。然而,AKT的过度激活会引发细胞衰老和凋亡,主要机制是通过增加胞内ROS产量,抑制FoxO转录因子并下调其下游抗氧化酶MnSOD、过氧化氢酶等表达[8]。Nogueira等[20]发现细胞AKT的活化程度越高,对ROS诱导的凋亡效应越灵敏。更有以此为基础,通过雷帕霉素过度激活癌细胞AKT活化水平,达到消除肿瘤细胞的目的[21]。本研究发现浓度递增的27-OHCH(3.125~50.0μM)作用于 SH-SY5Y 细胞,随着细胞内AKT活化水平的增加,细胞凋亡程度明显增强,推测27-OHCH诱导的细胞凋亡效应与AKT过度活化相关。此外,显微镜下观察、Western blot和流式细胞仪检测结果均表明AKT通路抑制剂LY294002能逆转27-OHCH诱导的SH-SY5Y细胞凋亡。
综上所述,27-OHCH通过PI3K/AKT信号通路诱导细胞毒效应。本研究对该调控通路的探讨,为最终揭开27-OHCH相关神经退行性疾病病因、寻找有效的临床治疗方法及靶点提供了新方向。
