托伐普坦治疗肝硬化伴低钠血症或腹水的Meta分析
2018-09-28张翔云代大顺焦伟杰孙英伟
张翔云,赵 旭,代大顺,焦伟杰,孙英伟
0 引言
肝硬化是一种以肝组织弥漫性纤维化、假小叶和再生结节形成为特征的慢性肝病,是一种不可逆的肝脏组织结构改变,是各种慢性肝病发展的晚期阶段[1]。腹水是肝硬化最常见的并发症,常伴有低钠血症[2]。腹水形成的机制复杂,尚不明确,主要认为是肝硬化导致门脉高压、低蛋白血症及血管扩张剂的产生,促使动脉扩张、循环障碍,进而激活肾素-血管紧张素-醛固酮系统及交感神经系统,导致水钠潴留[3]。肝硬化伴低钠血症或腹水的传统治疗以限液限钠、反复利尿、腹腔穿刺等为主,但因疗效较慢、耐受性较差、加重肾功损害及循环功能障碍等缺点,应用受限[3-4]。托伐普坦是一种血管加压素V2受体拮抗剂,通过干扰抗利尿激素在肾脏的作用,在不影响电解质排泄的情况下,抑制集合管内水分的重吸收,可提高患者的血钠,减轻腹水,增加尿量等[5]。因此,托伐普坦在药理机制上是治疗肝硬化伴低钠血症或腹水的理想药物[6]。但目前研究者对托伐普坦存在2种截然相反的观点,一种认为托伐普坦在肝硬化腹水患者的治疗中,尤其是对常规利尿剂反应不足的难治性腹水患者疗效肯定且安全[7];另一种认为托伐普坦在肝硬化低钠血症及腹水患者中收益较小,且不降低死亡率、并发症发生率,不支持常规应用[8]。因此,托伐普坦能否改善肝硬化伴低钠血症或腹水患者的临床症状及预后存在一定的不确定性和争议。在没有大样本、高质量循证医学证据支持的情况下,本Meta分析旨在定量地系统评价托伐普坦对肝硬化伴低钠血症及腹水患者的疗效和安全性,以期对临床提出合理的用药建议。
1 资料与方法
1.1 纳入与排除标准
1.1.1 研究类型 已公开发表的关于托伐普坦治疗肝硬化伴低钠血症或腹水的随机对照试验(Randomized controlled trial,RCT)。
1.1.2 研究对象 明确诊断为肝硬化伴低钠血症(血钠浓度低于135 mmol/L)或腹水患者,排除心力衰竭、癌症、抗利尿激素分泌异常综合征等疾病引起的低钠血症或腹水,年龄、性别、种族、教育程度等无限制。
1.1.3 干预措施 试验组:常规治疗+托伐普坦;对照组:常规治疗+安慰剂或常规治疗,两组剂量、疗程不限。
1.1.4 结局指标 ①血钠浓度变化;②24 h尿量变化;③体重变化;④腹围的变化;⑤不良反应发生率;⑥口干口渴发生率;⑦血钾变化;⑧血肌酐变化;⑨血丙氨酸氨基转移酶(ALT)变化。
1.1.5 排除标准 ①剔除无结局指标数据、数据错误及不完整的研究;②临床试验的摘要报道;③剔除重复研究;④剔除体外抗菌研究、动物实验、药动学研究、药理学研究、综述、回顾性分析等非RCT等。
1.2 检索策略 以“托伐普坦、肝硬化、低钠血症、腹水”等为中文检索词,以“tolvaptan,liver cirrhosis,hyponatremia,ascites”等为英文检索词,采用题目、摘要、关键词和全文结合的方法,检索中国知网(CNKI)、万方、维普(VIP)、PubMed、Cochrane Library、Web of Science、Elsevier等数据库;检索时间:建库-2017年5月;检索语言:中文和英文。
1.3 文献筛选与资料提取 由2名评价者独立阅读文题和摘要,排除明显不符合纳入标准的研究后,进一步阅读全文,确定是否符合纳入标准,并提取资料及交叉核对纳入文献。如有分歧,由第3位研究者介入讨论解决分歧。制定数据提取表,进行数据提取。提取资料包括:①试验的基本情况:第一作者、发表年份、年龄、样本量、干预措施、疗程等。②结局指标相关数据。若某一连续变量的均值及标准差无法直接获得时,可根据同一结局指标下的其他研究计算相关系数,然后根据相关系数进行推导计算均值和标准差[9]。③纳入研究质量信息,包括随机方法、分配隐藏、盲法、偏倚等。
1.4 方法学质量评价 采用改良版的Jadad量表[10]对纳入的文献进行质量评价,主要对随机序列的产生、随机化隐藏、盲法、退出与失访情况进行评分。1~3分属于低质量研究,4~7分属于高质量研究。
1.5 统计分析 采用Review Manager 5.3和Stata 12.0软件进行Meta分析。以相对危险度(Relative risk,RR)、标准均数差(Standardized mean difference,SMD)及95%可信区间(Confidence interval,CI)为合并效应量指标。对纳入研究进行异质性检验,若不存在或者异质性较小(P>0.10,I2≤50%),采用固定效应模型计算合并效应量;若异质性较大(P≤0.10,I2>50%),首先以敏感性分析方法,依次剔除1项研究,将剩余的其他研究重新进行Meta分析,探寻对合并效应量影响较大的研究。若敏感性分析后,总合并效应量的结果稳定,则进行亚组分析。如果经过处理后异质性仍无法消除,则采用随机效应模型进行Meta分析[11]。最终,剔除Jadad评分≤3分的研究后,再次合并分析来检测合并效应值的稳定性。另外,发表偏倚检验采用漏斗图及Begg′s检验,漏斗图不对称或Begg′s检验的P<0.05认为有发表偏倚[12]。
2 结果
2.1 文献基本特征及质量评价 初检相关文献145篇,除去重复的57篇,阅读文献标题及摘要88篇,排除动物实验、病例报道、综述等文献61篇,需要全文阅读的文献27篇,进一步阅读全文,排除非随机对照试验、无法获得有效数据、样本量过小等研究文献12篇,最终纳入全文15篇[13-27](图1),包括12篇中文文献[13-24]和3篇英文文献[25-27],共1 267例患者,其中2项研究关注老年患者[18,21],3项研究限制对照组液体入量为1~1.5 L[15,17,24],1项研究对照组液体限量由研究者裁量[25]。所有纳入研究应用改良版的Jadad量表评估质量,其中4项研究随机方法明确,分别为随机数字法[16,18,23]、计算机产生随机序列[25];2项研究做到了分配隐藏[26-27];4项研究详细记录了退出与失访情况[13,25-27]。纳入文献的详细基本特征及质量评价信息见表1。
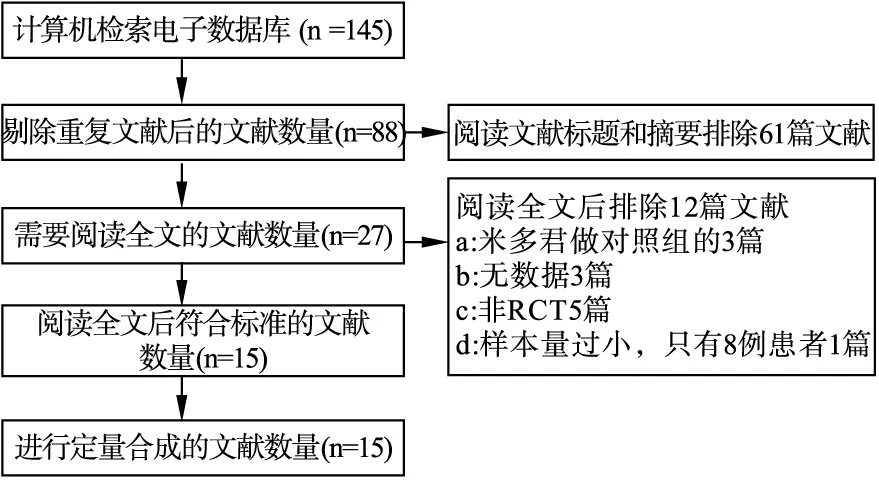
图1 文献筛选流程图及结果
2.2 Meta分析结果
2.2.1 血钠浓度、24 h尿量、体重及腹围的变化 共纳入13项比较托伐普坦和对照组之间的血钠浓度变化的研究,共1 059例患者[15-27]。纳入各
研究之间有异质性(P=0.002,I2=61%)。敏感性分析后,合并效应值稳定,以低钠血症及腹水分组进行亚组分析(表2),相比对照组,托伐普坦可提高低钠血症组(SMD 1.34,95%CI1.11~1.56,I2=52.3%,11项研究[15-25])和腹水组(SMD 0.98,95%CI0.45~0.52,I2=60.5%,2项研究[26-27])的血钠浓度,但两组内仍有异质性,遂最终以随机效应模型进行Meta分析,托伐普坦可提高肝硬化伴低钠血症或腹水患者的血钠浓度(SMD 1.28,95%CI1.06~1.50,图2A)。纳入研究间无发表偏倚(Begg′s检验PBegg=0.855)。
共纳入9项比较托伐普坦和对照组之间的24 h尿量变化的研究,共654例患者[15,17-24]。纳入各研究之间有异质性(P<0.001,I2=95%)。敏感性分析后,合并效应值稳定。由于纳入患者均为肝硬化伴低钠血症患者,遂未再分亚组,以随机效应模型进行Meta分析,托伐普坦可增加肝硬化伴低钠血症或腹水患者的24 h尿量(SMD 3.19,95%CI2.20~4.19,图2B)。纳入研究间无发表偏倚(Begg′s检验PBegg=0.348)。
共纳入8项比较托伐普坦和对照组之间的体重变化的研究,共591例患者[17-21,24,26,27]。纳入各研究之间无异质性(P=0.26,I2=21%),以固定效应模型进行Meta分析,托伐普坦可减轻肝硬化伴低钠血症或腹水患者的体重(SMD -0.58,95%CI-0.75~-0.42,图2C)。纳入研究间无发表偏倚(Begg′s检验PBegg=0.174)。
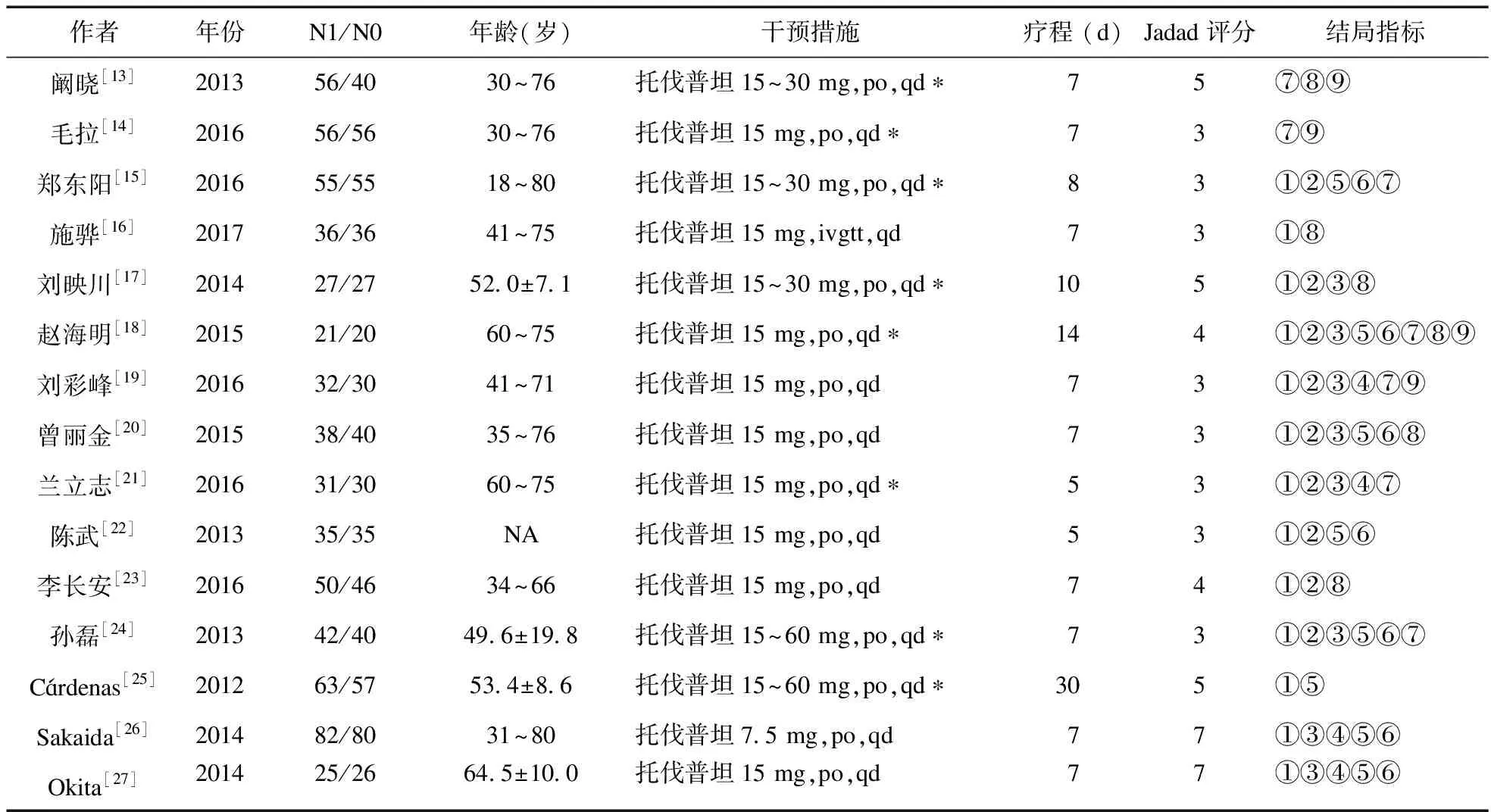
表1 纳入文献基本特征及治疗评价
注:N1:托伐普坦组例数,N0:对照组例数;NA:无数据;*随血钠浓度变化调整托伐普坦的剂量;结局指标:①血钠浓度变化,②24 h尿量变化,③体重变化,④腹围变化,⑤不良反应发生率,⑥口干口渴发生率,⑦血钾变化,⑧血肌酐变化,⑨ALT变化
共纳入4项比较托伐普坦和对照组之间的腹围变化的研究,共353例患者[19,21,26-27]。纳入各研究之间无异质性(P=0.20,I2=36%),以固定效应模型进行Meta分析,托伐普坦可缩小肝硬化伴低钠血症或腹水患者的腹围(SMD -0.78,95%CI-1.00~-0.56,图2D)。纳入研究间无发表偏倚(Begg′s检验PBegg=1.000)。
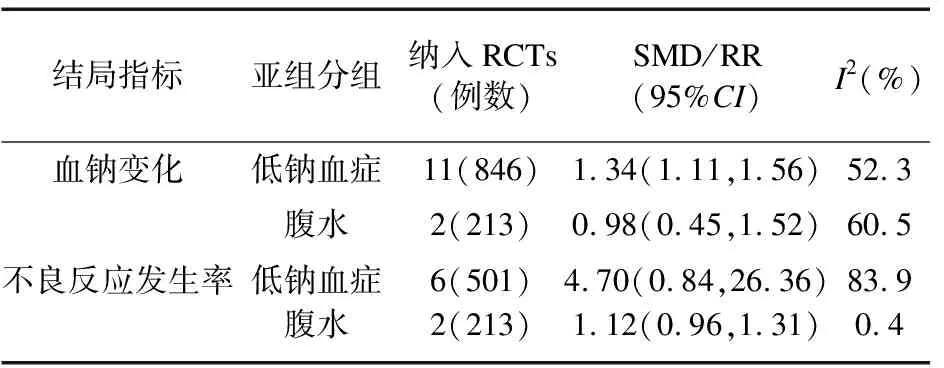
表2 托伐普坦治疗肝硬化伴低钠血症或腹水患者的亚组分析
2.2.2 不良反应发生率、口干口渴发生率 共纳入8项比较托伐普坦和对照组之间的不良反应发生率的研究,共714例患者[15,18,20,22,24-27]。纳入各研究之间有异质性(P<0.001,I2=78%)。敏感性分析后,合并效应值稳定,以低钠血症及腹水分组进行亚组分析(表2),相比对照组,低钠血症组(RR=4.70,95%CI0.84~26.36,I2=83.9%,6项研究[15,18,20,22,24-25])和腹水组(RR=1.12,95%CI0.96~1.31,I2=0.4%,2项研究[26-27])的不良反应发生率与对照组间差异无统计学意义,但低钠血症组内仍有异质性,遂最终以随机效应模型进行Meta分析,托伐普坦并不增加肝硬化伴低钠血症或腹水患者的不良反应发生率(RR=1.24,95%CI0.85~1.80,图3A)。纳入研究间无发表偏倚(Begg′s检验PBegg=0.108)。
共纳入7项比较托伐普坦和对照组之间的口干口渴发生率的研究,共594例患者[15,18,20,22,24,26-27]。纳入各研究之间无异质性(P=0.84,I2=0%),以固定模型进行Meta分析,托伐普坦的口干口渴发生率高于对照组16.85倍(RR=16.85,95%CI6.57~43.19,图3B)。纳入研究间无发表偏倚(Begg′s检验PBegg=0.764)。
2.2.3 血钾、血肌酐及血ALT变化 共纳入7项比较托伐普坦和对照组之间的血钾变化的研究,共564例患者[13-15,18-19,21,24]。纳入各研究之间有异质性(P<0.001,I2=86%)。敏感性分析后,合并效应值稳定。由于纳入患者全为肝硬化伴低钠血症患者,遂未再分亚组,以随机效应模型进行Meta分析,与对照组相比,托伐普坦并不影响肝硬化伴低钠血症或腹水患者的血钾(SMD -0.36,95%CI-0.10~0.82,图4A)。纳入研究间无发表偏倚(Begg′s检验PBegg=0.548)。
共纳入6项比较托伐普坦和对照组之间血肌酐变化的研究,共437例患者[13,16-18,20,23]。纳入各研究之间无异质性(P=0.95,I2=0%)。以固定效应模型进行Meta分析,与对照组相比,托伐普坦并不影响肝硬化伴低钠血症或腹水患者的血肌酐(SMD -0.09,95%CI-0.28~0.10,图4B)。纳入研究间无发表偏倚(Begg′s检验PBegg=0.707)。 共纳入4项比较托伐普坦和对照组之间血ALT变化的研究,共311例患者[13-14,18-19]。纳入各研究之间有异质性(P<0.001,I2=82%)。敏感性分析后,合并效应值稳定。由于纳入患者全为肝硬化伴低钠血症患者,遂未再分亚组,以随机效应模型进行Meta分析,与对照组相比,托伐普坦并不影响肝硬化伴低钠血症或腹水患者的血ALT(SMD -0.34,95%CI-0.90~0.22,图4C)。纳入研究间无发表偏倚(Begg′s检验PBegg=0.734)。
2.3 敏感性分析结果 为进一步探求Meta分析结果的稳定性,遂将各指标下Jadad评分≤3分的研究剔除后重新行Meta分析(表3),结果表明:剔除前后,除不良反应发生率的结果发生质变(RR=1.12,95%CI1.01~1.25),即托伐普坦组不良反应发生率高于对照组外,其余结局指标的合并效应值均稳定可靠。剔除Jadad评分≤3分的研究后,不良反应发生率研究间无明显异质性(I2从78%降至12%),因此结果更为可靠。
3 讨论
在我国甚至亚洲,由于乙型肝炎的人口基数大,肝硬化已成为一项严重而广泛的健康问题[28]。腹水和低钠血症是肝硬化患者的常见并发症,其1年、5年死亡率分别约为15%、44%[29]。因此,纠正低钠血症、预防腹水对于肝硬化患者十分重要。传统的治疗方式,包括限制液体摄入(<1 L/d)、传统利尿剂(呋塞米、螺内酯等)、腹腔穿刺等。限制液体摄入对于肝炎患者往往难以耐受,且不足以引起腹水减少[30]。
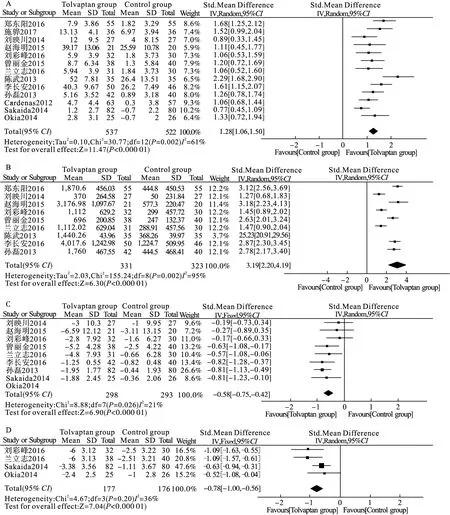
图2 托伐普坦对肝硬化伴低钠血症或腹水患者血钠(A)、24 h尿量(B)、体重(C)及腹围(D)方面的疗效分析
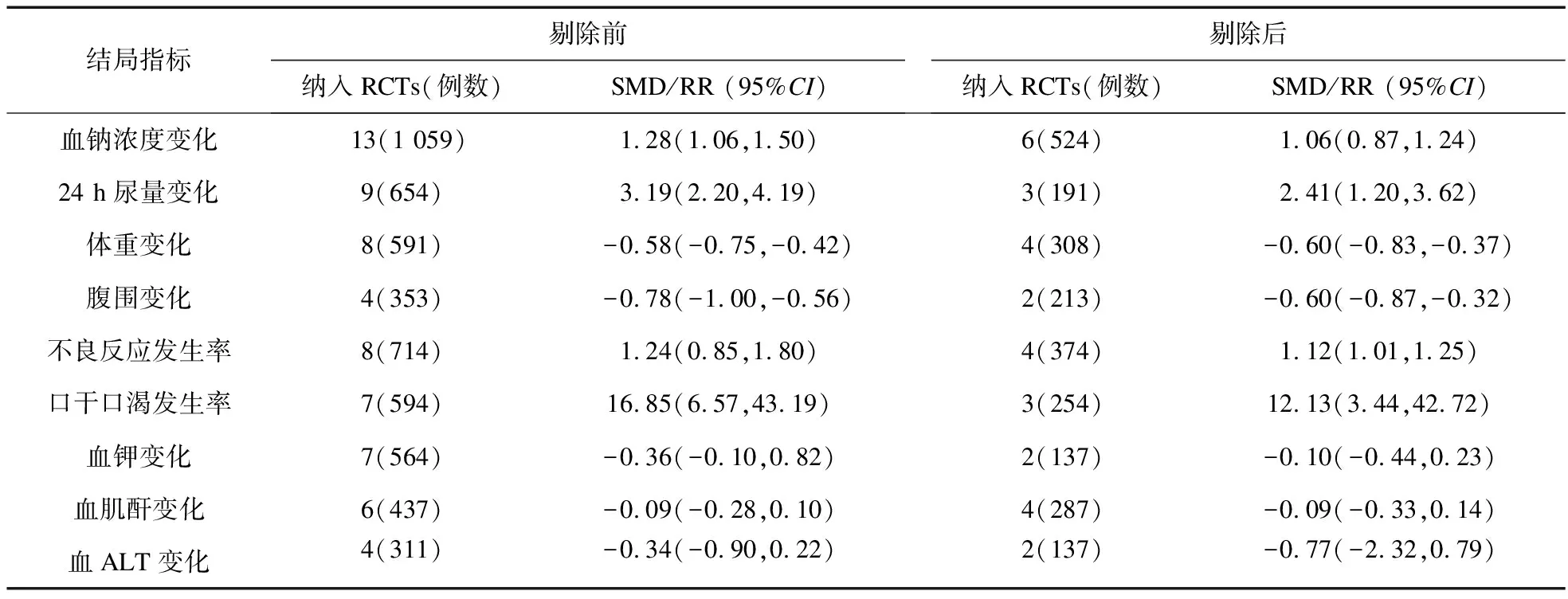
结局指标剔除前纳入RCTs(例数)SMD/RR (95%CI)剔除后纳入RCTs(例数)SMD/RR (95%CI)血钠浓度变化13(1 059)1.28(1.06,1.50)6(524)1.06(0.87,1.24)24 h尿量变化9(654)3.19(2.20,4.19)3(191)2.41(1.20,3.62)体重变化8(591)-0.58(-0.75,-0.42)4(308)-0.60(-0.83,-0.37)腹围变化4(353)-0.78(-1.00,-0.56)2(213)-0.60(-0.87,-0.32)不良反应发生率8(714)1.24(0.85,1.80)4(374)1.12(1.01,1.25)口干口渴发生率7(594)16.85(6.57,43.19)3(254)12.13(3.44,42.72)血钾变化7(564)-0.36(-0.10,0.82)2(137)-0.10(-0.44,0.23)血肌酐变化6(437)-0.09(-0.28,0.10)4(287)-0.09(-0.33,0.14)血ALT变化4(311)-0.34(-0.90,0.22)2(137)-0.77(-2.32,0.79)
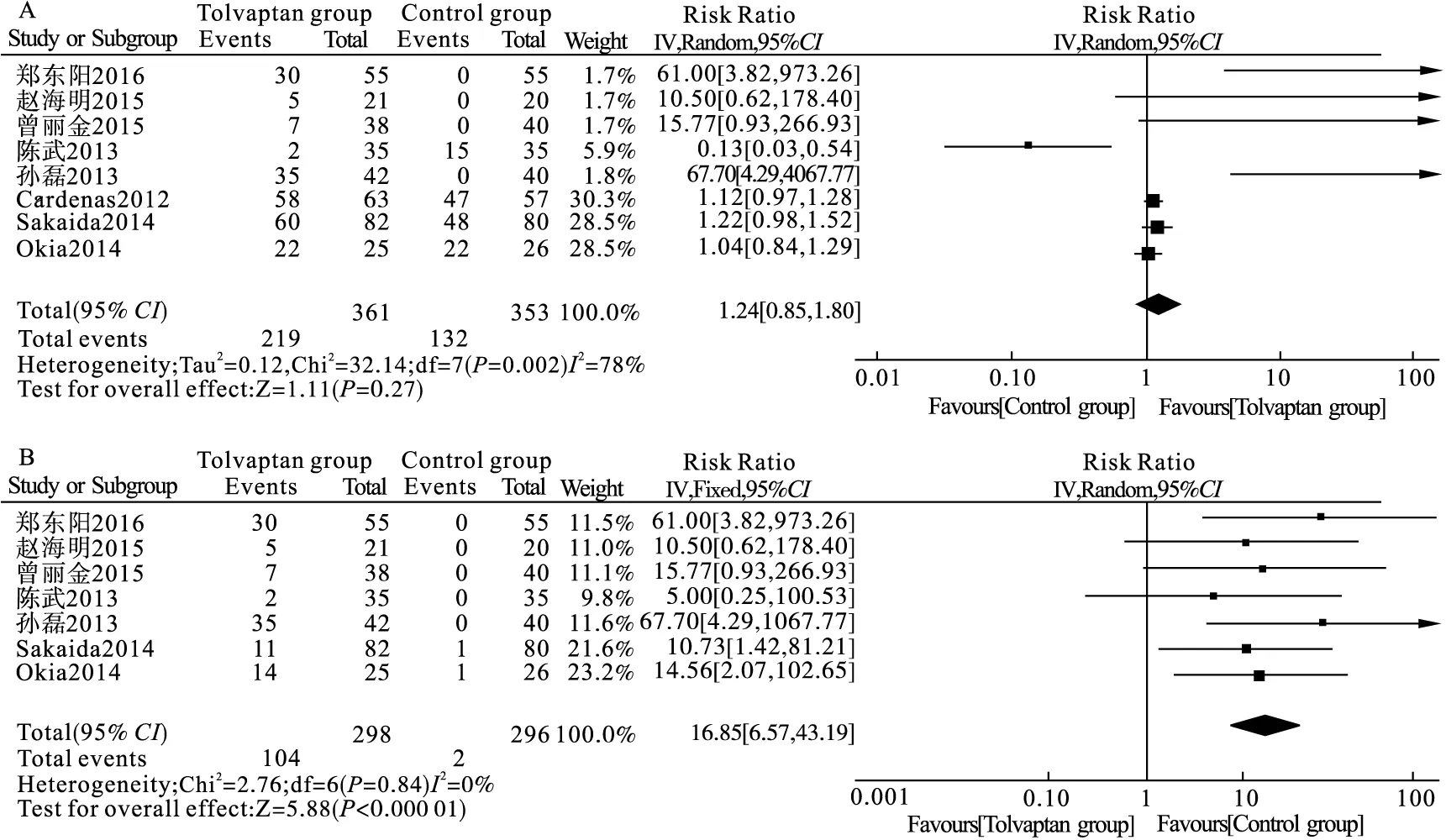
图3 托伐普坦对肝硬化伴低钠血症或腹水患者不良反应发生率(A)、口干口渴发生率(B)方面的安全性分析
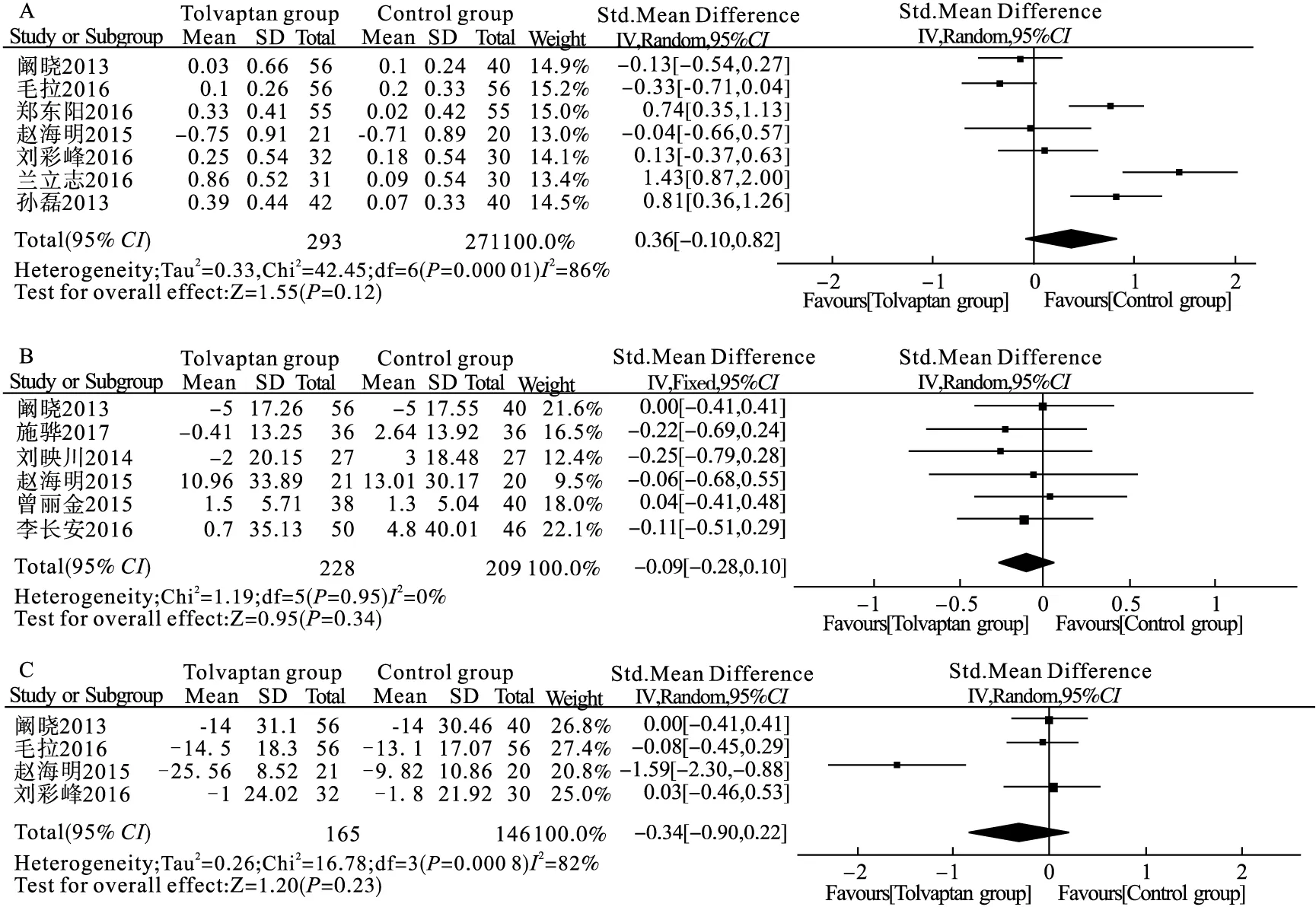
图4 托伐普坦对肝硬化伴低钠血症或腹水患者血钾(A)、血肌酐(B)及血ALT(C)方面的安全性分析
传统利尿剂可引发电解质紊乱、肾功能恶化、肝性脑病等。腹腔穿刺可以有效减少腹水,但不输注白蛋白时,可诱导循环障碍[31]。托伐普坦在不影响溶质排泄的同时,产生低渗性利尿作用,有助于肝硬化伴低钠血症或腹水患者恢复血钠,减少腹水及腹腔穿刺次数,且不增加不良反应,是治疗肝硬化伴低钠血症或腹水的新希望,但托伐普坦的临床疗效及安全性目前尚不明确,FDA因其可能造成严重肝损伤已声明限制托伐普坦>30 d的长期应用[32]。本文通过系统评价的方法,定量评价托伐普坦的疗效及安全性,托伐普坦可显著提高肝硬化伴低钠血症或腹水患者的血钠浓度、增加24 h尿量、减轻体重、缩小腹围,且不增加除口干口渴外的其他不良反应。
本Meta分析显示,无论是肝硬化合并低钠血症还是腹水,托伐普坦均可提高患者的血钠浓度(SMD 1.28,95%CI1.06~1.50)。但若血钠过快纠正(24 h内>12 mmol/L),特别是肝硬化伴血钠<125 mmol/L的患者,可导致渗透性脱髓鞘综合征,使患者构音障碍、吞咽困难、嗜睡、四肢痉挛、癫痫发作,甚至昏迷、死亡[33-34]。而本研究纳入的RCTs中,患者的血钠浓度升高在5.10~8.81 mmol/L,且并无渗透性脱髓鞘综合征的报道。根据目前已发表的中国患者托伐普坦的用药经验,建议可以7.5 mg/d起始,根据血钠浓度逐渐增加剂量至60 mg/d。另外,在血钠浓度变化、24 h尿量变化指标下,纳入的研究存在明显的异质性,本研究以低钠血症及腹水分亚组以探测异质性来源,血钠变化指标下亚组分析后可解释部分异质性的来源,但仍有残余异质性未能解释,不排除与研究的样本量、患者年龄、托伐普坦剂量、疗程等因素有关。24 h尿量变化指标下纳入的患者全部为低钠血症患者,因此未再进行亚组分析,直接选择随机效应模型进行合并分析,可能扩大了其合并效应值的可信区间的范围。此外,托伐普坦可有效减轻肝硬化伴低钠血症或腹水患者的体重,缩小腹围,纳入研究无异质性及发表偏倚,但这些实验室指标能否转变为临床收益仍然存在疑问。
一般情况下,托伐普坦的耐受性较好。本Meta分析中,托伐普坦不增加除口干口渴以外的不良反应。本研究结果表明,托伐普坦口干口渴的发生率高于对照组16.85倍。理论上,口干口渴是托伐普坦大量利尿后血浆渗透压升高自然引起的生理反应,通常可以忍受,或可通过减少托伐普坦的剂量、增加饮水来减轻。除口干口渴外,托伐普坦对血钾、血肌酐、血ALT均无明显影响。Ogihara等[35]研究表明,托伐普坦可纠正袢利尿剂引起的电解质紊乱,尤其是低血钾,本研究中未发生此现象,可能与纳入研究存在异质性有关。Boyer等[33]报道,托伐普坦过度利尿可导致患者肾功能不全,而本研究显示,托伐普坦并不增加患者的肌酐水平。另外,Wong等[36]报道,Satavaptan(与托伐普坦作用类似的另一血管加压素V2受体拮抗剂)与普通利尿剂(呋塞米、螺内酯等)合用可减少自身剂量,增加利尿作用,更好地控制腹水且不增加肾功损伤风险,因此,推测托伐普坦与常规利尿剂合用可能有同样的协同作用。Hanatani等[37]研究证实,对于充血性心力衰竭患者,托伐普坦联合半量袢利尿剂,与联合全量袢利尿剂相比,疗效相同,且肾功能损伤小,但是对于肝硬化伴低钠血症或腹水的患者,此方面的证据较少,需要进一步研究。此外,在肝损伤方面,FDA已经因致命的肝毒性限制了托伐普坦在肝硬化患者人群中的长期应用(<30 d),本Meta分析定量结果表明,托伐普坦并未显著增加患者的血ALT,因此在短期(7~14 d)应用托伐普坦是相对安全的。
本Meta分析限制研究人群为肝硬化伴低钠血症或腹水患者,增加样本量,结果认为,托伐普坦治疗肝硬化伴低钠血症或腹水安全有效,为临床提供了更多的循证依据,但仍然存在一定局限性。首先,纳入了部分未明确随机化、分配隐藏方法及退出失访情况的低质量研究。其次,在血钠浓度、24 h尿量、血钾及血肌酐变化和不良反应发生率指标下,纳入的研究间存在明显的异质性,虽然应用了敏感性分析、亚组分析的方法来探索异质性来源,但仍存在残余异质性。最后,肝硬化属于慢性进展的疾病,但本文纳入的研究没有关于托伐普坦的远期疗效及安全性数据。
综上所述,托伐普坦在治疗肝硬化伴低钠血症或腹水患者方面相对安全有效,但还仍需开展多中心、大样本、随机双盲对照试验,以获得更为严谨的临床证据。
