华蟾素增强氟尿嘧啶对食管癌TE-1细胞杀伤作用及机制研究
2018-09-28赵晓东刘学臣张立超
刘 博,戚 诚*,赵 爽,赵晓东,刘学臣,张立超,石 畅
0 引言
食管癌发病率在全球呈现上升趋势,在消化系统恶性肿瘤中,其死亡率较高。食管癌以发现晚为特点,5年生存率极低,大部分食管癌发现时均无手术机会[1]。目前,放化疗是药物治疗不能手术的食管癌的主要治疗方式[2],中药在恶性肿瘤中的应用已经取得了极大进展,尤其中药联合化疗药物的应用,可以达到提高治疗有效率、减少化疗药物剂量及毒副反应、延长患者生存期的目的[3-5]。华蟾素是近年应用的抗肿瘤药物之一,在肺癌及胃癌等恶性肿瘤中有应用[6],获得了肯定的效果,但目前其在食管癌中的作用及机制研究缺乏客观实验证据。本研究采用华蟾素联合氟尿嘧啶,观察食管癌离体细胞增殖、凋亡及细胞周期的变化,评价华蟾素对食管癌细胞的杀灭作用及对氟尿嘧啶化疗增效作用,并探讨其作用机制,为临床应用提供客观实验依据。
1 材料与方法
1.1 材料 人食管癌细胞株TE-1购自上海中科院细胞库,采用含10%胎牛血清、青霉素及链霉素的1640培养基,在37 ℃、5%CO2培养箱进行贴壁细胞培养。0.25%胰蛋白酶进行消化传代,取对数生长期的TE-1细胞进行实验,所有的实验均重复3次,以平均值进行统计。华蟾素注射液(CAS No.521-61-9)购自安徽华润金蟾药业股份有限公司,氟尿嘧啶注射液(CAS No. 51-21-8)购自上海旭东海普药业有限公司。ECL发光试剂盒、DAB显色试剂盒及BCA定量试剂盒均购自南京凯基生物公司。MTT试剂盒购自美国Biosharp公司;Annexin V-FITC/PI试剂盒购自美国Millpore公司;Bcl-2单克隆抗体、Bax单克隆抗体、Cleaved PARP多克隆抗体及Survivin多克隆抗体均购自美国Santa Cruz生物技术公司。实验细胞分为阴性对照组(Negative Control组)、华蟾素干预组(Cinobufotalin组)、华蟾素及氟尿嘧啶共同干预组(Cinobufotalin+5-FU组)及氟尿嘧啶组(5-FU组),Negative Control组给予DMSO干预作为空白对照,Cinobufotalin+5-FU组及5-FU组氟尿嘧啶浓度均为25 μmol/L。
1.2 方法
1.2.1 Western印迹 Cinobufotalin组以0、5、50、500 μmol/L浓度梯度华蟾素作用48 h后,依照细胞蛋白提取试剂盒规定步骤进行蛋白提取,10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳将蛋白进行分离并电转移至PVDF膜上。加入5%脱脂奶粉,在室温条件下进行90 min封闭后,分别加入Bcl-2、Bax、Cleaved PARP及Survivin一抗,进行孵育过夜后加入对应二抗,再孵育后进行化学发光法显色。应用Quantity One对灰度值进行定量分析。
1.2.2 流式细胞术检测TE-1凋亡及细胞周期 Cinobufotalin组、Cinobufotalin+5-FU组(50 μmol/L华蟾素干预24 h)、Negative Control组及5-FU组TE-1细胞培养48 h后转移至EP管,给予预冷及PBS洗涤后加入预冷70%乙醇,在4 ℃温度下固定24 h。1 000 r/min 离心10 min后弃上清。对每个样品均采用PBS重悬,加0.5% PI 40 μl、RNase A 20 μl(10 mg/ml),4 ℃下避光温浴35 min,上流式细胞仪进行细胞周期检测。另取培养48 h的各组细胞,依据Annexin V-FITC/PI试剂盒说明书规定步骤测定细胞凋亡,软件Cell Quest进行凋亡率分析,计算早期凋亡阳性的细胞百分比。
1.2.3 MTT法检测不同华蟾素浓度梯度及不同培养时间TE-1细胞存活率 各组细胞以6×104/ml数加入96孔板内培养6 h,细胞贴壁后Cinobufotalin组及Cinobufotalin+5-FU组加入0、5、10、15、20、25 μmol/L浓度梯度的华蟾素作用48 h,每个浓度均设3个复孔。48 h后在每孔内均加入5 mg/L的10% MTT液,在37 ℃温箱孵育4 h后弃上清,加入150 μl DMSO,震荡25 min后进行光密度值(OD值)测定,计算细胞存活率。另取细胞待贴壁后Cinobufotalin组及Cinobufotalin+5-FU组细胞加入50 μmol/L的华蟾素,分别在细胞培养24、48、72、96 h后行MTT检测,步骤同前,测定TE-1细胞在不同时点存活率。
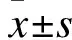
2 结果
2.1 华蟾素干预后凋亡相关蛋白的表达 Western blot检测0、5、50、500 μmol/L浓度梯度华蟾素干扰前后凋亡相关蛋白变化。随着Cinobufotalin浓度升高,Bcl-2、Survivin蛋白表达水平呈剂量依赖性下降,与0 μmol/L浓度对比,Bcl-2蛋白表达在5、50、500 μmol/L差异有统计学意义(t=6.922,P<0.01;t=7.736,P<0.01;t=11.075,P<0.01),Survivin蛋白表达在50、500 μmol/L差异有统计学意义(t=5.248,P<0.01;t=12.663,P<0.01);随着Cinobufotalin浓度升高,Cleaved PARP、Bax蛋白表达呈剂量依赖性上升,与0 μmol/L 浓度对比,Cleaved PARP在5、50、500 μmol/L 差异有统计学意义(t=4.179,P<0.05;t=8.631,P<0.01;t=9.254,P<0.01),Bax蛋白在50、500 μmol/L差异有统计学意义(t=2.169,P<0.05;t=7.428,P<0.01),见图1。

图1 华蟾素干预后凋亡相关蛋白表达
2.2 华蟾素干预后TE-1细胞凋亡变化 流式细胞仪检测显示,Negative Control组、Cinobufotalin组、Cinobufotalin+5-FU组、5-FU组的TE-1细胞凋亡率分别为21.32%、39.63%、59.52%、45.21%,Cinobufotalin组的TE-1细胞凋亡率高于Negative组,差异有统计学意义(t=2.236,P<0.05);Cinobufotalin+5-FU组的TE-1细胞凋亡率高于Negative Control组、Cinobufotalin组、5-FU组,差异有统计学意义(t=11.809,P<0.01;t=4.132,P<0.05;t=3.671,P<0.05)。
2.3 华蟾素干预后TE-1细胞周期变化 与Negative Control组对比,Cinobufotalin组TE-1细胞培养48 h后细胞周期停留在G1期及G2期的比例减少,在S期的比例升高,差异有统计学意义(t=2.504,P<0.05;t=2.842,P<0.05;t=3.493,P<0.05);与Negative Control组对比,Cinobufotalin+5-FU组TE-1细胞培养48 h后细胞周期停留在G1期及G2期的比例减少,S期的比例升高,差异有统计学意义(t=9.024,P<0.01;t=8.373,P<0.01;t=7.376,P<0.01);与Cinobufotalin组对比,Cinobufotalin+5-FU组TE-1细胞培养48 h后细胞周期停留在G1期及G2期的比例减少,S期的比例升高,差异有统计学意义(t=4.436,P<0.05;t=3.226,P<0.05;t=3.503,P<0.05);与5-FU组对比,Cinobufotalin+5-FU组TE-1细胞培养48 h后细胞周期停留在G1期及G2期的比例减少,S期的比例升高,差异有统计学意义(t=2.163,P<0.05;t=2.965,P<0.05;t=3.672,P<0.05),见表1。
表1 流式细胞检测细胞周期(%)
2.4 华蟾素干预后不同培养时间TE-1细胞存活率 MTT显示,给予 Cinobufotalin 50 μmol/L干预条件下TE-1细胞培养24、48、72、96 h后,细胞存活率呈现时间依赖性下降趋势,与Negative Control组对比,Cinobufotalin组TE-1细胞培养48、72、96 h后存活率低,差异有统计学意义(t=3.029,P<0.05;t=3.176,P<0.05;t=3.992,P<0.05);与Negative Control组对比,Cinobufotalin+5-FU组TE-1细胞培养48、72、96 h后存活率降低,差异有统计学意义(t=11.527,P<0.01;t=12.459,P<0.01;t=13.579,P<0.01);与Cinobufotalin组对比,Cinobufotalin+5-FU组TE-1细胞培养48、72、96 h后存活率低,差异有统计学意义(t=8.236,P<0.01;t=7.932,P<0.01;t=9.19,P<0.01);与5-FU组对比,Cinobufotalin+5-FU组TE-1细胞培养48、72、96 h后存活率低,差异有统计学意义(t=7.164,P<0.01;t=6.984,P<0.01;t=9.052,P<0.01),见图2。
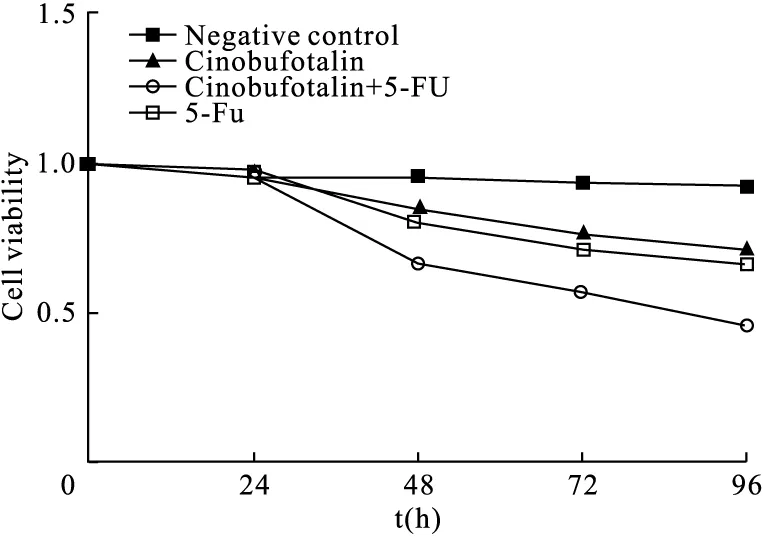
图2 MTT检测不同培养时间华蟾素处理后细胞
2.5 不同浓度华蟾素干预后TE-1细胞存活率 不同浓度梯度(0、5、10、15、20、25 μmol/L)的华蟾素作用48 h后,Cinobufotalin组及Cinobufotalin+5-FU组TE-1细胞存活率呈现剂量依赖性下降,与0 μmol/L浓度对比,Cinobufotalin组在20 μmol/L及25 μmol/L差异有统计学意义(t=2.217,P<0.05;t=3.021,P<0.05),Cinobufotalin+5-FU组在15、20、25 μmol/L差异有统计学意义(t=3.187,P<0.05;t=5.853,P<0.01;t=7.293,P<0.01);与Cinobufotalin组相比,Cinobufotalin+5-FU组TE-1细胞存活率在20、25 μmol/L较低,差异有统计学意义(t=2.473,P<0.05;t=3.578,P<0.05),见图3。
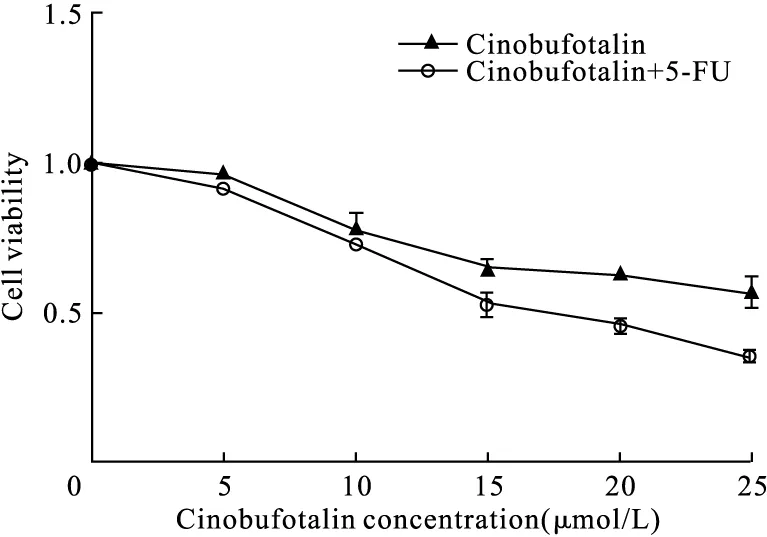
图3 MTT检测不同浓度华蟾素处理后细胞存活率(培养48 h)
3 讨论
大部分食管癌患者在确诊时已经失去手术时机,以手术为基础的综合治疗在2/3的患者中不能实现[7],放疗及化疗是目前新辅助治疗或综合治疗的主要内容,尤其对于晚期食管癌,放疗及化疗是减轻患者症状、延长患者生存期的主要治疗方式[8]。化疗药不良反应大,一部分食管癌患者对化疗敏感性差,且易发生耐药。中药治疗在食管癌方面是研究的主要方向,并取得了一定进展[9]。华蟾素提取自干蟾皮,是其中的脂溶性成分。多项研究表明,在中药中,华蟾素具有较强的抗癌疗效,用于肺癌、胃癌、子宫内膜癌及肝癌等恶性肿瘤的治疗,但目前对其抗癌机制的研究较少[10-12]。
本研究显示,华蟾素干扰后,Bcl-2/Bax通路中,Bcl-2及Survivin蛋白表达水平呈剂量依赖性下降,二者表达受到抑制,Cleaved PARP及Bax蛋白表达呈剂量依赖性上升,二者表达受到激活,表明华蟾素可能通过Bcl-2/Bax信号通路发挥对恶性肿瘤细胞的作用。Bcl-2/Bax信号通路是食管癌细胞活性过程中凋亡相关通路,Bcl-2/Bax比例对食管癌细胞凋亡具有重要影响,也是食管癌预后的标志物之一[13],二者比例降低会导致肿瘤细胞凋亡增加,细胞存活率降低,细胞增殖活性降低。Survivin及Cleaved PARP是该信号通路的下游蛋白,直接影响肿瘤细胞的增殖及凋亡等恶性行为,Survivin是重要的促癌基因,PARP裂解为Cleaved PARP会抑制肿瘤细胞的增殖活性,促进其凋亡,是重要的抑癌基因[14]。进一步细胞实验显示,华蟾素干扰后TE-1细胞凋亡率升高,而华蟾素联合氟尿嘧啶TE-1细胞凋亡率进一步增高,明显高于华蟾素或氟尿嘧啶单药应用,细胞周期研究也显示,华蟾素及氟尿嘧啶联合应用后TE-1细胞留在G1期及G2期的比例减少,S期的比例升高,均强于二者单药应用。MTT显示,给予华蟾素干预后,TE-1细胞存活率呈现时间依赖性下降趋势,联合氟尿嘧啶后,细胞存活率呈现进一步下降趋势,均较单药应用下降明显。随着华蟾素浓度升高,联合氟尿嘧啶后细胞存活率也呈现明显下降趋势,呈现浓度依赖性。病理标本研究显示,华蟾素处理后,癌细胞表现为核破碎,组织坏死及变性,对肿瘤细胞具有杀灭作用。氟尿嘧啶是消化系统肿瘤最常用的化疗药物,在食管癌中也是化疗的首选药物之一,但其抗肿瘤作用有限,不良反应也较为常见,联合中药应用可以达到化疗增效、降低毒副作用的目的。本研究显示,华蟾素联合氟尿嘧啶应用于食管癌细胞,在促进细胞凋亡、降低细胞生存率、抑制细胞复制等方面均优于单药应用。
另有研究显示,华蟾素可提高肿瘤患者细胞免疫及体液免疫水平,提高患者自体肿瘤细胞杀灭能力。随着更多靶点的发现,靶向治疗也是食管癌治疗的主要研究方向,中药联合靶向药物治疗可能达到增强治疗效果、减轻药物毒副反应的目的。目前,化疗联合放疗是术前新辅助治疗、术后辅助治疗及晚期食管癌治疗的主要药物治疗方式,而中药联合化疗在越来越多的肿瘤治疗中心展开,并取得了重大进展,华蟾素作为近年研发的抗肿瘤作用较强的中药之一,受到很多研究者的关注。对华蟾素中抗肿瘤单剂的进一步提取是未来的研究方向。
