基于先验信息的人体肺癌电阻抗层析成像*
2018-09-27岳士弘王亚茹
李 佳, 岳士弘, 王亚茹
(天津大学 电气自动化与信息工程学院 自动化系,天津 300072)
0 引 言
医学电阻抗层析成像(electrical impedance tomography,EIT)是当前生物医学工程的研究热点[1]。目前,针对医学EIT技术的研究包括肺部呼吸成像、乳腺癌诊断、癫痫病灶诊断等[2,3]。在肺癌早期,癌变组织尚未形成结节,传统的影像技术无法完成准确诊断,且频繁使用会对人体造成伤害,但电导率(介电常数)已随组织的病变发生变化,可以利用EIT技术通过对电导率(介电常数)的检测,完成对早期肺癌的诊断和预警。
EIT技术具有“软场”效应和不适定性,导致重建图像分辨率较低,为提高图像质量,本文根据人体胸腔的计算机断层扫描(computed tomography,CT)扫描图片,利用计算机辅助设计(computer-aided design,CAD)软件构建胸腔器官的结构模型,并结合器官、组织的电导率等先验信息构建正则化矩阵,引入到扩展Kalman滤波(extended Kalman filtering,EKF)的状态空间表达式中,完成肺癌组织的图像重建。
1 算 法
1.1 电阻抗层析成像原理
电阻抗层析运算过程主要分为正问题和逆问题。图像重建即属于逆问题的求解。EIT的线性模型为[4]
ΔU=U′(σ0)Δσ=JΔσ
(1)
式中 ΔU为边界测量电压变化量,Δσ为电导率变化量,J为Jacobian矩阵。
1.2 建立含有先验信息的正则化矩阵
对肺部进行图像重建时,真实的胸腔器官结构信息有利于提高重建图像精度。因此,根据人体的CT胸腔扫描图片,利用CAD软件,对人体胸腔器官组织进行建模,如图1所示。主要包括心脏、肺、脊髓、脂肪4部分,及其电导率σ(Ω/m)变化范围[5]。

图1 人体胸腔模型及器官电导率变化范围
在模型数值变化范围内随机取值,构建500个可能的电导率分布向量σn(n=1,2,3,…,500)作为学习集。利用主成分分析(principal component analysis,PCA)法对学习集进行降维处理。将特征值按从大到小顺序排列,前5个最大特征值中λ1=3.7570,与其他特征值相差很大,λ1所对应的特征向量w1中已包含了绝大部分胸腔电导率分布的先验信息。
构建正则化矩阵L,使L的零空间与向量w1张成的子空间Sw相等[6,7],即
L=I-WWT
(2)
式中I为单位向量,W的列向量由特征向量w1构成。
1.3 含先验信息的EKF算法
EKF方法是一种状态估计次优方法[8],利用EKF对肺部癌变组织进行图像重建时,需建立状态空间模型
σk=Fk/k-1σk+ωk,Uk=Vk(σk)+υk
(3)
式中σk为tk时刻的电导率;Fk/k-1为tk-1~tk时刻的状态转移矩阵,一般取单位矩阵;Uk为tk时刻的电压测量值;Vk为电压值与电导率的函数关系;ωk与υk分别为tk时刻的系统噪声和测量噪声,为0均值、互不相关的白噪声序列,相应的协方差矩阵分别为Qk,Rk。
对Uk关于初始电导率σ0进行泰勒展开,得线性形式
(4)
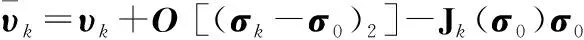
EKF基于状态误差协方差最小的原则对状态值进行估计,加入含先验信息的正则化项后,构建新的代价函数[9]

(5)
式中Pk/k-1为误差协方差矩阵;σ*为先验电导率分布;α为正则化参数,通常由经验获得;L为正则化矩阵,由式(2)计算得到。
式(5)变形并最小化,得到含先验信息EKF滤波方程
(6)
2 仿真实验及结果分析
仿真条件:酷睿i7 3.4 GHz CPU,12 GB内存台式机。将人体胸腔模型导入Comsol 3.5a软件中,进行物理条件仿真和有限元剖分,并利用MATLAB R2009a软件实现正问题的求解和图像重建。EIT系统共有16个电极,采用相邻电流激励、相邻电压测量的激励—测量模式,共获得208个测量值,胸腔被剖分为1 283个单元。
利用Comsol 3.5a建立3种肺癌模型,如图2(a),图中圆表示癌变组织。仿真时,模型中电导率设置心脏0.7,肺0.12,脊髓0.006,脂肪0.037,肺癌组织0.2,同时向电压测量值中添加均值为0,协方差矩阵R为10-2I208×208的白噪声,分别采用共轭梯度法(conjugate gradient,CG)、EKF方法和含先验信息的EKF方法进行图像重建。EKF和含先验信息的EKF方法的初值按经验选取[10],分别为电导率初值取0 Ω/m,误差协方差矩阵Po初值取5I208×208,另外系统噪声协方差矩阵Q取10-2I1 283×1 283。CG算法取迭代500次时重建结果,EKF算法和含先验信息的EKF算法均取迭代两次时的重建结果,各方法重建图像如图2。

图2 各方法仿真实验重建图像
可以看出,对模型1,当癌变组织较少时,三种方法均可较为准确地重建出癌变组织的位置和形状,其中EKF和含先验信息的EKF算法的形状与癌变形状更为接近。对模型2,CG算法的重建图像位置开始发生偏移,且形状也与真实形状相差较大,而EKF算法和含先验信息的EKF算法仍可较为准确地重建出癌变组织位置,其中含先验信息的EKF算法重建图像伪影更小。对模型3,CG算法已发生严重形变,无法分开左肺中的2个癌变组织,但EKF算法和含先验信息的EKF算法仍可较为准确地重建出癌变组织位置,可以分隔开左肺的2个癌变组织,但右肺的成像也与真实形状相差较大,比较2种方法,含先验信息的EKF算法的伪影更小。
为定量比较重建图像的质量,采用图像相对误差e作为评价参数
(7)

经计算3种模型中含先验信息的EKF方法图像的相对误差最小,说明其重建图像质量最好。其中CG算法与其他2种方法的相对误差值相差较大,说明CG算法重建图像质量最差。对模型3,癌变组织较多时,含先验信息的EKF方法较EKF方法的误差更小,重建图像质量更好。
3 结 论
利用人体胸腔器官分布结构和器官组织电导率等先验信息建立正则化矩阵,并将正则化项引入EKF中,进行肺癌组织的图像重建。仿真实验表明:与共轭梯度算法和传统的EKF算法相比,含先验信息的EKF算法得到的重建图像相对误差更小,图像质量更好。
