成人非酒精性脂肪肝患者早期肾损伤状况及影响因素分析*
2018-09-27任习芳
任习芳,张 祎
(三峡大学人民医院消化内科,武汉443000)
随着人们生活方式改变,非酒精性脂肪性肝病(NAFLD)发病率逐渐升高,并与高血压病、2型糖尿病、冠心病等密切相关。近年来,国外研究者发现 NAFLD 可增加患慢性肾病(CKD)的发病风险,CKD具有高发病率和高病死率特点,潜在危险因素包括高龄、肥胖、高血压、糖尿病,及时发现并且治疗早期肾损伤至关重要,CKD 被预防或被延迟将成为可能[1-2]。本研究分析NAFLD患者早期肾脏损伤状况及其影响因素,旨在提高肾损伤的诊断率,为临床上更好地管理NAFLD患者,早期防治CKD的发生、发展提供理论依据。
1 资料与方法
1.1一般资料 选取2016年1月至2017年6月本院门诊及住院NAFLD、NAFLD合并代谢综合征(NAFLD+MS)患者125例。其中NAFLD患者78例,男55例、女23例,平均年龄50.8岁;NAFLD+MS患者47例,男28例、女19例,平均年龄51.6岁;同期体检的单纯性肥胖者78例为对照组,男62例、女16例,平均年龄51.2岁。各组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2诊断标准
1.2.1NAFLD诊断标准 NAFLD患者均符合2010年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组修订的《非酒精性脂肪性肝病诊断标准》,排除病毒性肝炎、酒精性肝病、自身免疫性肝病及其他可致脂肪肝的特殊病例,排除合并其他严重疾病患者,以及影像学诊断具备以下3项腹部超声表现中的两项者为弥漫性脂肪肝患者:(1)肝脏近场回声弥漫性增强(“明亮肝”),回声强于肾脏;(2)肝内管道结构显示不清;(3)肝脏远场回声逐渐衰减、所有患者均为初次来本院就诊,未接受过任何治疗措施。
1.2.2公式定义 根据身高及体质量计算体质量指数(BMI);采用肾脏病饮食改良 (MDRD)公式计算肾小球滤过率(eGFR)=186×血清肌酐Scr-1.154×年龄-0.203×(0.742女性)。肾损害被定义为eGFR<90 mL·min-1·1.73 m-2。超重或肥胖诊断依据2005年国际糖尿病联盟标准,即腰围>90 cm(男性),>80 cm(女性)和(或)BMI>25 kg/m2。采用稳态模型评估计算法计算胰岛素抵抗指数(HOMA-IR),HMOA-IR=空腹血糖(FBG)×空腹胰岛素(FINS)/22.5。
1.3方法
1.3.1标本采集 (1)收集一般资料:包括年龄、性别、现病史、既往史、家族史、饮酒史。(2)测量身高、体质量和计算BMI(BMI=kg/m2)。(3)测量腰围:以cm为单位记录,结果精确到1 mm。
1.3.2观察指标 采用日立7600全自动生化分析仪及其配套试剂检测血生化指标。全部研究对象行生化指标、代谢指标的检测,采血前应禁食8~10 h,次晨于本院体检中心采集血清检测,(1)肝脏生化指标:天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)、γ-谷氨酰转肽酶(γ-GGT)。(2)代谢指标:胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、FBG及尿酸(UA)。(3)肾脏生化及早期肾损指标:尿酸(UA)、血清肌酐(Scr)、尿微量清蛋白/肌酐(ACR)、β2-微球蛋白(β2-MG)、FINS。

2 结 果
2.1各组肝脏生化、肾脏生化、早期肾损伤指标比较结果 NAFLD组、NAFLD+MS组与对照组肝脏生化和代谢指标比较,ALT、AST、TC、TG、HDL、LDL、FBG、FINS、HOMA-IR均升高,差异有统计学意义(P<0.05),其余指标差异无统计学意义(P>0.05)。肾脏生化和早期肾脏损伤指标比较,NAFLD组和NAFLD+MS组FINS、HOMA-IR、Scr、ACR、β2-MG 均升高,eGFR 则降低,NAFLD+MS组与NAFLD组FINS、HOMA-IR比较,差异有统计学意义(P<0.05),见表1。
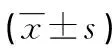
表1 各组肝脏生化、肾脏生化、早期肾损伤指标比较
注:与对照组比较,*P<0.05;与NAFLD组比较,#P<0.05
2.2NAFLD组中ACR与各指标相关分析结果 ACR是预测CKD较灵敏,准确率较高的检测指标,且从上述分析结果得出在对照组、NAFLD组及NAFLD+MS之间,ACR差异有统计学意义(P<0.05),故将ACR与NAFLD和MS各项相关指标(BMI、腰围、TC、TG、HDL、HOMA-IR、FBG、AST、ALT及γ-GGT)进行Spearman相关分析。ACR与BMI、腰围、FBG、FINS、TG、LDL、HOMA-IR呈正相关(P<0.05),与HDL呈负相关(P<0.05),HOMA-IR对ACR的影响最大。见表2。
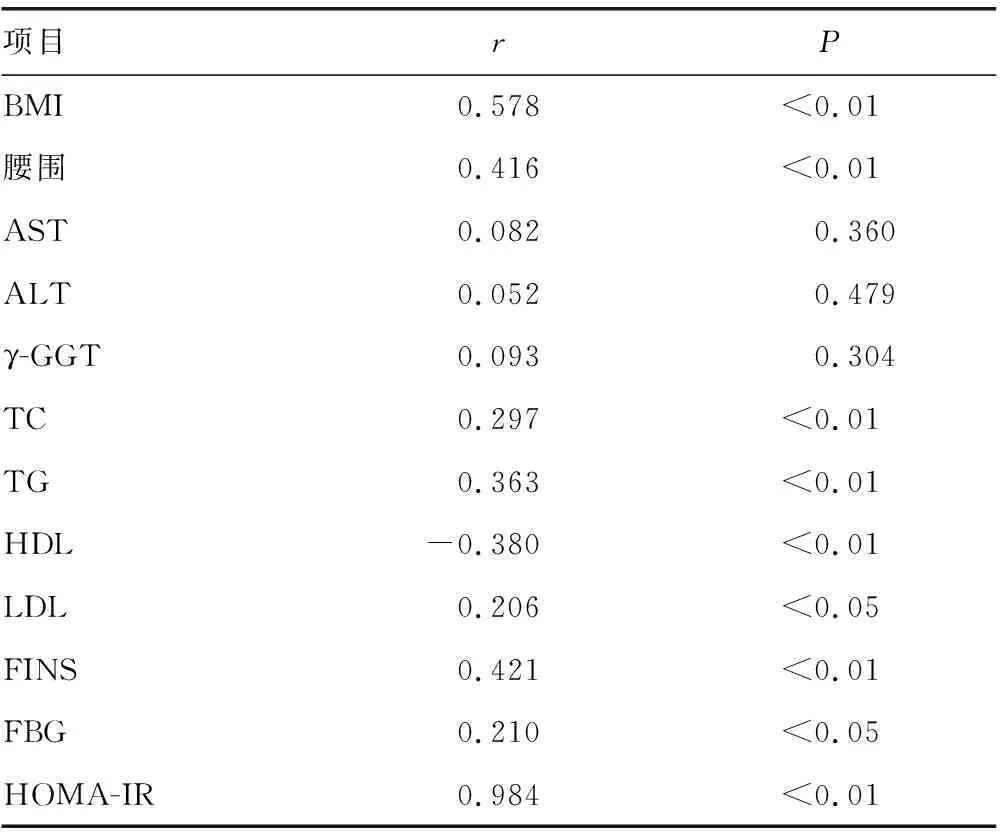
表2 ACR同NAFLD各项指标的Spearman相关分析
3 讨 论
随着对研究地深入,NAFLD与CKD的相互关系逐渐引起越来越多关注,提出2型糖尿病并发NAFLD患者可增加CKD的发病率,1型糖尿病患者中NAFLD是CKD发生、发展的独立危险因素[3]。前瞻性研究也显示NAFLD是CKD高发的危险因素,经过对大量的混杂因素进行校正分析后发现,脂肪肝与CKD发病率增加显著相关[4]。
目前针对NAFLD与CKD的研究主要基于1型和2型糖尿病患者,且已经合并慢性肾病,以及合并MS、本研究主要针对性别、年龄基线相同,同时排除糖尿病、高血压病及肾病史等,健康体检成人脂肪肝发生早期肾损伤的危险因素。本研究中,NAFLD组和NAFLD+MS组在BMI、腰围、TC、TG、HDL、LDL、FBG差异均无统计学意义(P>0.05);肾脏生化和早期肾脏损伤指标比较,NAFLD+MS组与NAFLD组的Scr、ACR、β2-MG均升高,eGFR则降低;NAFLD+MS组的eGFR明显低于对照组与NAFLD组(P<0.05)。提示NAFLD与早期肾脏损伤或CKD密切相关,NAFLD合并高血压、糖尿病、高脂血症、中心性肥胖患者更早出现肾脏损害,NAFLD可能是早期肾脏损伤或CKD的危险因素。SCHVPPAN等[5]指出MS的特征数量直接与肾脏疾病有关。在国外相关研究证实,肝活检诊断的NAFLD患者eGFR水平更低或有异常蛋白尿[6]。
eGFR、β2-MG是临床上反映肾功能的良好指标,但eGFR的计算复杂,且当尿微量清蛋白出现异常时,eGFR还处于正常范围。目前,研究认为CKD患者晨尿ACR和24 h尿微量清蛋白定量之间有相关性,ACR替代24 h尿微量清蛋白定量来评估肾病患者尿微量清蛋白的排泄情况,预测早期肾脏损伤[7]。在本研究中,对ACR与NAFLD相关指标进行Spearman分析,发现ACR与BMI、腰围、FBG、FINS、TG、TC、LDL、HOMA-IR呈正相关,NAFLD+MS患者FINS与HOMA-IR明显高于NAFLD组,其中HOMA-IR对ACR的影响最大,提示伴有胰岛素抵抗(IR)的NAFLD+MS患者更易出现早期肾损害或CKD,考虑IR可能是NAFLD患者发生早期肾损伤的危险因素。NAFLD慢性炎性反应可导致IR加重,研究指出IR引起的高胰岛素血症可介导炎性反应及动脉粥样硬化,通过多种途径直接导致肾脏损伤[8]。同时胰岛素受体分布于所有肾单位细胞上,故IR可直接作用于肾组织,如内皮细胞、足细胞、系膜细胞等,导致蛋白尿、肾间质小管损伤及水钠代谢紊乱,最终诱导CKD的发生、发展[9]。罗春华等[10]调查宜昌市职业人群非酒精性脂肪肝患者,认为治疗NAFLD的首要目标就是要改善IR,干预体质量是重要的病因治疗,有效预防并发症的发生。由此可看出ACR和HOMA-IR是较Scr、eGFR、β2-MG更敏感检测早期肾脏损伤的指标。
NAFLD是CKD独立危险因素,NAFLD+MS早期肾损伤患病率明显增高,ACR和HOMA-IR是早期发现肾损伤最重要的指标,CKD也是最重要的转归。因此早期发现潜在危险因素至关重要,并进行早期干预,有效降低CKD患病率,提高NAFLD患者的生活质量。NAFLD的严重程度是否会影响CKD的进展,未来可能需要更多的研究来阐述NADLF与CKD的关系。
