高场强磁共振结合弥散成像技术对进展期宫颈癌化疗效果的评价价值
2018-09-27康嗣如田荣华
王 艳,康嗣如,田荣华
(湖北省孝感市中心医院磁共振室 432000)
在我国,宫颈癌发病率居妇科肿瘤发病率第二位,是导致中青年妇女死亡的主要肿瘤类型之一[1]。近年来,随着放化疗技术的不断成熟与发展,进展期宫颈癌的整体治疗效果有所提升[2-3]。以顺铂为基础的同步放化疗对宫颈癌,尤其是进展期宫颈癌的治疗效果得到普遍认可。在化疗过程中对宫颈癌患者的病情进行准确判断是临床治疗和化疗的基础,对治疗过程中方案调整和整体治疗效果的提升具有重要价值[4]。高场强磁共振(MRI)结合弥散成像(DWI)可在无创条件下利用目标组织内水分变化和表观扩散系数(ADC)值动态变化反映宫颈癌病灶及周围组织变化情况,为临床判断和预测患者治疗效果提供客观依据[5-7]。本研究旨在探讨高场强MRI结合DWI对进展期宫颈癌患者诊断及预后的作用,分析其应用价值,现报道如下。
1 资料与方法
1.1一般资料 选取本院2014年8月至2017年8月收治的进展期宫颈癌患者的临床资料共计80例(子宫颈进展癌组),患者年龄24~62岁,平均(48.14±5.39)岁。其中,鳞癌62例,腺癌18例。所有患者均经临床病理诊断确诊为进展期宫颈癌[8];患者无法手术治疗或放弃手术治疗,主要治疗手段以放疗联合化疗治疗为主;患者纳入本研究之前均未进行过放化疗治疗,无放化疗禁忌证;患者依从性较好,均排除其他脏器严重并发症。选取本院收治的20例子宫颈原位癌患者(子宫颈原位癌组)和20例健康体检者的临床资料为对照组。整个研究在患者的知情同意下完成,签订知情同意书,并经过本院的伦理委员会批准。
1.2方法 本研究患者采用MRI结合DWI的检查方法[9-10]。MRI成像仪为德国西门子Verio3.0T MRI。检查前嘱咐患者适量喝水憋尿保持膀胱充盈。扫描范围:自髂骨上缘至耻骨联合下缘。信号采集:采用8通道腹部相控阵线圈采集信号,采用敏感编码技术进行采集。参数设置:轴位T1W1及T2W1,矢状位T2W1;主要扫描参数设置:轴位T2W1,快速自旋回波序列(TSE),TR/TE=1 600 ms/90 ms,层厚5~6 mm,层间距1 mm,FOV=325 mm,矩阵256×256。DWI采用单次激发回波平面成像进行测定,矩阵128×128,层厚5~6 mm,层间距1 mm,扩散敏感梯度为b=800 mm2/s及b=2 000 mm2/s,弥散方向=3,轴位成像。成像定位复制横断面T2图像为定位线。MRI结合DWI检查时间为化疗治疗前1周,化疗中第2周结束、放化疗完全结束时,测定患者ADC值。
1.3观察指标 分别统计正常宫颈与各类型肿瘤宫颈内膜ADC值,测定统计b=800 mm2/s及b=2 000 mm2/s宫颈鳞癌和宫颈腺癌的ADC值,分析不同预后患者ADC值及ADC变化率,对比化疗不同时段患者ADC值与肿瘤体积变化。
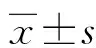
2 结 果
2.1正常宫颈与各类肿瘤宫颈内膜ADC值比较结果 子宫颈进展癌患者的ADC值低于健康体检者及子宫颈原位癌患者,差异有统计学意义(P<0.05),见表1。

表1 正常宫颈与各类型肿瘤宫颈内膜ADC值比较
2.2不同类型患者不同b值ADC值比较结果 化疗前,不同b值检测宫颈腺癌患者的ADC平均值均明显高于宫颈鳞癌患者,差异有统计学意义(P<0.05);化疗后,不同b值检测宫颈腺癌患者的ADC平均值均明显高于宫颈鳞癌患者,差异有统计学意义(P<0.05),见表2。
2.3不同疗效患者行复查时ADC值比较结果 对比不同疗效患者的ADC值,化疗前不同疗效患者的ADC值比较差异并不明显,差异无统计学意义(P>0.05);化疗后,可见全部缓解(CR)患者ADC值最高为(1.830 4±0.214 7)×10-3mm2/s,其次为部分缓解(PR)患者为(1.502 5±0.187 5)×10-3mm2/s,疾病稳定(SD)患者相对较低为(1.401 7±0.157 6)×10-3mm2/s,疾病进展(PD)患者ADC值为(1.387 9±0.166 1)×10-3mm2/s最低。不同化疗预后患者ADC变化率以CR最大,其次为预后PR和预后SD患者,预后为PD患者ADC变化率最小,差异有统计学意义(P<0.05),见表3。

表2 不同类型患者不同b值ADC值比较
注:与化疗前对应b值宫颈鳞癌ADC值比较,*P<0.05;与化疗后对应b值宫颈鳞癌ADC值比较,#P<0.05
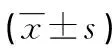
表3 不同预后患者ADC值及ADC变化率比较

表4 化疗不同时段患者ADC值与肿瘤体积变化结果
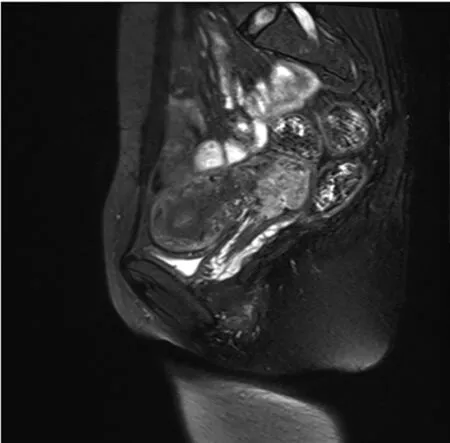
图1 女,35岁,宫颈腺癌患者,病灶环形生长,大小约4.9 cm×2.7 cm×2.1 cm
2.4化疗过程中患者肿瘤体积与ADC值关系 化疗不同时段,患者ADC值与体积呈现不同类型变化,化疗前患者ADC值为(0.988 7±0.182 6)×10-3mm2/s,化疗2个疗程后为(1.225 4±0.221 4)×10-3mm2/s,化疗结束后为(1.658 7±0.244 3)×10-3mm2/s,ADC平均值呈现出升高趋势,差异有统计学意义(P<0.05)。随着化疗疗程增加,患者肿瘤体积也呈现出逐渐减小的趋势,差异有统计学意义(P<0.05),见表4。
2.5典型病例 见图1~4。

图2 同一患者,b值为2 000时ADC呈明显低信号, ADC=0.922 3 mm2/s
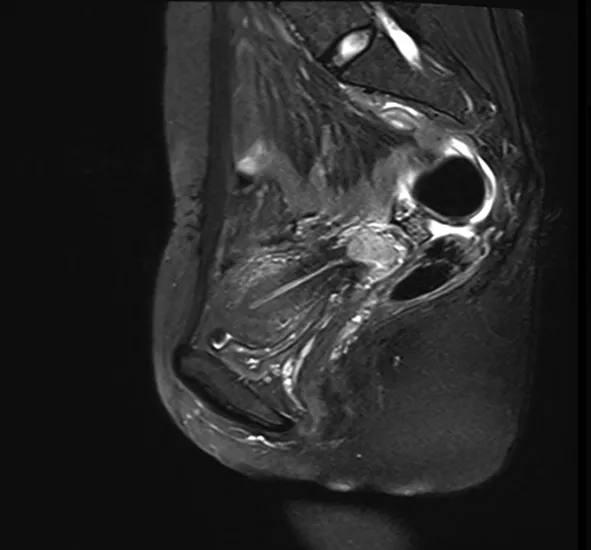
图3 同一患者,化疗2个疗程后,病灶明显缩小,大小约1.8 cm×1.2 cm×1.6 cm
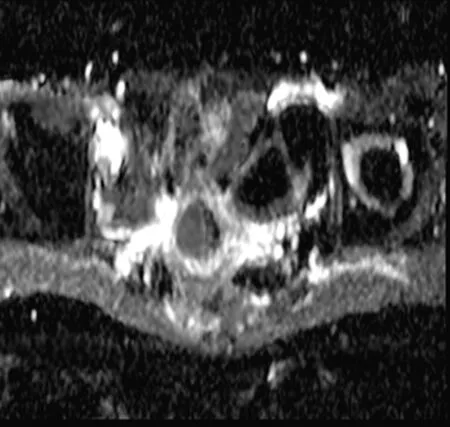
图4 同一患者,化疗2个疗程后,b值为2 000时对应ADC=1.234 7 mm2/s
3 讨 论
宫颈癌是临床常见的妇科肿瘤类型之一,其发病呈年轻化趋势[11-12]。随着健康意识改善和临床检查检验技术的进步,早期宫颈癌的检出率明显提高。病理活检作为宫颈癌诊断的金标准,在病情定性上具有决定性作用,但活检并不能反映病变具体范围,无法用于临床对病灶变化的动态观察[13]。有研究指出,常规超声检查、腹部CT等可通过影像呈现患者子宫颈病灶位置,但其并不能精确地反映瘤体与周边组织边界,导致界限划分不准确,不利于临床对治疗后瘤体变化的观察和疗效评定[14]。临床大量研究表明,单纯的高场强MRI成像技术可相对准确地反映瘤体大小、形态等基本情况,但在判断宫颈癌预后及疗效方面并不理想[15-16]。与既往报道相比,本研究将高场强MRI成像技术及弥散成像技术结合使用,发现此方案可较准确呈现进展期宫颈癌患者瘤体界限,具有成像清晰,反映组织密度准确的特点,并通过对其成像机制的分析建议临床推广。ADC值与组织密度、组成、水分等均具有密切联系,临床在对化疗患者检查时,可通过患者组织ADC变化,判定其组成变化,进而预估治疗价值。
化疗是临床用于进展期宫颈癌非手术治疗的重要手段,尤其是部分瘤体界限不清患者在采用放疗治疗后,进行同步化疗可有效控制病灶[17]。对化疗过程中患者病灶变化的检测对调整化疗方案、预估化疗效果具有重要意义。高场强MRI可通过对肿瘤形态、大小的变化来判断早期化疗疗效,但其灵敏度并不高,据统计常规MRI检测敏感度在60%左右,高场强MRI可在常规MRI基础上增加一定敏感度,准确性也有所提升。DWI利用受检组织水分子微观运动的成像方法,对受检组织细胞成分进行反馈,以此呈现出不同组织[18]。在本研究中,正常宫颈内膜ADC值为(1.789 1±0.095 8)×10-3mm2/s,子宫颈原位癌ADC值为(1.550 3±0.142 2)×10-3mm2/s,子宫颈进展癌ADC值为(0.879 8±0.102 5)×10-3mm2/s,可见,以进展癌ADC值最高,其次为原位癌患者,正常宫颈ADC值最低。分析其原因,考虑为进展期肿瘤细胞异常增殖,分布密集,生长迅速,代谢加快,核浆比较正常组织细胞明显增高,同时细胞密集也导致细胞间隙减小,水分子扩散受限,而使局部弥散速度明显降低,致使检测时ADC值降低,DWI信号增高。在对不同b值患者的ADC平均值对比中也发现,检测宫颈腺癌ADC值均明显高于宫颈鳞癌患者,说明宫颈腺癌细胞分布及活跃度较鳞癌患者低。
对比化疗后不同预后患者的ADC值发现,CP患者ADC值最高为(1.830 4±0.214 7)×10-3mm2/s,其次为PR患者,SD患者相对较低,PD患者ADC值为(1.387 9±0.166 1)×10-3mm2/s最低。同时,不同预后患者的ADC变化率也存在明显差异,预后越好其ADC值越高,变化率越好,二者呈负相关。相关报道中也有化疗效果越好,MRI联合DWI的ADC值越高的结论。化疗不同时段患者ADC值动态监测可见,化疗前患者ADC值为(0.988 7±0.182 6)×10-3mm2/s,化疗2个疗程及化疗结束后ADC平均值呈现出升高趋势。对比肿瘤体积发现,随着化疗疗程增加,患者肿瘤体积也呈现出逐渐减小的趋势。
综上所述,高场强MRI结合DWI可辅助判定宫颈癌病变程度,预测进展期宫颈癌化疗效果,准确性高。化疗后ADC值越高、ADC变化率越高则预示着患者化疗效果较好,可能出现较好预期。若患者治疗过程中ADC值变化并不明显,则需结合瘤体变化适当调整治疗方案,提高疗效。
