哮喘与感染患儿外周血中性粒细胞CD64指数、B淋巴细胞、BTLA的表达差异及临床意义研究*
2018-09-27唐宗生许雪梅秦道建李志鸿陶明芬
唐宗生,许雪梅,秦道建,李志鸿,陶明芬
(1.皖南医学院弋矶山医院输血科,安徽芜湖 241001;2.上海交通大学医学院附属上海儿童医学中心 200127;3.皖南医学院弋矶山医院儿科,安徽芜湖 241001;4.皖南医学院院弋矶山医院血液净化中心,安徽芜湖 241001)
据估计,到2025年全世界哮喘患者的数量将由目前的3亿多增至4亿[1-2]。数量庞大,增长之势迅猛。儿童作为哮喘发病率较高的群体,其患病情况一直备受关注。哮喘的病理机制是气道慢性炎症,主要是气道的高反应性、阻塞可逆性和可重塑性,表现为反复咳喘、气促、胸闷、肺部哮鸣音等[3]。影响哮喘发病的因素众多,总的来说,由遗传因素和环境因素共同作用决定。临床上发现哮喘患者通常合并有感染,感染可能作为哮喘发病的一个重要诱因,并且可能加重哮喘患者病情,影响患者生活质量,增加医疗费用。本研究以哮喘和一般细菌感染患儿作为研究对象,通过测定两组外周血中性粒细胞CD64、B淋巴细胞、B和T淋巴细胞衰竭因子(BTLA)、免疫球蛋白E(IgE)、C反应蛋白(CRP)水平,探讨其作用机制及临床意义。
1 资料与方法
1.1一般资料 选取皖南医学院弋矶山医院儿科2015年6月至2017年1月收住入院的49例患儿,其中哮喘组26例(女14例,男12例),同期一般细菌感染组23例(女10例,男13例)。两组受试对象在年龄、体质量、性别方面差异无统计学意义(P>0.05)。两组患儿均无其他并发症。哮喘患儿及一般感染患儿入院前均未接受治疗。本研究获得家属知情同意。哮喘组患儿均符合哮喘诊断标准(第8版《诸福棠实用儿科学》):(1)反复发作喘息、胸闷、气促,多与接触变应原、化学、物理性刺激等有关,常在夜间和(或)清晨发作或加剧。(2)在发作时两肺可闻及以呼气相为主的散在或弥漫性哮鸣音,呼气相延长。(3)上述症状和体征经抗哮喘治疗有效或自行缓解。(4)除外其他疾病所引发的喘息、咳嗽、气促和胸闷。(5)临床表现不典型者,至少符合以下一项标准,①运动激发试验或支气管激发试验阳性。②证明有可逆性气流受限(满足以下任意一项),抗哮喘治疗有效,即使用支气管舒张剂和吸入(或口服)糖皮质激素治疗1~2周后,第1秒用力呼吸容积(FEV1)增长≥12%;支气管舒张试验阳性,即吸入速效β2受体激动剂15 min后的FEV1增长≥12%。③最大呼气流量(PEF)连续检测1~2周,每日变异率≥20%。符合第1~4项或第4、5项者,可以诊断为哮喘。一般细菌感染诊断标准:中性粒细胞绝对值>10×109/L或CRP>10 mg/L或降钙素原(PCT)>0.5 ng/mL确证,并完善呼吸道病毒、肺炎衣原体、肺炎支原体等检测,排除病毒及特殊病原体感染。
1.2仪器与试剂 Mouse Anti-Human CD45-PE-CY5溶液(Cat:12-0649;美国eBioscience公司)、Mouse Anti-Human CD64-PE溶液(Cat:12-0649;美国eBioscience公司)、Mouse Anti-Human CD3-PE-CF594溶液(Cat:562280;美国BD Bioscience公司);Mouse Anti-Human Anti-Human CD19-PE-CY5溶液(Cat:A07771;美国Beckman Coulter公司)、Mouse Anti-human CD272-PE溶液(BTLA)(Cat:344506;美国Biolegend公司) OptiLyse C红细胞裂解液(11895;美国Beckman Coulter公司);磷酸盐缓冲液(PBS,HyClone SH30256.01B;北京Therm公司)。FC500 MPL流式细胞仪(美国Beckman Coulter公司)。
1.3方法 患儿入院24 h内,在取得家属同意的前提下,采集清晨空腹外周静脉血送至相关化验室检测并报告结果;另外留取1.5 mL在乙二胺四乙酸(EDTA)抗凝管(紫头)中自行实验通过流式细胞仪测得。
取EDTA 抗凝管中的全血20 μL依次置于分别标记A、B的流式管中;在暗光下依次向流式管中加入单克隆抗体染色剂各1.5 μL(A管:CD64-PE、CD45-PE-CY5,B管:CD3-CF594、CD19-PE-CY5、CD272-PE),混匀避光20 min后分别加入1×红细胞裂解液1 500 μL,再混匀避光20 min后以1 500 r/min离心5 min,共2次;最后加1×PBS 700 μL混匀,至此荧光抗体标记样本制备好,并用流式细胞仪检测;所得结果使用FlowJo_V10软件分析,计算中性粒细胞平均荧光强度和淋巴细胞平均荧光强度得出CD64指数,计算B淋巴细胞的百分比及其BTLA表达。

2 结 果
2.1中性粒细胞指数变化 N代表中性粒细胞平均荧光强度;L代表淋巴细胞平均荧光强度,CD64指数表示N的MFI与L的MFI比值。根据统计分析结果可知,感染组和哮喘组中性粒细胞CD64指数比较,差异有统计学意义(P<0.05),见图1。
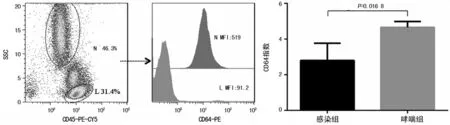
图1 中性粒细胞CD64表达

图2 B淋巴细胞百分率及BTLA表达
2.2B细胞的百分比及其BTLA的表达 根据统计分析结果可知,哮喘组B淋巴细胞百分比高于感染组,差异有统计学意义(P<0.05);哮喘组B淋巴细胞表面BTLA表达(百分比及平均荧光强度)较感染组明显降低,差异有统计学意义(P<0.01)。见图2。
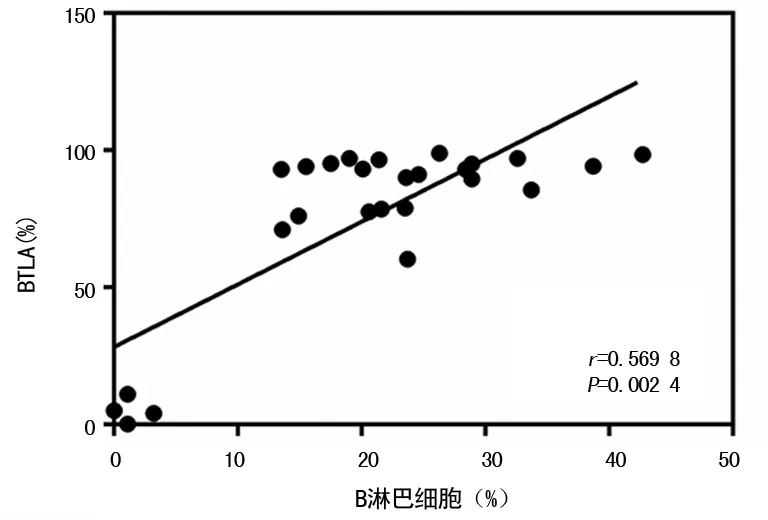
图3 B淋巴细胞与其表达BTLA相关性
2.3B细胞与其表达的BTLA相关性分析 根据统计分析结果可知,哮喘组B淋巴细胞百分比与其表达BTLA呈正相关(r=0.569 8,P=0.002 4<0.01),见图3。

图4 血清CRP水平

图5 血清IgE水平
2.4外周血清CRP与IgE分析 根据统计分析结果可知,哮喘组血清CRP水平较感染组低,差异有统计学意义(P<0.05),见图4;感染组血清IgE水平较哮喘组有显著减低,差异有统计学意义(P<0.01),见图5。
3 讨 论
儿童哮喘的发生并无特定、明确的病因,该病是由遗传因素与环境因素共同导致。对于多数哮喘患儿,追寻病史可发现其三代近亲属中有人罹患哮喘。除哮喘外,还可以发现患儿家族近亲中有过敏性鼻炎、荨麻疹、湿疹等患者。且该病具有多基因遗传倾向,并非独立发病,感染、尘螨、空气污染、花粉过敏、食物过敏、运动、情绪变化等均可引发哮喘。越来越多的研究证明,病毒、细菌及定植菌在哮喘的发病过程中发挥了一定的作用,它们可能作为独立影响因素,或者病毒的辅因子[4-7]。BISGAARD等[6]通过大的出生队列研究发现哮喘母亲分娩的无症状新生儿在生后5年内发生哮喘与其咽部定植肺炎链球菌、流感嗜血杆菌、卡他莫拉菌呈正相关。对同一人群进行第二项研究,观察发生喘息性疾病时细菌和病毒在呼吸道出现的频率[8]。他们发现,喘息与细菌感染(肺炎链球菌、流感嗜血杆菌、卡他莫拉菌)密切相关,这种关系与病毒感染相似但又有区别。本研究结果显示,感染组CRP高于哮喘组,哮喘患儿在急性发作期可合并有细菌感染,感染不是哮喘的独立发病因素,除外遗传背景,还可能与过敏、运动、情绪变化等有关。另外本研究显示,感染组CD64指数低于哮喘组,这与预期结果不符。中性粒细胞作为固有免疫的重要细胞,在细菌侵入机体后第一时间到达炎症部位,通过吞噬病原体、分泌抗菌物质发挥作用,同时分泌细胞因子募集单核巨噬细胞、树突状细胞等发挥免疫调节作用。国外学者认为CRP和CD64均可作为细菌感染的检测指标,CD64在感染12 h内一般即有变化,而CRP出现变化较晚,一般超过24 h[9]。在正常情况时,中性粒细胞表面很少表达CD64,而当机体感染细菌后,中性粒细胞表面的CD64表达明显增多。在一般细菌感染,固有免疫发挥重要作用。故预期结果与实验结果相反。哮喘被认为是一类变态反应性疾病,CD64在哮喘患儿中性粒细胞表面的过度表达可能与机体粒细胞吞噬、活化反应降低有关[10-11]。感染作为哮喘发病的危险因素,不仅加重已有的哮喘,而且促进哮喘的发生、发展,使其难以控制。所以,本研究认为在哮喘患者在有CD64或CRP指标异常情况下需积极抗感染治疗。另外,本课题组之前的研究显示,对于细菌感染联合检测CD64和CRP的灵敏度及准确度均较单一指标升高[12]。
哮喘发病是多种因素相互作用的结果,免疫因素所致的气道慢性炎症被认为是哮喘的本质,除外固有免疫应答,适应性免疫应答也参与哮喘的发病。免疫功能紊乱与哮喘的发生、发展密切相关。正常情况下,淋巴细胞亚群的比例在一定范围内。在适应性免疫应答中,T细胞的完全活化需要TCR-CD3特异性识别pMHC产生的第一活化信号、T细胞与APC表面的共刺激分子相互作用后产生第二活化信号及Th细胞上调表达相关细胞因子受体结合细胞因子产生的第三信号。B细胞在适应性免疫应答中也起重要作用。对绝大部分B 细胞来说,其活化需要T细胞辅助,完全活化需要先B-T结合提供第一信号、然后B 细胞表面共刺激分子传递第二信号、最后B细胞表达细胞因子受体结合细胞因子传递第三信号。大部分B 细胞活化后,转化为浆细胞,产生大量 IgE,IgE的合成增多是儿童哮喘的主要免疫特性。本实验结果显示:哮喘组B淋巴细胞百分比及IgE水平较感染组明显升高,证实B淋巴细胞参与了哮喘的发病,并发挥了重要作用。故认为临床上检测B淋巴细胞及IgE水平有助于哮喘的诊治,可提早预防。
BTLA是CD28家族抑制性受体成员之一,是表达在细胞膜表面的1型跨膜蛋白,包含一个免疫球蛋白超家族结构域,一个跨膜区和一个胞内域,后者包含一个近端免疫受体酪氨酸抑制基序(ITIM)和远端的免疫受体酪氨酸转换基序(ITSM)。BTLA最初是从鼠Th1细胞中克隆而来。目前发现BTLA广泛表达于B淋巴细胞、T淋巴细胞(CD4+T细胞/CD8+T细胞/调节性T细胞)、巨噬细胞、树突状细胞和NK细胞等。HVEM是BTLA的唯一配体,为肿瘤坏死因子受体超家族的一个成员,与BTLA相互作用参与免疫耐受。BTLA是B和T淋巴细胞的共抑制受体,在炎症和感染过程中调节淋巴细胞活化发挥重要作用。研究更多的是其在T淋巴细胞的作用。已知BTLA抑制小鼠和人类T细胞的活化和增殖。然而关于BTLA在B淋巴细胞中的作用和功能的研究甚少。VENDEL等[13]研究了B细胞BTLA的抑制作用。BTLA与HVEM结合后抑制B细胞的增殖,主要是通过减少脾酪氨酸激酶(SYK)、B细胞连接蛋白和磷脂酶C-γ2的磷酸化下调BCR下游信号分子的信号强度发挥作用。THIBULT等[14]认为,BTLA/HVEM信号通路可以通过抑制CG二核苷酸来抑制B细胞的功能。动物实验显示特异性抗体反应和自身免疫性肝炎与BTLA缺乏有关,突出BTLA在调节B细胞的自身免疫性方面的潜在作用。有数据显示缺乏BTLA能够促进受细菌感染诱导的抗原特异性CD8+T细胞的存活,再次表明BTLA可能在维持免疫系统的平衡方面起作用。虽然BTLA被普遍看作是一个共抑制受体,但是有报告认为这可能取决于抗原刺激的强度。研究显示,免疫衰老时B淋巴细胞表达BTLA减少,这可能与老年人长寿血浆细胞、记忆B细胞和抗体效价诱导减低有关。由此推测BTLA可能促进而不是抑制长寿浆细胞和记忆B细胞的诱导,当然这有待于进一步研究。本研究中哮喘组BTLA表达水平较感染组低。此外,B淋巴细胞百分比与其BTLA的表达呈正相关。结合本研究中哮喘组B淋巴细胞表达较感染组多,笔者猜测可能处在不同分化阶段的BTLA表达水平不同。THIBULT等[14]研究表明,处在不同阶段的B淋巴细胞其BTLA的表达水平也有变化。虽然BTLA在所有B淋巴细胞亚群表达,但是在初始B淋巴细胞(CD19+IgD+CD27-)和记忆B淋巴细胞(CD19+IgD-CD27+)的表达明显低于IgM记忆B淋巴细胞(CD19+IgD+CD27+),循环过渡期B淋巴细胞(CD27-IgD+CD24high和CD38high)表达更高。研究还分析了HVEM在B淋巴细胞分化亚群的表达;与BTLA相反,HVEM的表达与B淋巴细胞所处分化阶段无关。研究还分析了B淋巴细胞活化时BTLA的变化情况。B淋巴细胞表达基因编码的TLAR(Toll样受体),主要与先天性免疫有关,然后针对入侵的病原体发生适应性免疫应答。人体TLR9的表达则只存在于B淋巴细胞、浆细胞样树突状细胞。TLR9识别低甲基化CpG基序(细菌、病毒和原生动物DNA的特征),后者与人工合成的寡聚核苷酸相似(如CpG基序)。研究中,接种含CpG佐剂疫苗的黑色素瘤患者循环B淋巴细胞持续表达BTLA,而接种缺乏CpG佐剂疫苗的黑色素瘤患者循环中B淋巴细胞BTLA表达逐步下调。在B淋巴细胞分化过程中,BTLA表达被调节,在IgM记忆B淋巴细胞BTLA表达升高。结合上述内容,虽然哮喘组B淋巴细胞百分比较感染组高,但BTLA表达较感染组低,笔者推测一方面与B淋巴细胞分化所处阶段有关,另一方面与细菌感染人体后其低甲基化CpG基序被B细胞表面TLR9识别,使B淋巴细胞持续表达BTLA。
本研究的不足之处:因患儿年龄较小、入组标准严格、采集血液标本需征求家属知情同意,故最终入组对象数量相对较少,一定程度上可能影响试验结果,其样本代表性还需进一步的试验验证。
综上所述,笔者认为感染是哮喘发病的重要诱因,临床上哮喘患者有感染应积极抗感染治疗。哮喘发病机制复杂,BTLA、B淋巴细胞、IgE等只是其众多研究中的一部分。哮喘发病众多因素相互影响、相互作用,构成了一个巨大的网络,需要更大样本量、更加系统、多中心的临床研究来阐释其中错综复杂的网络关系机制。
