绿原酸缓解镉暴露致大鼠肠道损伤
2018-09-26刘文惠鄢雅丽
黄 芳,刘文惠,吴 轶,鄢雅丽,阮 征*
镉元素于1817年被德国的化学家Strohmeier发现,关于镉暴露最早的毒性作用观察来自临床医学[1]。镉由于其性质柔韧和良好的抗氧化性而被广泛应用于现代工业生产中,故其对环境造成的污染日趋严重。镉主要通过食物链、烟草烟雾以及镉矿工业等进入人体和动物体中[2],在体内的生物半衰期长达10~30 年,在动物和人类的血液、肾脏、肝脏、肠道、骨骼和生殖器官中不断蓄积[3]。镉会使肝和肾等重要器官产生严重的畸变和癌变[4],被国际癌症研究机构界定为人类致癌物。研究显示,镉造成的毒性与其引起机体产生大量活性氧(reactive oxygen species,ROS)紧密相关,说明氧化应激参与镉引起的毒性损伤。肠道是镉进入机体的第一个器官,只有3%左右的摄入镉可以被吸收[5],镉在胃肠道绒毛的最长停留时间集中在4~68 h之间[6-7]。早期的体外实验表明肠道屏障对限制镉的吸收至关重要[8-9],肠道屏障被破坏会增加镉的吸收。这些事实表明肠道是一个保护机体免受无机毒物损害的重要器官。
绿原酸(chlorogenic acid,CGA)是天然的膳食酚类物质,广泛存在于杜仲、金银花、咖啡与向日葵等多种植物性食品及药食同源性食物中,是日常膳食中摄入量最多的一类酚酸[10]。早期研究表明绿原酸具有抗氧化、抗菌、抗病毒、抗肿瘤、降血压、降血脂、清除体内自由基及免疫调节等作用,是一种重要的生物活性物质,其抗氧化作用最受关注[11-13]。绿原酸是一种酚型抗氧化剂,其抗氧化作用与其分子结构中的R—OH有关,它可以清除羟自由基和超氧阴离子自由基等,保护组织免受自由基的损害。
本实验通过构造镉暴露导致的肠损伤大鼠模型,添加膳食绿原酸干预,从大鼠的生长性能、组织形态学、黏膜损伤评分、绒毛高度和隐窝深度等方面来探讨镉对大鼠肠道的损伤作用,及绿原酸对镉损伤的缓解作用。
1 材料与方法
1.1 动物、材料与试剂
SPF级SD雌性大鼠购自长沙天勤生物技术有限公司,许可证编号:SCXK(湘)2016-0002。
绿原酸(纯度98%) 阿拉丁试剂有限公司;葵花仁提取物(sunflower seed extract,SSE;含绿原酸33.27%,提取率为3.04%) 内蒙古沃禾泥农业科技有限公司;氯化镉 西陇化工股份有限公司;苏木精-伊红(hematoxylin-eosin,HE)染色试剂盒 长沙艾杰生物技术有限公司;其他试剂均为分析纯。
1.2 仪器与设备
YP202N电子天平 上海精密科学仪器有限公司;SC-3614台式离心机 科大创新股份有限公司中佳分公司;UV-160A紫外分光光度计 日本岛津公司;HH-2数显恒温水浴锅 江苏金坛市城西晓阳电子仪器厂;BN-803生物组织摊片烤片机 湖北贝诺医疗科技有限公司;Power Tome-XL超薄切片机 美国RMC公司;RM2235切片机 德国Leica公司。
1.3 方法
1.3.1 动物分组与喂养
实验选取32 只健康SD雌性大鼠,按照随机分配的原则分为4 组,预喂养1 周,1 周后分别对每组进行灌胃给药。空白对照(control,CON)组:只灌胃蒸馏水;镉损伤模型(CdCl2,Cd)组:灌胃6 mg/kg mbCdCl2;镉损伤模型+绿原酸干预(Cd+CGA)组:灌胃6 mg/kg mbCdCl2+50 mg/kg mbCGA;镉损伤模型+葵花仁提取物干预(Cd+SSE)组:灌胃6 mg/kg mbCdCl2+50 mg/kg mbSSE。参照GB 14924.3—2001《实验动物 大鼠小鼠配合饲料》营养需要量配制本实验的基础日粮(表1)。实验周期为14 d,之后禁食12 h后麻醉断头处死。

表1 饲料营养成分表Table 1 Composition and nutrients of experimental diet
1.3.2 检测指标和方法
1.3.2.1 组织器官的采集和处理
大鼠于正式实验第14天晚上采用麻醉断头的方式处死,然后解剖,分别取出内脏器官肝脏、肾脏、脾、小肠和大肠组织;小肠又分为十二指肠、空肠和回肠3 段,取出的所有器官和组织,用质量分数0.9%的生理盐水清洗干净并除去异物,再用吸水纸吸干后用电子天平称质量,用以计算脏器指数,剪取部分组织用锡箔纸包好并标记,放入充满液氮的泡沫盒中暂时保存,再用剪刀剪取空肠组织1.5 cm左右放入10%福尔马林固定液中待用。
1.3.2.2 血样的采集和处理
实验大鼠采用麻醉断头的方式处死,收集血液,为防止所取得的血液凝固,立即4 000 r/min离心15 min,取上清液并分装在2.5 mL的EP管中,标记后置于-80 ℃冰箱中保存待用。
1.3.2.3 生长性能指标的测定
在大鼠正式造模后每7 d称量1 次大鼠的体质量和剩余饲料质量,记录下大鼠的体质量和进食量。计算大鼠平均每周体质量增加量和进食量情况。
1.3.2.4 脏器指数的测定
取出的肝脏、脾脏、肾脏、空肠、回肠和结肠在除去其表面或内部异物后用电子天平分别称其质量,根据下式计算脏器指数。

式中:m1为器官质量/g;m2为大鼠体质量/kg。
1.3.2.5 血液生化指标的测定
取存于-80 ℃冰箱中的血清200 μL放入全自动生化分析仪中,并加入检测试剂测定谷丙转氨酶(alanine aminotransferase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)活力及血清白蛋白(serum albumin,ALB)水平。
1.3.2.6 肠道黏膜HE染色
所取空肠样本采用10%福尔马林溶液固定、乙醇逐级脱水、二甲苯透明处理、石蜡包埋,切片并做HE染色[14],在电子显微镜下观察组织的损伤切片。用ISCpicture 3.0系统进行图像采集,收集放大200 倍条件下观察到的图片,采用显微图像分析软件Image-Pro Plus 6.0测量空肠绒毛高度和隐窝深度。绒毛高度是从肠绒毛基部至绒毛顶端的长度,隐窝深度是从肠腺绒毛联结处至肠腺基部的距离。收集数据,做后续统计学分析。
1.3.2.7 肠道的评分
肠道病理损伤程度的评价采用Chiu氏评分法[15]。0 分:正常肠黏膜;1 分:绒毛顶部出现上皮下间隙;2 分:上皮下间隙继续扩展;3 分:上皮层大块分离伴部分绒毛顶部缺失;4 分:绒毛消失伴固有层、扩张的毛细血管裸露;5 分:固有层溃疡、解体。
1.4 数据统计分析
将经过初步处理后的数据用SPSS 17.0统计软件进行单因素方差分析以及Tukey氏多重比较,最终结果以 ±s表示,以P<0.05为差异显著性的判断标准。
2 结果与分析
2.1 绿原酸对镉暴露大鼠生长性能的影响
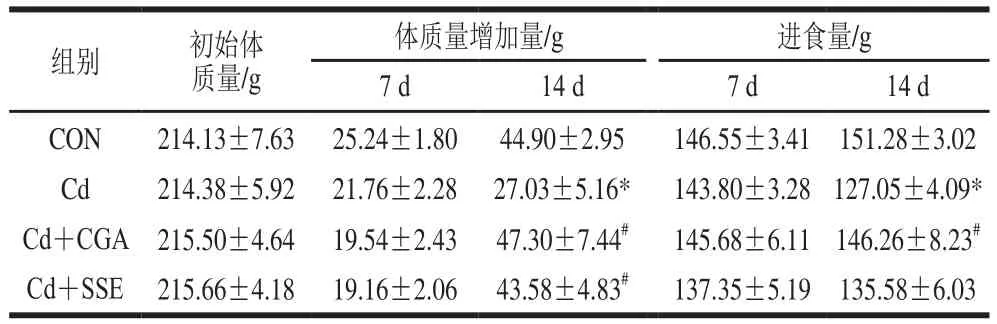
表2 绿原酸对镉暴露大鼠体质量和进食量的影响(n=8)Table 2 Effect of chlorogenic acid on body mass and feed intake of rats with cadmium exposure (n= 8)
由表2可知,镉损伤造模1 周后,造模组第一周的体质量增加量和进食量与空白对照组相比均无显著性差异,绿原酸干预1 周后,Cd+CGA组第一周的体质量增加量、进食量与模型组相比也无显著性差异。镉损伤造模2 周后,与空白对照组相比,Cd组的体质量增加量和进食量显著降低(P<0.05);与Cd组相比,Cd+CGA组的体质量增加量与进食量显著增加(P<0.05),Cd+SSE的体质量增加量与进食量也显著增加(P<0.05)。
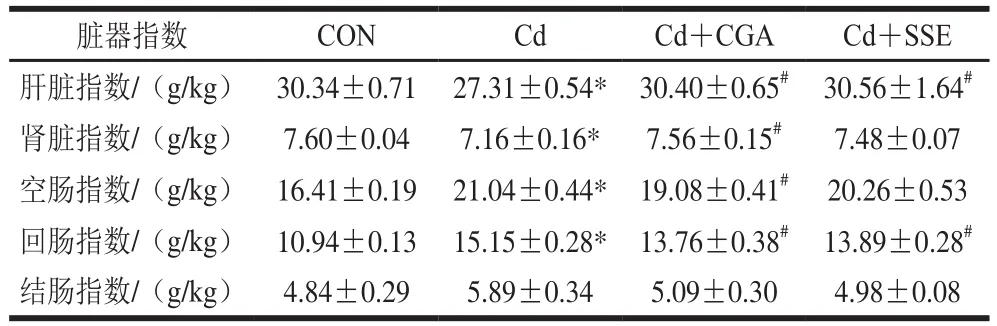
表3 绿原酸对镉暴露大鼠脏器指数的影响(n=8)Table 3 Effect of chlorogenic acid on organ indexes of rats with cadmium exposure (n= 8)
由表3可知,重金属镉损伤造模2 周后肝脏指数较空白对照组、Cd+CGA组和SSE+CGA组显著降低(P<0.05);肾脏指数也较空白对照组和Cd+CGA组显著降低(P<0.05);空肠指数较空白对照组和Cd+CGA组显著升高(P<0.05);回肠指数较空白对照组、Cd+CGA组和Cd+SSE组显著升高(P<0.05)。
2.2 绿原酸对镉暴露大鼠血液生化指标的影响
由表4可以看出,重金属镉损伤造模2 周后,血液中ALT活力较空白对照组、Cd+CGA组和Cd+SSE组显著升高(P<0.05),AST活力较空白对照组、Cd+CGA组和Cd+SSE组也显著升高(P<0.05),ALB的水平则较其他组均无显著性变化。
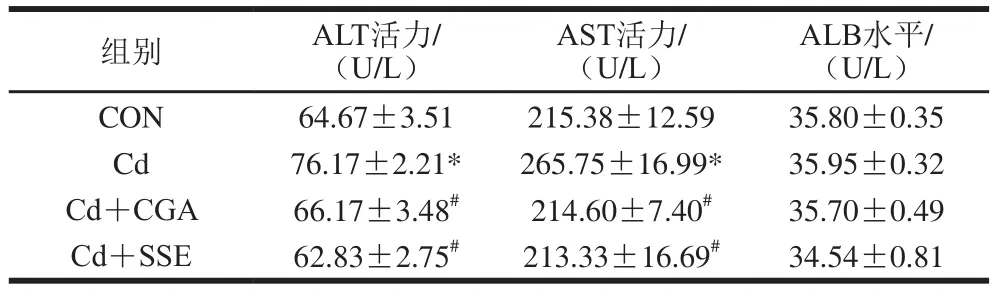
表4 绿原酸对镉暴露大鼠血液生化指标的影响(n=8)Table 4 Effect of chlorogenic acid on blood biochemical indicators of rats with cadmium exposure (n= 8)
2.3 绿原酸对镉暴露大鼠肠道黏膜形态的影响
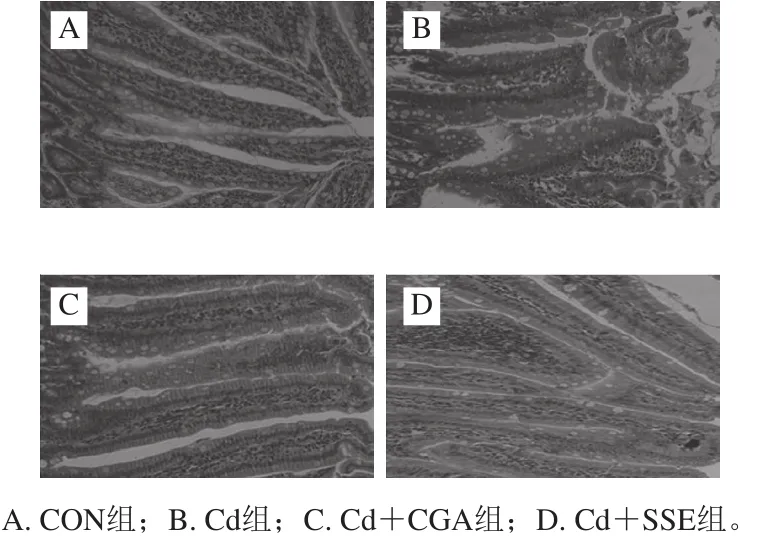
图1 大鼠空肠黏膜形态(200×)Fig. 1 Mucosal morphology of rat jejunum (200 ×)
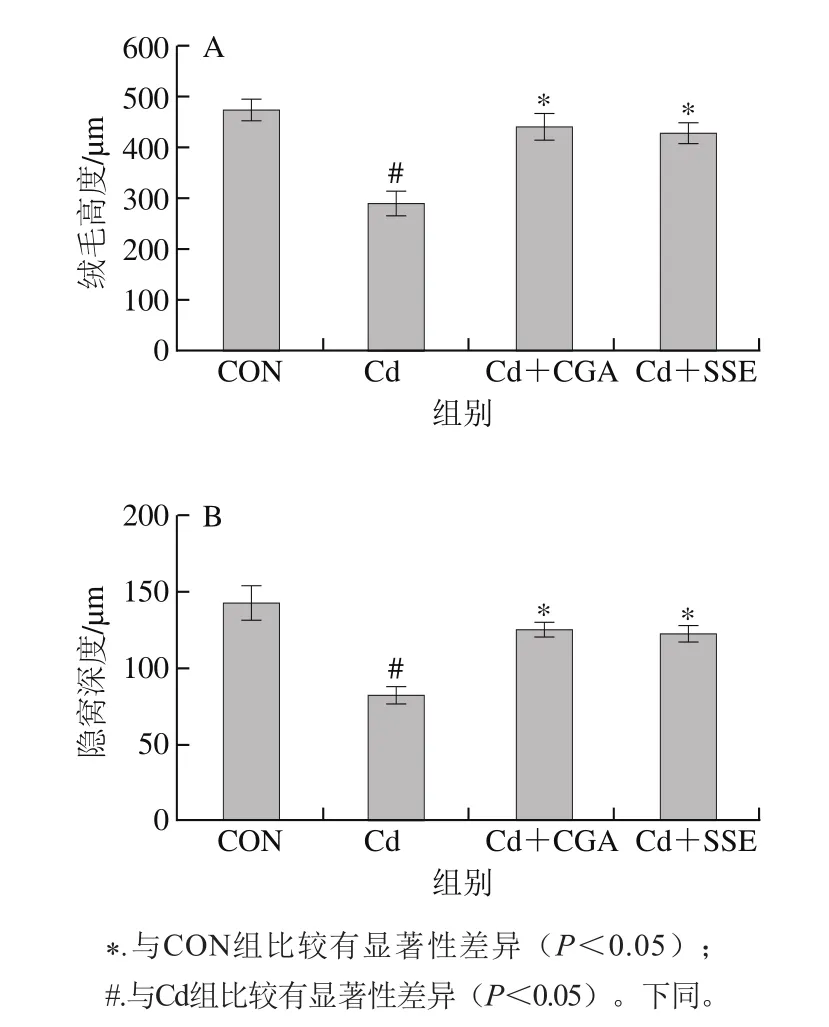
图2 大鼠空肠绒毛高度(A)及隐窝深度(B)Fig. 2 Jejunum villus height (A) and crypt depth (B) in rats
空白对照组大鼠空肠黏膜的形态基本正常,肠黏膜绒毛结构完整,绒毛排列整齐,上皮细胞排列整齐,间质无水肿(图1A);Cd组大鼠空肠黏膜绒毛完整性被破坏,绒毛间质疏松,肠绒毛排列极不规则,绒毛上皮坏死脱落,上皮层与固有层可见分离,固有层出现水肿(图1B);Cd+CGA组大鼠空肠黏膜形态基本正常,肠黏膜绒毛结构比较完整,绒毛排列较造模组整齐,间质无明显水肿(图1C、D)。由图2A、B可以看出Cd组大鼠的绒毛高度和隐窝深度较空白对照组显著降低(P<0.05),Cd+CGA组和Cd+SSE组较Cd组绒毛高度和隐窝深度显著升高(P<0.05)。
2.4 肠道评分
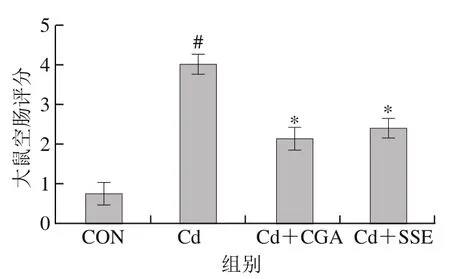
图3 大鼠空肠评分Fig. 3 Jejunum mucosal injury scores
Chiu氏评分法的结果见图3,此评分体系中,得分越高组表明肠道黏膜损伤越严重。空白对照组平均评分为0.75;Cd组平均评分为4,表明肠黏膜损伤很严重;Cd+CGA组平均评分为2.13,表明肠黏膜损伤较造模组得到了一定程度的改善;Cd+SSE组平均评分为2.38,表明肠黏膜损伤较造模组也得到了一定程度的改善。
3 讨 论
生长性能是反映机体动物生长和营养状态的比较直观的指标。镉进入机体后会在机体内大量蓄积,进而产生一系列毒性反应,会严重影响生长期动物的食欲,从而使体质量增加量受到影响。王静[16]研究发现,与对照组相比,染镉组能显著降低小鼠日平均增长体质量,添加花青素可显著增加染镉大鼠的体质量;Shim等[17]研究发现染镉组日平均采食量与对照组相比显著下降,添加小球藻粉末后可显著使采食量增加;欧阳彩群[18]研究发现染镉组大鼠肝脏指数与对照组相比存在显著性差异;王林[19]研究发现染镉组大鼠肾脏指数与对照组相比有显著性差异,这些结论与本实验得出的结果一致。肠道是镉进入机体途经的第一个器官,在肠道产生大量活性氧,这些自由基会使肠道上皮结构被破坏,细胞产生水肿。结肠指数无显著性差异的可能原因是镉主要在小肠段被吸收,对结肠的损伤相对较小[20]。
肝功能是由肝酶标记的等离子体(ALT和AST)决定的,Abdel-Rahim等[21]研究发现染镉组大鼠可显著刺激ALT和AST等离子体大量生成,这意味着镉抑制了肝的活性,添加龙葵汁可显著降低镉引起的ALT和AST的增加量,这与本实验结果是一致的。说明绿原酸能显著抑制染镉大鼠ALT和AST的大量合成,保护肝脏功能,降低镉的毒性。
本实验观察的肠道黏膜形态与Zhao Zhaohui等[22]的研究结果是一致的。镉暴露会使线粒体肿胀,从而使吸收细胞坏死[23]。从死细胞中释放的细胞碎片或者酶可能伤害或者杀死相邻的完整的细胞,从而放大镉的毒性[24]。染镉后大鼠肠道结构的完整性遭到破坏,肠道绒毛高度降低,绒毛脱落,会减少肠道内表面营养物质的吸收面积,直接影响着动物生长发育。同时绒毛高度与上皮细胞数量呈正相关,只有成熟的肠道绒毛上皮细胞才有吸收养分的功能。因此大鼠染镉后绒毛高度降低,会使成熟的绒毛上皮细胞减少,则其养分吸收能力会降低[25-27]。本实验结果表明绿原酸可显著增加染镉大鼠肠道绒毛的高度。小肠隐窝是绒毛根部的上皮陷入固有层而形成的管状腺。隐窝深度主要是反映肠道上皮细胞的生成率。隐窝变浅时,成熟的细胞生成量会降低,分泌能力减弱,消化液的分泌随之减弱,肠道吸收功能则也会减弱[28]。本实验结果显示染镉大鼠隐窝深度较空白对照组显著降低,使上皮细胞生成率下降,影响营养物质的吸收,而添加绿原酸可显著使染镉大鼠隐窝变深。
本实验的研究结果表明,绿原酸可以改善染镉大鼠肠道黏膜损伤,增加绒毛高度和隐窝深度,从一定程度上增加体质量增加量和进食量,缓解器官指数失衡,能显著抑制镉造成的ALT和AST大量合成,保护大鼠肝脏功能,降低镉的毒性作用。
