大豆蛋白与大豆低聚肽对负氮平衡老年小鼠表皮创伤感染下的免疫调节作用
2018-09-26李雯晖赵博雅刘新旗
张 健,李雯晖,赵博雅,李 赫,刘新旗,*,肖 林
大豆蛋白主要由大豆球蛋白和β-伴大豆球蛋白组成,其氨基酸构成相对平衡。大豆低聚肽是指大豆分离蛋白经蛋白酶作用或微生物技术处理后,再经过分离和精制等工艺处理得到的低聚肽混合物,通常含有3~6 个氨基酸,分子质量低于1 000 Da,其中还包括少量游离氨基酸、糖类、水分和灰分等[1-2]。大豆低聚肽的氨基酸组成与大豆蛋白基本相同,具有良好的必需氨基酸平衡性,其氨基酸吸收、转运速度均高于含等量氨基酸的蛋白质和游离氨基酸[3-6]。大豆低聚肽具有调节免疫功能、降血压、降低胆固醇、改善脂质代谢、抗疲劳等功能特性[7-10],是目前大豆蛋白研究中的一个热点。
我国已经步入老龄化社会,随着年龄增长,人体的基础代谢和消化能力下降,特别是蛋白酶活力下降尤为明显,蛋白质的消化吸收减少引起老年人体内“负氮平衡”[11-12],最终导致免疫力下降、肌肉萎缩、睡眠障碍等各种老年人常见的健康问题。营养支持不仅为人体提供热量、蛋白质等营养物质,还直接参与机体代谢,是人体免疫功能的物质基础[13-14]。免疫营养不仅能防止营养缺乏,且能通过特定方式刺激免疫细胞,增强机体免疫应答,通过调控细胞因子的产生和释放减轻过度的炎症反应[15]。
大豆蛋白与大豆低聚肽作为重要的营养物质影响着动物的免疫功能,是维持和调控动物免疫功能的直接参与者。与大豆蛋白相比,大豆低聚肽因为其吸收快、利用率高、氨基酸平衡好等特点,可更好地发挥免疫营养支持作用,更适合解决老年人负氮平衡以及由此引发的健康问题。目前很少有大豆蛋白与大豆低聚肽对负氮平衡状况下体内免疫功能调节的报道,本实验通过研究大豆蛋白与大豆低聚肽对负氮平衡老年小鼠在金黄色葡萄球菌感染情况下免疫功能的调节作用,分析小鼠体液免疫、血清炎症因子、趋化因子的变化,以及大豆蛋白与大豆低聚肽的作用差异,旨在探索改善负氮平衡下免疫应答的营养干预方法。
1 材料与方法
1.1 动物、材料与试剂
SPF级雄性ICR小鼠(48 只,8 月龄,体质量40~50 g)购自北京维通利华实验动物技术有限公司,合格证号:SCXK(京)2012-0001;低蛋白饲料(蛋白质量分数1.5%)购自北京华阜康生物科技股份有限公司,许可证号:SCXK(京)2014-0008;金黄色葡萄球菌金黄亚种(编号1.801)购自中国普通微生物菌种保藏管理中心。
大豆蛋白 山东御馨生物科技有限公司;中性蛋白酶、碱性蛋白酶 上海源叶生物科技有限公司;Gel Filtration Calibration kit 美国GE公司;小鼠免疫球蛋白(immunoglobulin,Ig)M、IgG、IgA试剂盒 北京方程佰金科技有限公司;小鼠白细胞介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、巨噬细胞炎性蛋白-2(macrophage inflammatory protein-2,MIP-2)、正常T细胞表达与分泌调节活化因子(regulated upon activation normal T cell expressed and secreted,RANTES)luminex试剂盒美国默克公司。
1.2 仪器与设备
EX623ZH千分之一天平、NVL5100B电子天平上海奥豪斯仪器有限公司;0.2 μm陶瓷微滤膜、超滤膜(截留相对分子质量2×103) 江苏久吾高科技股份有限公司;LRH-250F生化培养箱 上海一恒科学仪器有限公司;YXQ-LS-75SII高压灭菌器、SW-CJ-2FD超净工作台 上海博迅实业有限公司;X-30R台式高速冷冻离心机 美国Beckman公司;AKTA Pure蛋白质层析纯化系统 美国GE公司;BIO-PLEX3D新型液相芯片检测仪北京雅联百得科贸有限公司;Infinite 200 Pro Nanoquant酶标仪 瑞士Tecan公司。
1.3 方法
1.3.1 大豆低聚肽的制备
将大豆蛋白溶于蒸馏水中,使其充分溶解,配制成质量分数8%的蛋白溶液,调pH值至7.0,各加入质量分数0.1%的1 000 U/g中性蛋白酶和碱性蛋白酶,50 ℃水浴,水解4 h。水解结束后立即85 ℃灭活15 min,得到低聚肽酶解液。冷却后40 ℃、0.6 bar通过复合膜(陶瓷微滤膜与超滤膜)过滤提纯[16],得到大豆低聚肽及膜分离副产物。通过0.12 mbar、-42 ℃真空冷冻干燥30 h得到冻干大豆低聚肽粉末。
1.3.2 大豆蛋白及大豆低聚肽的SDS-PAGE分析
质量分数12%分离胶、质量分数5%浓缩胶,样品质量浓度约1 μg/μL,上样量10 μL/孔,电压80 V条件下进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),以三色预染蛋白(分子质量为10~180 kDa)为标准蛋白。电泳结束后,经考马斯亮蓝染色、脱色后分析。
1.3.3 大豆低聚肽的分子质量分布
取大豆低聚肽冻干粉制成大豆肽溶液,过0.22 μm微滤膜。在蛋白质层析纯化系统中过Superdex peptide 10/300GL柱,用10 mmol/L Tris-HCl缓冲液,控制恒定流速0.5 mL/min,220 nm波长处检测。
1.3.4 负氮平衡老年小鼠模型制备
选取8 月龄清洁级雄性ICR小鼠,单笼饲养,适应性饲养一周后,分成普通饲料组(12 只)与低蛋白饲料组(36 只)。普通饲料组饲喂蛋白质量分数为20%的普通饲料,低蛋白饲料组饲喂蛋白质量分数为1.5%的低蛋白饲料,自由采食饮水,饲喂2 周,构建负氮平衡老年小鼠模型。每3 d记录体质量一次,在饲喂2 周后,每组各取5 只小鼠放入代谢笼中饲养,收集小鼠24 h的粪便和尿液样品,同时记录摄食量,测定粪便和尿液中氮的质量以及氮摄入量,同时对小鼠进行尾尖采血,收集血清样本,测定血清中血清总蛋白(total protein,TP)与血清白蛋白(serum albumin,ALB)的质量浓度。分别按式(1)、(2)计算每只小鼠的氮平衡量和蛋白质表观消化率[17-18]。

1.3.5 金黄色葡萄球菌培养
将金黄色葡萄球菌划线接种于营养琼脂培养基上,37 ℃培养过夜,挑取单个菌落,接种至新鲜营养肉汤中,37 ℃恒温摇床100 r/min培养20 h后,平板计数法计算菌液浓度,用营养肉汤系列稀释至菌液浓度约1×108CFU/mL,离心收集菌体,以生理盐水洗涤悬浮,备用[19]。
1.3.6 小鼠的分组及处理
将48 只小鼠分为4 组,每组12 只,单笼饲养,自由采食饮水,室温保持(25±1)℃。分别为空白组(饲喂普通饲料的正氮平衡小鼠,灌胃生理盐水)、模型组(饲喂低蛋白饲料的负氮平衡小鼠,灌胃生理盐水)、蛋白组(饲喂低蛋白饲料的负氮平衡小鼠,灌胃大豆蛋白)、低聚肽组(饲喂低蛋白饲料的负氮平衡小鼠,灌胃大豆低聚肽),各组灌胃量为0.4 mL,蛋白组与低聚肽组灌胃液体总含氮量相等,以体质量计为650 mg/kg。
将所有小鼠以1%戊巴比妥钠(80 mg/kg)麻醉后,于小鼠背部手术区剪毛,在小鼠背部脊柱两侧,切除1 cm×1 cm的全层皮肤及皮下组织,破坏肌膜,取金黄色葡萄球菌菌液0.1 mL,均匀涂抹于整个创面,观察小鼠创面感染情况[19]。创伤涂抹金黄色葡萄球菌后每日对小鼠灌胃,每组于连续灌胃第3天与第7天分别处死6 只小鼠。
1.3.7 小鼠的处死及血清的制备
于灌胃的第3天和第7天小鼠眼球取血后处死,血液置于4 ℃静置过夜,3 000 r/min离心15 min,分离上清液得到血清收集于灭菌离心管中,于-70 ℃保存。
1.3.8 小鼠血清免疫因子的测定
取保存的血清,以酶联免疫吸附测定法测定负氮平衡老年小鼠血清IgM、IgG、IgA质量浓度,按照luminex试剂盒要求以流式荧光技术测定免疫炎症因子(IL-1β、IL-6、TNF-α)及趋化因子(MIP-2、RANTES)质量浓度。
1.3.9 小鼠股直肌湿质量与体质量比的测定
剥离小鼠右腿股直肌肌肉组织,称其湿质量,按式(3)计算股直肌湿质量与体质量比。

1.4 数据处理
所有数据均以 ±s表示。采用SPSS Statistics 22软件进行统计分析。多组均数进行方差齐性检验和单因素方差分析(ANOVA)和多重比较(Duncan’s法),P<0.05为差异显著。
2 结果与分析
2.1 大豆低聚肽的SDS-PAGE分析

图1 大豆蛋白与大豆低聚肽的SDS-PAGE图谱Fig. 1 SDS-PAGE pattern of soybean protein and soybean oligopeptides
由图1可知,大豆蛋白经复合酶水解后,酶解产物分子质量远低于大豆蛋白,酶解产物中主要肽段分子质量低于10 kDa,表明大豆蛋白大部分已被酶解为小分子低聚肽。本实验选用Marker分子质量范围是10~180 kDa,同时SDS-PAGE凝胶电泳不容易分离分子质量在4 kDa以下的小肽,所以酶解液中低于10 kDa的肽段没有得到明显的分离。酶解产物经过复合膜组合的方式进行分离提纯,减少大分子肽和未酶解蛋白的混入,得到纯度更高的低聚肽。
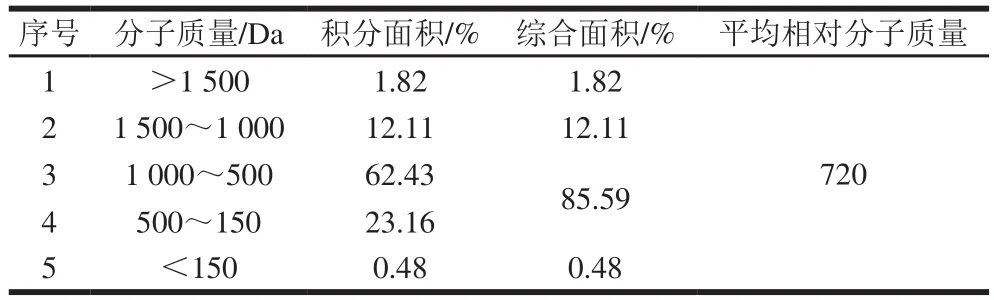
表1 大豆低聚肽的分子质量分布Table 1 Molecular mass distribution of soybean oligopeptides
由表1可知,经过蛋白层析纯化系统分析,有85.59%大豆低聚肽分子质量分布在150~1 000 Da之间。
2.2 负氮平衡制备期老年小鼠体质量的变化
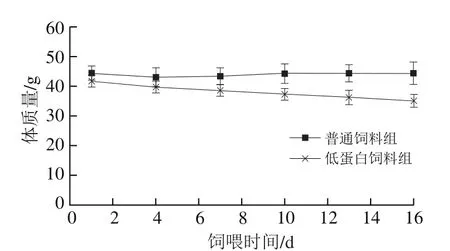
图2 负氮平衡制备期小鼠体质量的变化Fig. 2 Change in body mass of mice during negative nitrogen balance
小鼠体质量的下降是负氮平衡的重要生理指标之一。实验期间,两组小鼠的饲料摄入总量无显著差异(P>0.05),由图2可知,低蛋白饲料组小鼠的体质量明显下降,从第7天开始,低蛋白饲料组小鼠体质量显著低于普通饲料组,且随时间延长差异逐渐增大。实验结果表明,低蛋白饲料饲喂小鼠可影响其正常的生长发育,造成体质量降低。研究发现,给大鼠饲喂低蛋白饲料,会使低蛋白组大鼠体质量显著低于正常饲料组[20-21]。
2.3 负氮平衡制备期小鼠氮代谢相关指标的测定结果
机体摄入食物中的含氮营养物质经消化、吸收与代谢,一部分沉积在体内或被利用,合成机体内的蛋白物质,另一部分代谢为废物随尿等排出,构成机体的氮代谢[22]。氮平衡是评估蛋白质代谢状况最常用和最有效的指标[23]。

表2 第14天小鼠氮代谢相关指标的变化Table 2 Changes in nitrogen metabolism indexes of mice on day 14
由表2可知,在负氮平衡制备期第14天,普通饲料组小鼠氮代谢呈正氮平衡,而低蛋白饲料组呈负氮平衡。普通饲料组小鼠蛋白质表观消化率为(81.31±7.00)%,低蛋白饲料组小鼠蛋白质表观消化率为(54.35±4.35)%。两组小鼠氮平衡与蛋白质表观消化率均有显著性差异(P<0.05)。低蛋白饲料组小鼠氮排泄量多于氮摄入量,表明体蛋白合成率相对减少或降解率相对增加,体内营养物质、肌肉被过度消耗,造成体内氮平衡处于负值,并造成体质量降低。由于低蛋白饲料组小鼠氮摄入量很少,使得无氮膳食期的粪代谢氮对表观消化率的影响变大,故低蛋白饲料组的蛋白质表观消化率显著降低。
2.4 负氮平衡制备期小鼠血清蛋白质量浓度的测定结果
TP反映机体的蛋白质营养状况及肝脏合成功能等情况。ALB是TP的主要蛋白质成分,由肝脏合成。TP、ALB可代表体内蛋白质代谢及营养状况[24]。ALB半衰期长,约20 d,且其影响因素较多,可能对蛋白质代谢和营养状况的短期变化不敏感[25]。
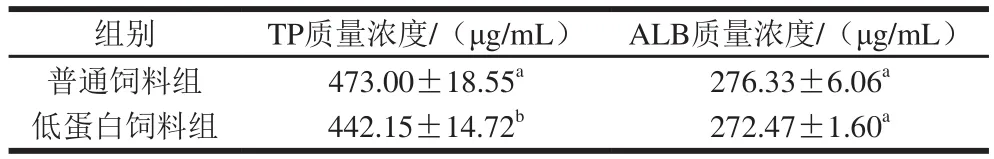
表3 第14天小鼠血清蛋白质量浓度的变化Table 3 Change in serum proteins of mice on day 14
由表3可知,在负氮平衡制备期第14天,低蛋白饲料组小鼠TP显著低于普通饲料组(P<0.05),且其ALB质量浓度低于普通饲料组但差异不显著(P>0.05)。实验结果表明低蛋白饲料饲养的小鼠体内氮代谢发生改变,由于含氮营养物质摄入不足,导致蛋白质合成率降低,使体内TP质量浓度降低。本研究通过对老年小鼠饲喂低蛋白饲料制备负氮平衡老年小鼠模型,通过2 周低蛋白饲料饲养,对两组小鼠的体质量、体内氮代谢及血清蛋白质量浓度进行分析,可判断负氮平衡老年小鼠模型建立成功。
2.5 大豆蛋白与大豆低聚肽对小鼠血清免疫球蛋白的影响
血清免疫球蛋白在体液免疫中发挥重要作用,是介导体液免疫的主要抗体,在一定程度上反映了体液免疫水平[26]。IgM约占抗体总量的5%~10%,因其分子质量极大,故仅限在血管内运行,是初次体液免疫应答早期阶段产生的主要抗体,具有较强的抗感染作用。IgG是机体再次体液免疫应答产生的主要抗体,是血液中含量最高的一种抗体,在机体防御机制中发挥抗感染作用,约占抗体总量的80%~85%。IgA的含量仅次于IgG,约占抗体总量的10%,是少数在消化道中不被消化的蛋白质之一。IgA在保护肠道、呼吸道、泌尿生殖道、乳腺和眼睛抵抗微生物入侵方面起关键作用,能凝集颗粒性抗原和中和病毒[27]。

表4 大豆蛋白与大豆低聚肽对小鼠血清免疫球蛋白的影响(n=6)Table 4 Effect of soybean protein and soybean oligopeptides on serum Ig levels in mice (n= 6)
通常IgM、IgG、IgA这3 类免疫球蛋白水平就可以代表血清免疫球蛋白的总体水平[28]。由表4可知,蛋白组、低聚肽组与模型组相比较,可显著提高IgM与IgG的质量浓度(P<0.05);蛋白组、低聚肽组与空白组相比较,可显著提高IgG的质量浓度(P<0.05),说明大豆蛋白和大豆低聚肽的蛋白营养补充支持作用可显著提高负氮平衡老年小鼠感染后体液免疫功能。在感染第7天,低聚肽组IgG水平显著高于蛋白组(P<0.05),低聚肽组IgM与IgA水平高于蛋白组但差异不显著(P>0.05),说明大豆低聚肽的营养补充作用对负氮平衡老年小鼠感染后体液免疫的提高优于大豆蛋白。张为鹏等[29]在猪饲料中分别补充血浆蛋白粉和植物活性肽,显著提高了血清中IgG抗体的水平(P<0.05)。B细胞在抗原刺激下可分化为浆细胞,合成和分泌免疫球蛋白,血清免疫球蛋白的变化能及时反应B细胞的数量及活性。杨小军[30]在实验中对大鼠灌胃植物源面筋蛋白酶解活性肽,提高了大鼠IgA的水平,显著提高了血凝抑制效价,促进了大鼠的体液免疫,推测肽作为B细胞刺激因子或活化辅助受体而起作用。B细胞表面有很多受体,肽可能刺激B细胞,发生增殖、分化,进入激活状态,转化为浆细胞,产生抗体[31]。本研究中大豆蛋白与大豆低聚肽也可能通过作用于B细胞膜表面受体,调节细胞活性,从而提高小鼠体液免疫水平。
2.6 大豆蛋白与大豆低聚肽对小鼠血清炎症因子的影响
微生物感染的炎症反应的一个主要特征就是细胞因子的释放,这些因子在宿主对抗感染和炎症的免疫应答中起着重要的作用。在炎症反应过程中,IL-1β、IL-6和TNF-α的水平会迅速增加[32]。IL-1β、IL-6和TNF-α的表达对免疫系统是必不可少的,但是过多的分泌会导致全身的炎症[33]。
IL-1β对宿主免疫系统抵抗金黄色葡萄球菌感染时有显著的调节作用。IL-6在感染过程中是一种重要的促炎细胞因子,它与炎症反应中的多种生物效应有关。TNF-α被认为是炎症指标中的一个主要细胞因子[34]。
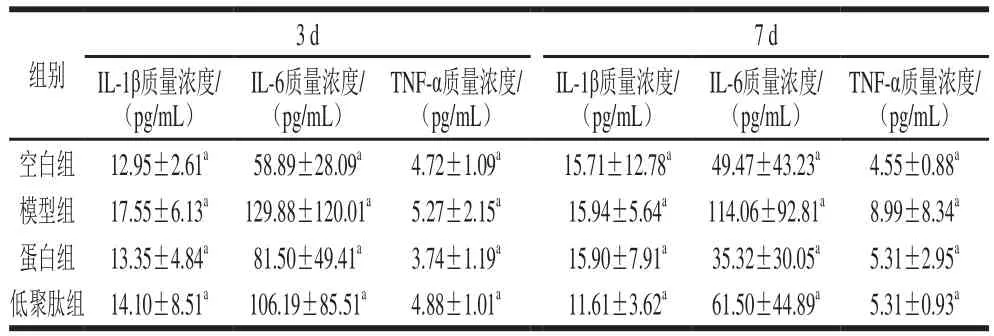
表5 大豆蛋白与大豆低聚肽对小鼠血清炎症因子的影响Table 5 Effect of soybean protein and soybean oligopeptides on serum inflammation factors in mice
由表5可知,模型组与空白组比较,IL-1β、IL-6和TNF-α 3 种炎症因子质量浓度有不同程度的升高,但差异不显著(P>0.05),说明模型组小鼠炎症水平有一定升高;蛋白组、低聚肽组与模型组相比较,3 种炎症因子质量浓度有所降低,但是差异不显著(P>0.05),IL-6质量浓度降低最为显著,接近空白组质量浓度。对胃癌术后患者进行肠内免疫营养干预,可有效降低炎症指标(IL-1β、IL-6和TNF-α)水平[35]。对脂代谢紊乱大鼠给予含大豆蛋白饲料,显著降低了大鼠血清IL-6与TNF-α质量浓度[36]。实验结果表明灌胃大豆蛋白与大豆低聚肽对炎症水平的抑制有积极作用,对IL-6的抑制作用较为强烈。
2.7 大豆蛋白与大豆低聚肽对小鼠血清趋化因子的影响
MIP-2是炎症早期的促炎性细胞因子,其在炎症早期的短期急剧释放可能趋化和激活多种炎症细胞,当机体局部有炎症时能够趋化单核细胞向炎症部位聚集[37]。RANTES具有迁移细胞的作用,对活化T淋巴细胞、粒细胞、单核细胞、自然杀伤细胞具有趋化和刺激作用,诱导其向炎症部位浸润,发挥杀伤作用[38]。
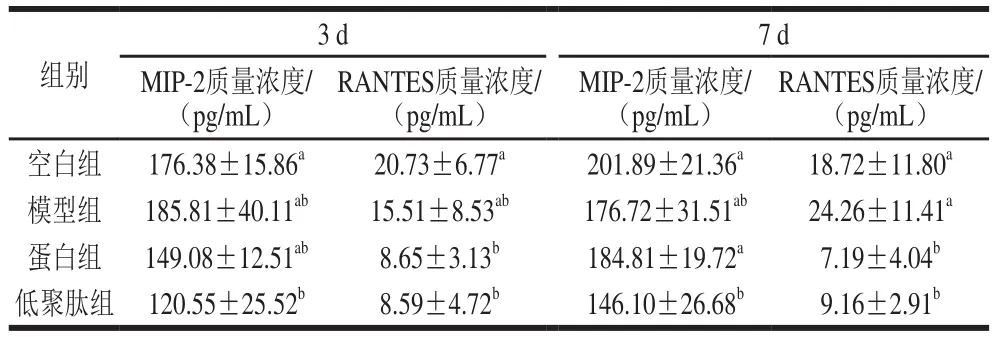
表6 大豆蛋白与大豆低聚肽对小鼠血清趋化因子的影响Table 6 Effect of soybean protein and soybean oligopeptides on serum chemokines in mice
由表6可知,与空白组比较,低聚肽组MIP-2质量浓度显著降低31.7%(P<0.05),而蛋白组降低水平不显著,说明大豆低聚肽较大豆蛋白吸收转化速率快,可对炎症早期起作用的MIP-2起到良好的抑制作用;蛋白组、低聚肽组与空白组、模型组相比,可显著降低RANTES水平(P<0.05),说明大豆蛋白与大豆低聚肽的营养补充支持作用可有效抑制炎症趋化因子的生成,降低炎症水平。蒋莉娅等[39]发现大鼠降低MIP-2以及MIP-2 mRNA生成水平,可缓解机体炎症,保护大鼠急性胰腺炎早期肺损伤。本实验结果表明大豆蛋白与大豆低聚肽的营养补充作用可显著抑制MIP-2与RANTES的质量浓度,防止过度的分泌造成组织损伤与过度炎症,大豆低聚肽由于吸收速度快,转运耗能少,其营养补充可在炎症早期有效抑制过度的炎症反应。
2.8 大豆蛋白与大豆低聚肽对小鼠股直肌质量的影响
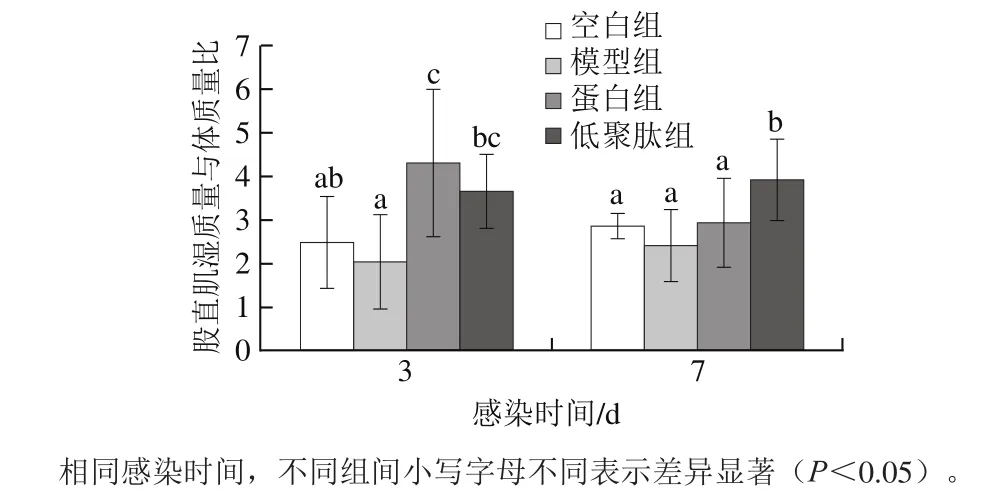
图3 小鼠股直肌湿质量与体质量比Fig. 3 Ratio of rectus femoris and body mass in mice
由图3可知,蛋白组、低聚肽组小鼠的股直肌湿质量与体质量比均高于模型组与空白组;在感染第3天,蛋白组、低聚肽组股直肌湿质量与体质量比均显著高于模型组(P<0.05),蛋白组与低聚肽组无显著差异(P>0.05);在感染第7天,低聚肽组股直肌湿质量与体质量比为3.93,显著高于蛋白组(2.91)(P<0.05)。实验结果表明大豆蛋白与大豆低聚肽的营养补充,可显著提高股直肌湿质量与体质量比,改善老年小鼠因负氮平衡引起的肌肉萎缩状况,大豆低聚肽由于吸收速度快,利用率高,作用优于大豆蛋白。负氮平衡和炎症情况会使骨骼肌中蛋白质降解增加,氨基酸进入血浆中合成免疫细胞因子,参与免疫系统的调节,机体将本用于生长和骨骼肌沉积的营养物质用于维持体内激活的免疫系统,导致骨骼肌分解加速,蛋白质合成速度减慢[40]。与大豆蛋白相比,大豆低聚肽因为在肠黏膜上的转运载体不易饱和,转运能耗低,转运速度快[41],可增强机体氨基酸吸收代谢,使体蛋白分解代谢减少,增加体氮沉积,缓解肌肉萎缩状况。
3 结 论
本研究采用低蛋白饲料饲喂小鼠从而引起小鼠体内负氮平衡状态,通过小鼠体质量、体内氮平衡、血清蛋白等结果验证负氮平衡老年小鼠模型造模成功。对负氮平衡老年小鼠进行背部创伤感染金黄色葡萄球菌,通过灌胃大豆蛋白与大豆低聚肽,显著提高了小鼠血清IgM、IgG、IgA质量浓度,降低了血清炎症因子IL-1β、IL-6、TNF-α的质量浓度,降低了血清RANTES、MIP-2质量浓度,显著提高了股直肌质量,表明大豆蛋白与大豆低聚肽能提高金黄色葡萄球菌感染下负氮平衡老年小鼠体液免疫水平,降低其炎症水平,缓解并恢复肌肉萎缩状况,大豆低聚肽较大豆蛋白能更有效地提高体液免疫水平,并在炎症早期显著抑制炎症反应,提高短期应激能力。
