茶花粉的抗氧化活性及其对急性酒精肝损伤的保护作用
2018-09-26彭国霞赵浩安刘清清
彭国霞,赵浩安,刘清清,张 颖,程 妮,2,曹 炜,2,*
酗酒是引发肝脏疾病的因素之一。近年来,由于饮酒频率的增加及饮食结构的改变,我国酒精肝的发病率已经明显升高,成为除病毒性肝炎以外又一严重威胁人类健康的肝病[1],引起了社会的高度重视。因此,寻找防治肝病的无副作用的天然药物显得尤为迫切。研究表明,许多天然食物具有保肝活性,蜂花粉就是其中的一类,如已经被报道的油菜花粉和马尾松花粉等[2-5]。
蜂花粉是蜜蜂从植物花药上采集花粉并添加了少量唾液后加工而形成的饼状物[6],素有“天然营养库”之称。已有研究表明蜂花粉中含有250多种物质,包括脂质(甘油三酯)、脂肪酸、氨基酸、维生素、矿物质、酚类以及类黄酮等物质[6-8],具有抗氧化、抑菌、抗病毒、抗炎以及增强免疫力等功效[9]。因此,蜂花粉作为传统药物和保健食品已经得到广泛应用[10]。茶花粉是蜂花粉的一种,主产于中国,因其具有味甜可口、气味清香等特点,深受消费者的青睐。Kao等[11]的研究发现,茶花粉具有较强的抗氧化活性,并含有多种酚类及黄酮类化合物,如没食子酸、阿魏酸、咖啡酸、儿茶素和芦丁等。Yildiz等[12]证明天然食物中的多酚和黄酮类物质与其保肝的活性有关,但是到目前为止,关于茶花粉保肝功效的研究鲜见报道。
本实验测定了5 个不同产地茶花粉中总酚和总黄酮的含量,采用体外法研究了茶花粉的抗氧化活性,在此基础上,以小鼠为实验对象,研究了茶花粉对酒精诱导的急性肝损伤的保护作用,旨在为蜂花粉保肝功能性食品的开发提供理论依据。
1 材料与方法
1.1 材料、试剂与实验动物
不同产地(湖南、安徽、浙江、四川、江西)茶花粉由当地蜂农提供;芦丁、福林-酚试剂、没食子酸、水溶性VE(Trolox)、2,4,6-三(2-吡啶基)三嗪(2,4,6-tri-2-pyridyl-s-triazin,TPTZ)、1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-azobis(2-methylpropionamidine) dihydrochloride granular,AAPH)美国Sigma-Aldrich公司;谷草转氨酶(aminotransferase,AST)、谷丙转氨酶(aspartate aminotransferase,ALT)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化酶(glutathione peroxidase,GSH-Px)、考马斯亮蓝试剂盒 南京建成生物工程研究所;所有其他试剂均为分析纯。
昆明小鼠(SPF级,雄性,4 周龄,(20±2)g)购于西安交通大学实验动物学部,动物饲养和实验符合中华人民共和国科学技术部颁发的管理规定(生产许可证号:SCXK 2012-003)。饲养条件:室温(25±2)℃,相对湿度(50±10)%。
1.2 仪器与设备
L5S紫外-可见分光光度计 上海仪电分析仪器有限公司;Infinite 200 PRO多功能读板机 帝肯(上海)贸易有限公司;TGL16G离心机 上海化工机械厂有限公司。
1.3 方法
1.3.1 样品液的制备
称取1.16 g粉碎后的茶花粉于圆底烧瓶中,加入20.0 mL乙醇,热回流提取2 h,静置一段时间后,取上清液用于实验。
1.3.2 茶花粉中总酚含量的测定
参照Hinneburg等[13]的方法并略作修改。取400 μL的茶花粉提取液于10 mL棕色具塞试管内,加入5.0 mL Na2CO3溶液(1 mol/L)和1.0 mL福林-酚显色剂,加蒸馏水至刻度线,摇匀,暗室反应1 h后在760 nm波长处读取吸光度。以没食子酸作标准曲线,得回归方程为y=0.019+0.120x(R2=0.995 7),没食子酸在质量浓度为0~5.0 μg/mL范围之间呈良好的线性,以该标准曲线计算茶花粉中的总酚含量,结果以每克茶花粉相当于没食子酸的质量计(mg/g)。
1.3.3 茶花粉中总黄酮含量的测定
参照孙丽萍等[14]报道的方法。取1.0 mL茶花粉提取液于盛有聚酰胺粉的蒸发皿中,通过水浴加热(50 ℃)除去乙醇,将该聚酰胺粉转至层析柱。先用20.0 mL苯液进行洗脱除去杂质,再用20.0 mL甲醇洗脱,收集洗脱液并定容至25.0 mL,在360 nm波长处测吸光度。以芦丁作标准曲线,得回归方程为y=-0.000 9+0.033 4x(R2=0.997 2),芦丁在0~25.0 μg/mL之间呈良好的线性,以该回归方程计算茶花粉中的总黄酮含量,结果以每克花粉相当于芦丁的质量计(mg/g)。
1.3.4 茶花粉的DPPH自由基清除活性
参照Cheng Ni等[15]的方法进行测定。取5.0 mL DPPH甲醇溶液(0.04 mg/mL)于10 mL棕色具塞试管内,分别加入600 μL不同质量浓度(0.2~0.6 mg/mL)的茶花粉提取液,加甲醇至刻度线,摇匀。暗室反应1 h后在波长517 nm处读取吸光度A样品,以加入600 μL甲醇试剂的溶液作为空白对照读取吸光度A空白。DPPH自由基清除率按照公式(1)进行计算。
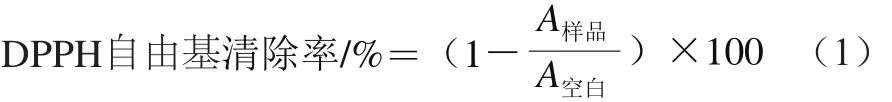
1.3.5 茶花粉的FRAP测定
Fe3+总还原力(ferric reducing antioxidant power,FRAP)的测定参考Benzie等[16]的方法并稍作改进。配制300 mmol/L的醋酸钠缓冲液、10 mmol/L的TPTZ溶液、20 mmol/L的FeCl3溶液,将上述溶液按照10∶1∶1(V/V)的比例混合为工作液,避光保存。移取200 μL质量浓度为10 mg/mL的花粉提取液于10 mL容量瓶内,加入2.8 mL的工作液,蒸馏水定容,反应10 min后在593 nm波长处读取吸光度。以Trolox做标准曲线,从而评估茶花粉的FRAP,结果以每克茶花粉相当于Trolox的质量计(mg /g)。
1.3.6 酒精诱导的急性肝损伤模型。
将65 只体质量为18~22 g的昆明小鼠(雄鼠)随机分为5 组(表1),正常组、模型组、高剂量组各15 只,低剂量组和阳性对照组各10 只。连续灌胃7 周,每日2 次。第50天灌胃酒精造成急性肝损伤,酒精剂量为5.0 g/kg,空腹(禁食不禁水)16 h后称质量,并在眼球取血后处死,同时收集血液及肝脏组织备用。若模型组小鼠血清中AST和ALT活力显著高于正常组小鼠,说明建模成功[17]。
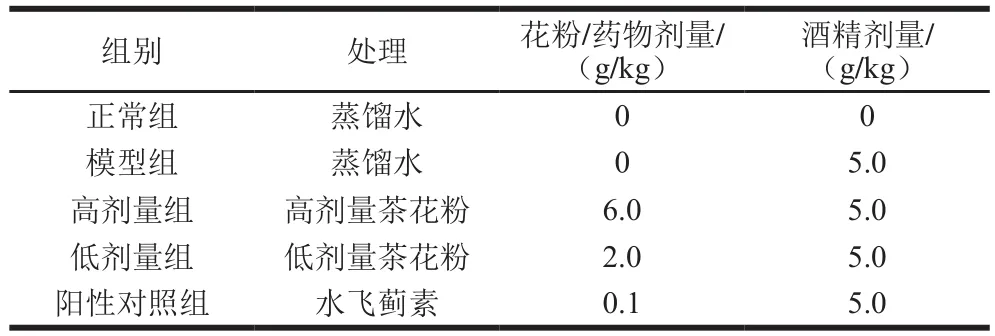
表1 小鼠分组情况Table 1 Grouping of mice
1.3.7 茶花粉对小鼠血清ORAC的影响
茶花粉对小鼠血清氧自由基吸收能力(oxygen radical absorbance capacity,ORAC)的测定参照Wang Yuan等[18]的方法进行。用75 mmol/L pH 7.0的磷酸盐缓冲液(phosphate buffered saline,PBS)配制78 nmol/L的荧光素二钠溶液(fluorescein disodium salt,FL)和221 mmol/L的AAPH溶液。在1.3.6节中的小鼠灌胃第45天后通过眼球取血的方法分别取5 只正常组小鼠和5 只高剂量组小鼠的血清备用,并且在实验前稀释150 倍。在黑色96 孔板中,阴性对照组每孔加入50 μL FL+50 μL PBS;正常组加入50 μL FL+50 μL正常组小鼠血清;高剂量花粉组加入50 μL FL+50 μL高剂量组小鼠血清,37 ℃温育15 min后,各组均加入25 μL AAPH溶液并摇匀。在激发波长为485 nm、发射波长为535 nm的条件下测定荧光强度,每5 min测定一次,直到荧光强度达到初始荧光强度的5%,从而得到荧光衰减曲线。通过曲线下面积来评估茶花粉对小鼠血清ORAC的影响。
1.3.8 茶花粉对Cu2+诱导的小鼠血清氧化损伤的影响
参照Hodgson等[19]的测定方法。制备浓度为2×10-4mol/L的CuSO4溶液,取1.3.7节中的血清并稀释200 倍后备用,在96 孔板中,正常组每孔加入250 μL正常组小鼠血清+16 μL CuSO4溶液,高剂量茶花粉组加入250 μL高剂量组小鼠血清+16 μL CuSO4溶液,37 ℃温育,每10 min读取一次吸光度,直到吸光度不再发生变化。根据曲线下面积S评估茶花粉对Cu2+诱导的小鼠血清氧化损伤的影响,结果以抑制率表示。抑制率按照公式(2)进行计算。

1.3.9 茶花粉对小鼠血清中AST和ALT活力的影响
将1.3.6节中采集的血液置于1.5 mL离心管中,4 ℃ 3 500 r/min离心10 min获得小鼠血清,用AST和ALT试剂盒测定血清中转氨酶的活力。
1.3.10 茶花粉对小鼠肝脏指数的影响
将1.3.6节中收集的肝脏组织用预先冷却的生理盐水清洗以除去血液,滤纸吸干并称质量。肝脏指数按式(3)计算。

1.3.11 茶花粉对小鼠肝脏中MDA含量的影响
取1.3.6节中收集的肝组织0.5 g于玻璃匀浆管内,加入4.5 mL生理盐水,研磨至组织匀浆化,得到质量分数10%的肝匀浆用于测定MDA含量。本实验采用MDA试剂盒测定,结果以nmol/mg计。
1.3.12 茶花粉对小鼠肝脏中SOD活力的影响
用生理盐水将1.3.11节中的肝匀浆稀释至质量分数0.5%,通过SOD试剂盒测定SOD活力,结果以U/mg计,其中每毫克组织蛋白在1 mL反应液中SOD抑制率达到50%时所对应的SOD量为1个SOD活力单位(U)。
1.3.13 茶花粉对小鼠肝脏中GSH-Px活力的影响
用生理盐水将1.3.11节中的肝匀浆稀释至质量分数0.25%,通过GSH-Px试剂盒测定,结果以U/mg计,规定每毫克蛋白每分钟扣除非酶反应的作用,使反应体系中还原型谷胱甘肽浓度降低1 μmol/L为1 个酶活力单位(U)。
1.3.14 肝脏组织病理学染色观察
取肝脏的左小叶保存在体积分数10%的甲醛溶液中24 h,经过酒精脱水和石蜡包埋后用病理切片机进行切片,厚度为5 μm。将该切片再次经过脱水、脱蜡后用苏木精-伊红染色,光学显微镜下观察。
1.4 数据处理与分析
本研究采用SAS软件进行统计学显著性检验,多组间比较用单因素方差分析方法,两两比较采用Tukey’s检验,数据均以 ±s表示,P<0.05时认为存在显著性差异。
2 结果与分析
2.1 不同产地茶花粉总酚和总黄酮的含量
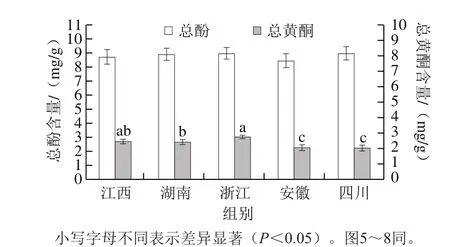
图1 不同产地茶花粉总酚和总黄酮的含量Fig. 1 Total polyphenolic and total flavonoid contents of C. japonica bee pollen from five geographical origins in China
本研究测定了不同产地茶花粉的总酚和总黄酮含量。由图1可知,不同产地茶花粉的总酚含量没有显著性差异(P>0.05),但产自浙江的茶花粉的总黄酮含量最高并且显著高于湖南、安徽和四川3 个省份(P<0.05),总黄酮含量依次为:浙江>江西>湖南>安徽>四川。结果表明产地不同,茶花粉的总黄酮含量也不同。由于多酚和黄酮类化合物的含量与天然食物的抗氧化活性相关[20],因此,本实验以浙江茶花粉为原料,进一步研究茶花粉的体外抗氧化活性。
2.2 茶花粉的DPPH自由基清除能力
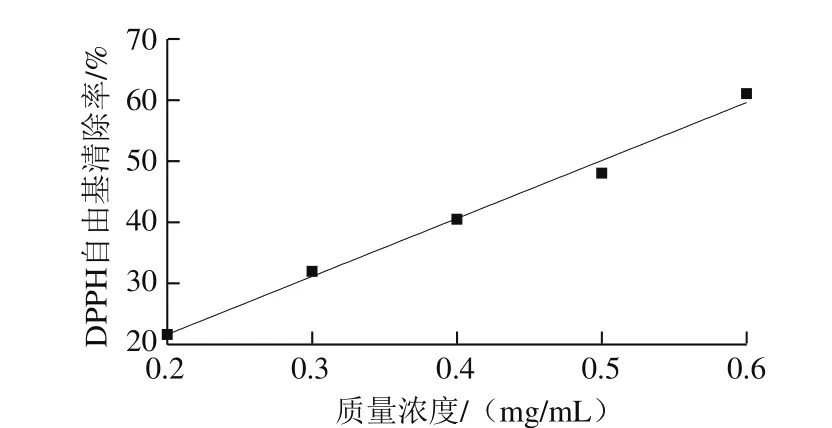
图2 茶花粉的DPPH自由基清除自由基能力Fig. 2 DPPH radical scavenging capacity of C. japonica bee pollen
DPPH自由基清除能力是评价天然产物抗氧化活性的常用指标,DPPH溶于甲醇后呈紫色,当样品中存在抗氧化剂时可与其反应生成联苯-苦味肼,紫色褪去,因此可以根据紫色褪去的程度来评价抗氧化剂对自由基的清除能力[21]。由图2可知,茶花粉的DPPH自由基清除率与其质量浓度呈正相关,其回归方程为y=94.936x+2.646(R2=0.992 2),并且通过计算得出其半抑制浓度为0.50 mg/mL。结果表明茶花粉具有较强的DPPH自由基清除能力。
2.3 茶花粉的FRAP
FRAP是一种评价抗氧化剂还原力的常用方法。当样品中存在还原剂时,铁离子转化为蓝色的亚铁形式,可以通过对该亚铁离子络合物进行定量分析计算茶花粉的还原力。在本研究中,当Trolox的质量浓度在0.6~3.0 μg/mL时,对应的回归方程为y=0.135 2x+0.080 1(R2=0.995 0),把实验结果带入该方程得出,1 g茶花粉的FRAP相当于(5.37±0.53)mg Trolox。
2.4 茶花粉对小鼠血清ORAC的影响
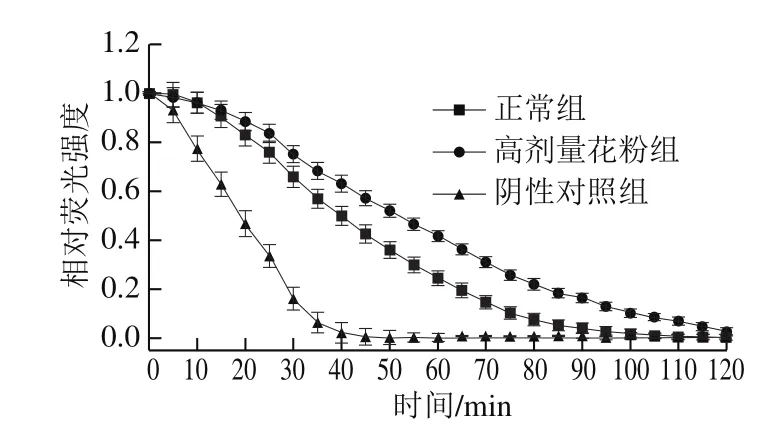
图3 茶花粉对小鼠血清ORAC的影响Fig. 3 Effect of C. japonica bee pollen on serum ORAC
在含氧的溶液中,FL会与AAPH产生的过氧自由基(ROO•)发生反应,使FL发生荧光猝灭。当溶液中存在抗氧化剂时,AAPH产生的ROO•与抗氧化剂提供的氢原子结合而被清除,从而抑制了荧光的猝灭,荧光衰减速率越慢表明样品的抗氧化能力越强[22]。从图3可以看出,与阴性对照组相比,正常组和高剂量花粉组均能抑制荧光的衰减速率,说明小鼠血清本身具有一定的抗氧化能力。灌胃高剂量的茶花粉后小鼠血清的抑制荧光衰减速率效果明显高于正常组,表明长期给小鼠灌胃茶花粉能够增强小鼠血清的抗氧化能力。
2.5 茶花粉对Cu2+诱导的小鼠血清氧化损伤的影响
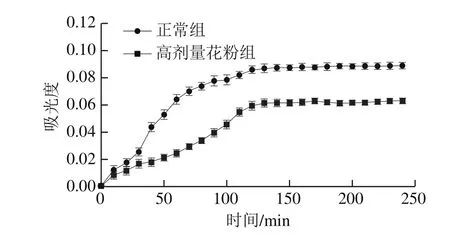
图4 茶花粉对Cu2+诱导的小鼠血清氧化损伤的影响Fig. 4 Effect of C. japonica bee pollen on Cu2+-induced oxidative damage in serum
在中性环境下,过渡金属Cu2+对血清脂蛋白有氧化修饰作用,加入抗氧化剂后可以抑制血清脂蛋白的氧化修饰作用。本研究通过在234 nm波长处监测4 h内氧化产物的生成量来评估茶花粉的抗氧化能力,结果如图4所示。相比于正常组,高剂量组的曲线下面积明显减小。表明长期灌胃茶花粉能够显著抑制Cu2+对小鼠血清脂蛋白的氧化修饰作用,抑制率为36.58%。
2.6 茶花粉对小鼠血清中AST和ALT活力的影响
AST和ALT活力是评价肝损伤的敏感生化指标。当肝细胞发生损伤时,肝脏中的AST和ALT渗入到血液中,使其含量超出正常范围[23]。如图5所示,与正常组小鼠相比,模型组小鼠血清中AST和ALT的活力急剧上升,分别达到54.65、51.54 U/L,是正常组的2.30 倍和2.94 倍。在给小鼠灌胃茶花粉后,与模型组相比,高剂量组和低剂量组小鼠血清中AST及ALT的活力均显著降低(P<0.05),并且高剂量组AST及ALT活力分别降低了47.47%和45.83%。结果表明茶花粉有明显的保肝功效。
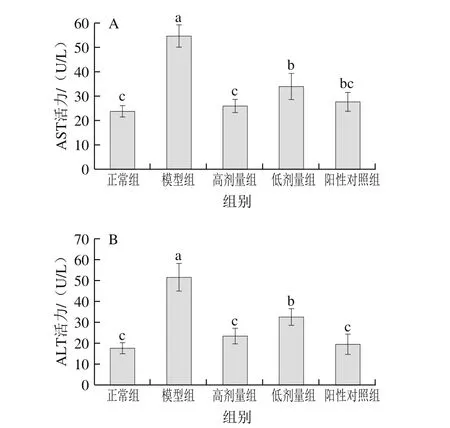
图5 茶花粉对小鼠血清AST(A)、ALT(B)活力的影响Fig. 5 Effect of C. japonica bee pollen on the activity of AST (A) and ALT (B) in serum
2.7 茶花粉对小鼠肝脏指数的影响
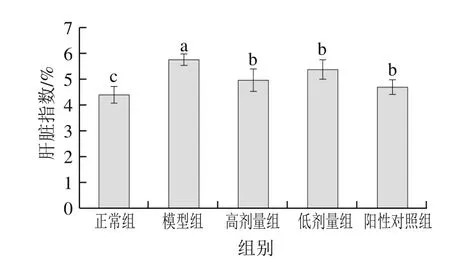
图6 茶花粉对小鼠肝脏指数的影响Fig. 6 Effect of C. japonica bee pollen on liver index
大量摄入酒精会引起肝损伤,导致肝脏肿大,从而使得肝脏的质量增加。如图6所示,相比于正常组小鼠,模型组小鼠的肝指数显著增大(P<0.05)。在给小鼠连续灌胃7 周水飞蓟素和茶花粉以后,相比于模型组小鼠,水飞蓟素组和茶花粉组的肝脏指数均显著降低(P<0.05),表明水飞蓟素和茶花粉均能缓解酒精对小鼠肝脏造成的损伤。
2.8 茶花粉对小鼠肝脏中MDA含量的影响
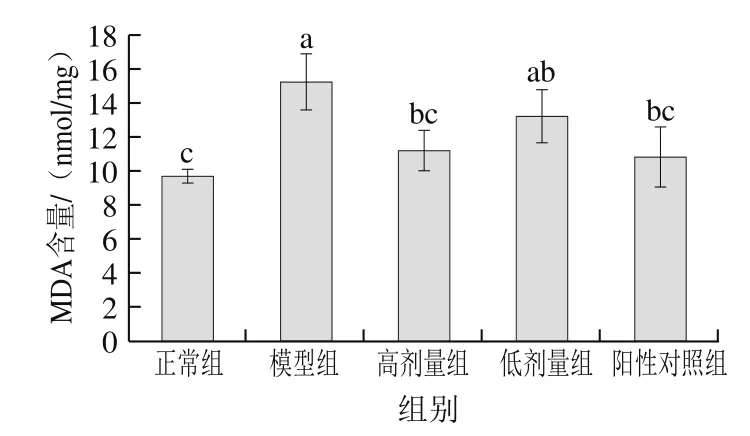
图7 茶花粉对小鼠肝脏中MDA含量的影响Fig. 7 Effect of C. japonica bee pollen on MDA content in liver
MDA作为脂质过氧化作用的产物,是评价肝损伤的重要生化指标,因此本研究通过测定小鼠肝脏组织中MDA的含量来评估酒精造成的肝损伤程度。如图7所示,相比于正常组,模型组小鼠肝脏组织中的MDA的含量显著升高(P<0.05),给小鼠灌胃水飞蓟素和高剂量茶花粉均能够显著抑制MDA的形成(P<0.05),且高剂量组的抑制率为26.93%。表明长期给小鼠灌胃茶花粉能够增强小鼠体内的抗氧化防御系统,从而预防酒精对肝脏造成的氧化损伤。
2.9 茶花粉对小鼠肝脏中SOD和GSH-Px活力的影响
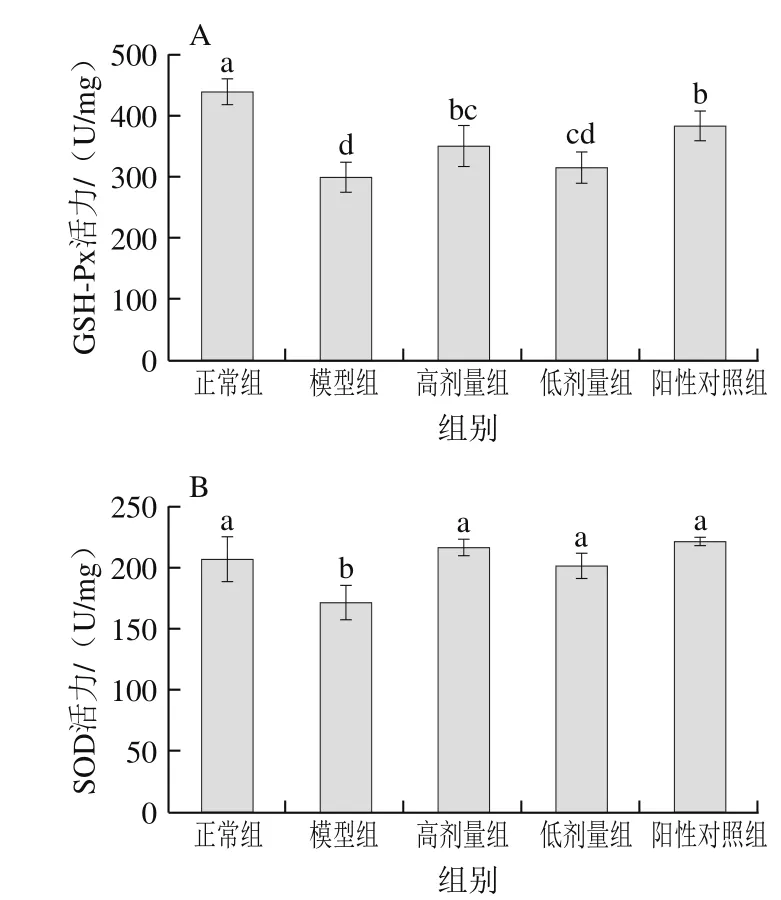
图8 茶花粉对小鼠肝脏中GSH-Px(A)和SOD(B)活力的影响Fig. 8 Effect of C. japonica bee pollen on the activity of GSH-Px (A) and SOD (B) in liver
SOD是机体内的一种酶促抗氧化剂,它能够与GSH-Px共同作用清除机体内的超氧自由基,从而保护细胞免受氧化损伤[18]。本研究通过测定小鼠肝脏中的SOD和GSH-Px活力研究茶花粉的保肝作用,结果如图8所示。模型组小鼠肝脏组织中的SOD和GSH-Px的活力均显著低于正常组小鼠(P<0.05),表明过量摄入酒精会降低肝细胞中SOD和GSH-Px的活力,这与Wang Mingchun等[24]的研究结果一致。在给小鼠连续灌胃7 周高剂量的茶花粉和水飞蓟素后,与模型组相比,阳性对照组和高剂量组小鼠肝脏组织中的SOD和GSH-Px活力均显著提高(P<0.05)。在低剂量组中,小鼠肝脏组织中SOD的活力亦显著提高(P<0.05)。结果表明,茶花粉能够增强小鼠肝脏组织中SOD和GSH-Px的活力。
2.10 肝脏组织病理学染色观察
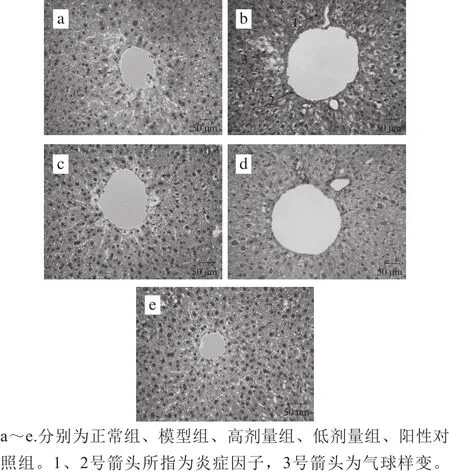
图9 小鼠肝脏切片组织病理学染色观察(×200)Fig. 9 Effect of C. japonica bee pollen on hepatic morphological analysis (× 200)
如图9a所示,正常组观察到规则性的肝细胞形态。在模型组中,可以观察到肝细胞有明显的炎症浸润和气球样变性,并且出现肝细胞点状坏死(图9b),表明酒精对肝细胞造成明显的损伤。与模型组相比,高剂量组中肝组织的炎症因子明显减少,肝损伤明显减轻,但仍见轻微的气球样变(图9c)。相比于模型组,在低剂量组中可以观察到肝组织的气球样变性明显减轻,但是仍然有大量炎症浸润(图9d)。在阳性对照组中,可以观察到肝细胞排列整齐,仅有少量炎症因子出现,无明显肝损伤(图9e)。
3 讨 论
蜂花粉因其含有丰富的营养物质和药用价值而闻名。近年来,对蜂花粉的功能性研究越来越多,其因具有降血脂、降血糖、抗动脉粥样硬化、治疗前列腺等功能而受到广泛关注。茶花粉作为蜂花粉的一种,在我国产量大,具有潜在的开发价值,但是到目前为止,关于茶花粉的功能性研究较少。在本研究中,通过一次性给小鼠灌胃酒精(5.0 g/kg)来建立急性酒精肝损伤模型,探究茶花粉的保肝功能,为茶花粉成为一种新型的保健食品提供理论依据。
多酚和黄酮类化合物是广泛存在于植物中的一类抗氧化剂[25],对天然食物的抗氧化活性起着重要的作用。本研究选取了浙江、安徽、江西、四川、湖南5 个地方的茶花粉测定其总酚和总黄酮含量,结果分别为8.41~8.97、2.23~3.01 mg/g,这与任乃艳[26]报道的茶花粉的总酚和总黄酮含量的结果(8.49、2.33 mg/g)几乎一致。DPPH自由基清除能力和FRAP体外实验结果表明,茶花粉具有较强的体外抗氧化活性,对人体健康有着非常重要的作用[27]。此外,本研究发现茶花粉能够提高小鼠的体内抗氧化能力,ORAC实验中,高剂量组小鼠血清对荧光猝灭的抑制效果高于正常组证明了这一点。同样,在Cu2+诱导的小鼠血清氧化损伤实验中,相比于正常组,高剂量组能够明显降低血清中脂蛋白氧化产物的形成,进一步表明茶花粉能够增强小鼠血清的抗氧化能力。
酒精在肝脏中的分解代谢会促进活性氧(reactive oxygen species,ROS)的产生,并且ROS在体内过度累积会引发肝细胞膜发生脂质过氧化而损伤肝细胞[28-29]。AST和ALT是存在于肝细胞中的转氨酶,当肝细胞发生损伤时,AST与ALT会被释放到血液中[23]。在本研究中,相比于正常组,模型组小鼠血清中的AST和ALT活力显著升高(P<0.05),但是在灌胃不同剂量(2.0、6.0 g/kg)的茶花粉后其活力均显著降低(P<0.05)。这可能与茶花粉中含有的芦丁等黄酮类物质具有降低肝损伤小鼠血清中AST和ALT活力的功能有关[30]。
SOD是机体内一种重要的清除ROS的酶,它能够促使体内的超氧阴离子自由基转化成过氧化氢,过氧化氢在过氧化氢酶和GSH-Px的作用下进一步分解成水。此外,MDA作为脂质过氧化和DNA氧化损伤的产物,也可以间接反映出肝细胞损伤的程度。本研究发现模型组中小鼠血清中SOD和GSH-Px的活力显著降低,MDA含量显著升高,表明给小鼠灌胃酒精会显著损伤机体的抗氧化防御系统,导致ROS的积累从而引发脂质过氧化。给小鼠灌胃茶花粉后,小鼠体内SOD和GSH-Px的活力显著增强,MDA含量显著降低,表明茶花粉能够提高小鼠体内抵御ROS攻击生物膜和生物大分子的氧化损伤的能力,这可能与茶花粉中的没食子酸和咖啡酸可以缓解氧化应激引起的炎症、增强小鼠体内SOD和GSH-Px的活力有关[31-32]。此外,组织病理学染色观察表明,茶花粉能够减轻酒精引起的肝细胞炎症浸润及肝细胞死亡。
综上所述,茶花粉中总酚和总黄酮含量丰富,具有较强的抗氧化活性。此外,小鼠体内实验表明,茶花粉能够降低小鼠血清中AST和ALT的活力,增强小鼠体内SOD和GSH-Px的活力,并降低脂质过氧化物MDA的含量。研究结果表明茶花粉对酒精诱导的急性肝损伤具有保护作用,因此,茶花粉既能成为一种新型的抗氧化食品,又可以作为一种制造保肝功能性食品的原料。但是本研究对茶花粉的活性成分和保肝的具体分子机制尚不清楚,有待进一步深入研究。
