脐带间充质干细胞治疗心脏扩大伴心力衰竭类心肌病病儿的效果
2018-09-26,3
,3
(青岛大学附属妇女儿童医院,青岛市妇女儿童医院,山东 青岛 266034 1 心脏中心; 2 儿童超声科; 3 重症医学中心)
扩张型心肌病(DCM)是一种以单心室/双心室球形扩大,并且伴有进行性心脏收缩功能减退的疾病[1]。小儿心肌病年发病率为(1.24~1.31)/10万,而DCM占其中一半以上,是引起儿童心力衰竭(简称心力衰竭)的重要原因之一[2]。约40% DCM病儿后期合并心力衰竭,最终不得不接受心脏移植,或者在诊断后的2年内面临死亡[3]。目前该病主要的治疗方法包括药物治疗、心脏起搏器置入以及心室减容成形术等[4],但都不能从根本上解决心肌细胞再生及心肌功能重建等问题[5]。脐带间充质细胞(UC-MSCs)的治疗为DCM伴有心力衰竭的病儿提供了一种崭新的及有益的尝试[6]。人UC-MSCs(hUC-MSCs)是成体干细胞的一种,具有较高自我更新能力[7],其来源丰富,具有多向分化潜能及移植后不良反应少等优点[8],是移植的“种子细胞”的理想来源。本研究通过对心肌病伴心力衰竭病儿接受hUC-MSCs治疗前后临床、相关检查及实验室指标的观察,评估hUC-MSCs对心肌病伴心力衰竭病儿的临床治疗效果,旨在为干细胞的治疗提供依据。
1 对象与方法
1.1 研究对象
纳入标准:①确诊心脏扩大伴有心力衰竭的心肌病,如DCM、心室肌致密化不全、心内膜弹力纤维增生症;②NYHA分级为Ⅱ~Ⅳ级或者具有等同于Ⅱ~Ⅳ级的症状;③左心室射血分数>20%;④已给予至少1次大剂量丙种球蛋白治疗,效果不佳;⑤治疗年龄为1月龄~18周岁;⑥病儿和(或)病儿家属签署知情同意书。排除标准:①具有持续性室性心动过速或颤动病史者;②植入心脏除颤器者;③潜在的心脏除颤器候选者;④其他:有晕厥病史、5年内患有肿瘤、活动性感染性疾病以及病毒性疾病实验阳性者等。本研究在clinicaltrails.gov网站注册编号为NT01219452,已报经医院伦理委员会批准。
符合入选条件的病儿共17例,男9例,女8例。其中诊断为DCM者4例,心肌致密化不全者12例,心内膜弹力纤维增生症者1例。NYHA心功能分级Ⅱ级者10例,Ⅲ级者5例,Ⅳ级者2例。初诊年龄为1~144个月,平均为(44.23±48.32)个月;hUC-MSCs治疗前的病程为3~120个月,平均为(29.29±27.03)个月。细胞治疗前存在端坐呼吸者5例,口唇发绀者2例;心脏听诊闻及奔马律者4例,肝脏肿大者4例,双下肢水肿者2例。细胞治疗前心电图存在多导联ST-T改变者17例,其中期前收缩(房性或室性)者4例,传导阻滞者4例。17例病儿均常规给予强心、利尿和扩血管药物治疗,所用药物为地高辛、双氢克尿噻或呋塞米、安体舒通、卡托普利或苯那普利;细胞治疗前,15例(88.2%)心肌病病儿给予β受体阻断剂(美托洛尔或卡维地洛)治疗,其疗程为1~120个月,平均(23.7±13.2)个月。17例病儿均给予丙种球蛋白治疗1~4次,其总剂量为2~6 g/kg;10例(58.8%)病儿给予激素治疗,其疗程为12~48个月,平均(25.9±12.2)个月。所有病儿细胞治疗前常规给予左卡尼丁口服液、维生素B1、维生素B2及辅酶Q10等治疗。
1.2 hUC-MSCs来源
hUC-MSCs由青岛奥克生物开发公司生产并提供,1 U hUC-MSCs含有1×107个细胞,流式细胞仪检测细胞表型为CD34(-)、CD45(-)、CD90(+)、CD105(+)、HLA-DR(-),符合间充质干细胞表型特征;乙型肝炎病毒、丙型肝炎病毒、梅毒螺旋体、支原体、巨细胞病毒和HIV检测均阴性;需氧菌培养和真菌培养阴性。
1.3 方法
hUC-MSCs的应用方法为肌肉注射,选取双上肢三角肌和双下肢股四头肌各1处为注射点;根据病儿年龄不同,每次肌肉注射剂量为0.5~1.0 U,每个月应用1次,连续给予2~3次。细胞治疗期间病儿继续应用抗心力衰竭等基础治疗药物,所用药物有地高辛、双氢克尿噻或呋塞米、安体舒通、卡托普利或苯那普利、左卡尼丁口服液、维生素B1、维生素B2及辅酶Q10等。
1.4 观察指标
细胞治疗后观察以下指标。①临床指标为临床症状,无症状生存时间、存活和死亡人数及存活者心功能。存活者心功能评价标准:NYHA提高2级及以上为明显好转,NYHA提高1级及以上为好转,NYHA无提高或恶化为无好转。②心脏超声指标为左心室射血分数、左心室短轴缩短率、左心室舒张末期内径和左心室收缩末期内径。③实验室指标为氨基未端脑钠肽前体(NT-proBNP)。
1.5 安全性观察指标
观察病儿细胞治疗后有无体温波动、恶心、呕吐、腹泻、皮疹、感染等;注射局部有无肿胀、钙化、新生肿物及感染;心电图或动态心电图观察有无新的心律失常发生;实验室检测血常规(白细胞、血红蛋白、血小板)、尿常规(尿红细胞、尿白细胞、尿蛋白)和肝肾功能改变(谷丙转氨酶、谷草转氨酶、尿素氮和肌酐)。
1.6 统计学方法
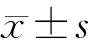
2 结 果
2.1 病儿治疗后NYHA心功能的变化
细胞治疗后,病儿明显好转者4例(23.5%),好转者11例(64.7%),无好转者2例(11.8%),病儿总体心功能改善(u=-3.637,P<0.05)。NYHA分级由Ⅳ级转为Ⅱ、Ⅲ级者各1例;Ⅲ级转为Ⅰ级者3例,转为Ⅱ级者2例;Ⅱ级转为Ⅰ级者8例; Ⅱ级无改善者和转为Ⅲ级者各1例,此2例病儿均存在难以控制的反复呼吸道感染。
2.2 病儿治疗后生存质量情况
至本次随访结束,总随访时间为7~74个月,平均随访时间为(31.5±30.27)个月,最长随访时间为74个月。17例心肌病病儿于细胞治疗后均存活,目前均口服抗心力衰竭基础药物;其中13例病儿临床无任何心力衰竭症状,参加同年龄组儿童的日常活动,如上学或进幼儿园,其生存时间为3~28个月,平均生存时间为(13.8±10)个月;4例病儿仍存在心力衰竭症状,其中轻度端坐呼吸者1例,肝脏肿大者2例,双下肢水肿者1例,日常活动轻度受限,不能参加同年龄组儿童的日常活动,其生存时间分别为7、13、32以及74个月,平均生存时间为(31.5±33.5)个月。
2.3 病儿治疗前后外周血NT-proBNP水平及心脏超声的变化
hUC-MSCs治疗后14例病儿NT-proBNP水平由治疗前(697±693)ng/L下降至治疗后(200±141)ng/L,治疗前后比较,差异有显著性(t=2.641,P<0.05)。3例病儿因反复呼吸道和(或)消化道感染,心功能无明显好转,NT-proBNP多次复查处于较高水平,其中1例细胞治疗后较治疗前明显升高,心功能分级恶化;1例病儿细胞治疗前后无明显变化,心功能分级无改善;1例病儿细胞治疗后较治疗前明显下降,但仍处于较高水平,心功能分级好转。
hUC-MSCs治疗后病儿左心室射血分数由治疗前(37.2±10.9)%提高到(45.4±13.0)%,治疗前后比较,差异具有显著意义(t=-2.910,P<0.05),其中12例病儿治疗后的左心室射血分数由治疗前(35.6±9.8)%提高到(49.6±12.2)%,差异有显著性(t=-6.196,P<0.05);5例病儿的左心室射血分数治疗后无升高,其中3例较治疗前无变化,但其心功能分级有所好转;2例较治疗前下降,心功能分级恶化或无改善。
hUC-MSCs治疗后病儿左心室短轴缩短率由治疗前(19.4±6.2)%升高至(22.6±7.3)%,但治疗前后比较,差异无显著性(P>0.05);其中11例病儿由治疗前(18.0±5.0)%升高至(24.8±7.2)%,治疗前后比较,差异有显著性(t=-5.648,P<0.05);6例病儿较细胞治疗前无升高,其中2例较治疗前下降,心功能分级恶化或无改善;2例稍有下降;2例无变化,但其心功能分级有所好转。
hUC-MSCs治疗后病儿左心室舒张末期内径由治疗前(51.2±10.4)mm缩小至(48.1±11.8)mm,治疗前后比较,差异具有显著意义(t=2.591,P<0.05);其中11例由治疗前(49.7±10.4)mm缩小至(44.4±10.8)mm,治疗前后比较,差异具有显著性(t=3.689,P<0.05);6例较治疗前无缩小,其中2例较治疗前增大,心功能分级恶化或无改善;4例无明显变化,但其心功能分级有所好转。
细胞治疗后病儿左心室收缩末期内径由治疗前(41.3±12.0)mm缩小至(37.1±13.0)mm,治疗前后比较,差异具有显著性(t=2.805,P<0.05);其中13例病儿治疗后由治疗前(43.9±12.4)mm缩小至(37.8±14.6)mm,治疗前后比较,差异具有显著性(t=3.718,P<0.05);4例病儿较治疗前无缩小,其中2例较治疗前增大,心功能分级恶化或无改善;2例无变化,但其心功能分级有所好转。
2.4 安全性
17例心肌病病儿细胞治疗后的1周内,尤其是48 h之内出现面颊和口唇红润,部分病儿出现多汗,无发热、皮疹、恶心、呕吐、腹泻等。肌肉注射部位未见红肿、出血、发硬及肿胀等异常。1例6岁病儿细胞治疗后右侧腹股沟斜疝自愈。细胞治疗后病儿心电图明显改善,表现为ST-T压低改善,2例室性期前收缩及2例房性期前收缩病儿期前收缩次数明显减少,传导阻滞消失;未合并感染的病儿无新发心律失常出现;仅1例病儿因合并重症感染出现阵发性室上性心动过速、频发室性期前收缩,经抗感染、抗心律失常治疗后心律失常消失,目前心电图仅见多导联ST-T段改变。细胞治疗前后外周血白细胞计数、血红蛋白、血小板计数、谷丙转氨酶、谷草转氨酶、尿素氮及肌酐均未见明显升高或者降低(P>0.05)。见表1。细胞治疗前1例合并感染病儿白细胞计数偏高,1例合并急性心力衰竭和感染的病儿存在肝肾功能损害,表现为谷丙转氨酶、谷草转氨酶、尿素氮、肌酐值增高,余15例病儿上述指标均在正常范围;细胞治疗后2个月及随访结束时上述指标均在正常范围。细胞治疗前后监测尿蛋白、尿白细胞和尿潜血均为阴性。
3 讨 论
近年来,有关干细胞临床治疗的研究越来越多,而且逐渐倾向于有关间充质干细胞应用研究[9-10]。UC-MSCs是间充质干细胞的一种,其来源于包绕脐带血管的结缔组织——华尔通胶(WJ)[11],具有以下优点:具有干细胞的多项分化潜能[7];取材方便,来源丰富,伦理争议少;低免疫原性,移植相关排斥反应小,安全性高[12]。这些优点使其成为临床应用治疗多种系统疾病的很好的选择[9]。目前多项研究表明,UC-MSCs在心脏修复及心脏疾病治疗中具有较高的安全性及有效性,是移植的“种子细胞”的理想来源[13-14]。
既往我们已经对hUC-MSCs治疗DCM进行了相关的实验研究,研究对象为正常大鼠及DCM大鼠,发现肌肉注射hUC-MSCs对正常大鼠无影响,主要表现为注射前后心脏结构、功能以及心肌相关细胞因子的水平无明显变化[15-16],大鼠内脏各器官(肺、肝、脾、脑、肾、肌肉)结构无异常,大鼠血常规、血生化及尿常规亦无明显变化,大鼠生活习性以及生长发育无明显的变化[17];肌肉注射hUC-MSCs对DCM大鼠有一定的影响,表现为增加心肌组织胰岛素样生长因子、肝细胞生长因子、血管内皮生长因子等细胞因子的表达,促进心肌微血管再生,减轻心肌组织病理损伤,改善心肌组织超微结构,从而使心功能改善,并具有一定的免疫调节功能[18-20]。以上动物实验研究为hUC-MSCs的临床应用提供了有效性及安全性证据。
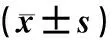
表1 病儿治疗前后血常规和肝肾功能指标比较
目前UC-MSCs治疗心肌病的相关临床研究报道较少,FISHER等[21]将干细胞应用于慢性缺血性心脏病的治疗,ISHIGAMI等[22]发现冠状动脉内注射干细胞治疗单心室改变的心脏病,可以改善心脏功能,PINCOTT等[23]报道了骨髓来源的干细胞应用于成人DCM的治疗;FANG等[24]将hUC-MSCs应用于缺血性心脏病患者治疗效果的研究。这些研究均显示干细胞可应用于心脏疾病的治疗,可部分改善部分病人的心功能。目前相关的研究认为,hUC-MSCs治疗心肌病的可能机制如下:①替代作用,hUC-MSCs诱导后分化为心肌细胞,移植至体内替代病变心肌[25];②自分泌或旁分泌功能,分泌血管生成因子、生长因子、细胞因子等物质,从而改善心肌功能[26];③抗低氧诱导心肌凋亡功能[27];④免疫调节功能[28];⑤促进血管再生功能;⑥激活内源性心脏干细胞,从而促进心肌修复[29]。
本研究结果显示,肌注hUC-MSCs可改善部分心肌病伴心力衰竭病儿的临床症状及心功能,表现为活动耐力提高,可实现无症状生存,左心室射血分数提高,左心室舒张末期内径、左心室收缩末期内径减小;肌注hUC-MSCs后无明显不良反应,安全性较好,肌注部位无明显异常,且未发现hUC-MSCs移植相关的血常规异常、肝肾功能损害、恶性心律失常等。但本研究样本较少,随访时间较短,尚需要多中心、大样本、前瞻性的病例对照研究进一步明确其有效性和安全性。
