基于Dong’s肝段分型体系的右半肝门静脉分析及临床意义
2018-09-26
(1 青岛大学附属医院小儿外科,山东 青岛 266003; 2 山东省数字医学与计算机辅助手术重点实验室; 3 青岛大学附属医院肝胆外科;4 青岛大学附属医院放射科; 5 浙江大学医学院附属儿童医院小儿外科; 6 中国医科大学附属盛京医院小儿外科)
随着医学影像学与数字医学的发展,以肝段甚至更小单位为切除单位的解剖性精准肝切除成为可能。精准肝切除术可在彻底清除肝脏病灶的同时保留最大肝脏剩余体积[1-2],为达到精准肝切除术的要求,须在术前对病人的影像学资料进行详细分析,掌握病人血管及其分支走行[3]。COUINAUD[4]提出的肝脏8段划分法在肝脏外科手术中被广为应用,然而由于当时肝脏灌注技术以及研究例数的限制,导致COUINAUD肝脏8段划分法与实际肝脏的分段存在一定的差异[5]。基于4级门静脉血管提出的Dong’s肝段分型体系达到了精准肝切除术要求的功能性肝脏切除单位,因而可以更好地指导精准肝切除[1]。由于左半肝血管变异较少,进行精准肝切除相对容易,而右半肝血管走行复杂,尤其门静脉存在较多变异[6],增加了解剖性肝切除术的难度。本研究基于Dong’s肝段分型体系对右半肝4级门静脉血管的走行进行更详细地分析,并对右半肝各肝段流域体积进行测量,为制定个体化的精准肝切除术手术方案提供理论依据。
1 对象与方法
1.1 研究对象
收集2013年7月—2018年1月青岛大学附属医院、复旦大学附属儿科医院、中国医科大学附属盛京医院等16家医院共816例不同年龄段人体肝脏上腹部增强CT的二维影像学资料。研究纳入标准:①既往无肝脏疾病及肝切除手术史者;②患有其他系统疾病(如胸腔肿瘤、肾肿瘤、腹膜后肿瘤等)需行上腹部增强CT检查而未压迫肝脏导致肝脏血管变形者;③上腹部增强CT动脉期、静脉期、平衡期三期成像质量好,能清晰显示门静脉4级血管的形态、走行者。④肝功能检查无异常者。符合该纳入标准的病人共810例,其中男270例,女540例;年龄3个月~89岁,平均年龄51.5岁。
1.2 仪器与试剂
增强CT机(美国GE 64层螺旋CT,型号:GE Discovery CT 750HD),螺旋CT机(德国西门子,型号:Somatom Definition Flash CT);非离子碘海醇对比剂100 mL∶35 g(I)(北京北陆药业股份有限公司);海信计算机辅助手术系统(Hisense CAS)为青岛大学附属医院与青岛海信集团联合研发的手术规划系统[1],Hisense CAS兼容0.625~2.000 mm厚度的图片,通过人工智能及传统图像分割算法,精确分割肝脏边缘。通过透明掩膜模式,可将分割结果附在二维影像数据上进行对比验证,并提供交互工具,局部微调分割结果。结合分割结果及影像扫描参数(像素间距和层间距),精确计算肝脏体积及门静脉各分段流域体积[3,7-10]。
1.3 研究方法
1.3.1上腹部增强CT检查 检查前受检者需空腹4~6 h,经手背或前臂建立静脉通道后,注入碘海醇对比剂(1.5~2.0)mL/kg。对于不配合的儿童,给予100 g/L水合氯醛(0.5 mL/kg)口服镇静,待其入睡后进行检查。扫描范围从肝上膈顶到胰腺下缘,成人于对比剂注射后30、60、120 s分别行动脉期、静脉期以及平衡期三期扫描,管电压设置参数为120 kV;儿童于对比剂注射后20、50、90 s分别进行三期扫描,管电压设置参数为80 kV。其他扫描参数设置:球管转速0.5 r/s,螺距1.375∶1.000,扫描层厚5 mm、间距5 mm,重建厚度为0.625 mm,将三期扫描的数据传至工作站并以DICOM格式文件刻盘存储。
1.3.2Hisense CAS三维重建 将DICOM格式的三期扫描数据导入Hisense CAS,添加病例资料后进入三维重建模块,分别进行肝脏、胆囊、下腔静脉、肝静脉以及门静脉的三维重建,重建完成后可在全部显示功能中看到立体透明的肝脏、清晰的血管以及胆囊。
1.3.3右半肝门静脉分析 采用Hisense CAS 2.20重建出右半肝门静脉4级血管,参照Dong’s 肝脏分段体系的A型、B型、C型和D型4个类型,在此基础上对A型、C型和D型的右半肝4级门静脉进行更详细分析。
1.4 统计学方法
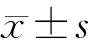
2 结 果
2.1 三维重建结果
采用Hisense CAS对810例上腹部增强CT影像资料的DICOM数据进行三维重建,获取肝脏、胆囊、肝静脉、肝动脉、门静脉整合的三维立体模型,通过对模型的任意旋转、放大、缩小等功能观察并分析右半肝门静脉走行,计算右半肝门静脉支配流域体积。见图1。
2.2 基于Dong’s肝段分型体系[1]的右半肝门静脉分析及体积测量结果
2.2.1A型 共355例,占43.83%。门静脉右前支呈两主支(Ⅴ段和Ⅷ段),右后支呈两主支(Ⅵ段和Ⅶ段)。其中门静脉右前支呈头尾侧支者193例(23.83%),呈腹背侧支者162例(20.00%)。右半肝各段流域体积见表1,图2(扫描或长按文后二维码观看相关视频)。
2.2.2B型 共250例,占30.86%。门静脉右前支呈三主支(Ⅴ段、Ⅷ段和Ⅸ段),右后支呈两主支(Ⅵ段和Ⅶ段)。右半肝体积占全部肝体积的比例为(62.02±5.66)%。其中Ⅴ段、Ⅵ段、Ⅶ段、Ⅷ段、Ⅸ段流域体积占全部肝体积的比例分别为(10.36±3.10)%、(9.88±3.82)%、(15.17±4.67)%、(11.93±3.32)%及(12.69±3.73)%。见图2(扫描或长按文后二维码观看相关视频)。
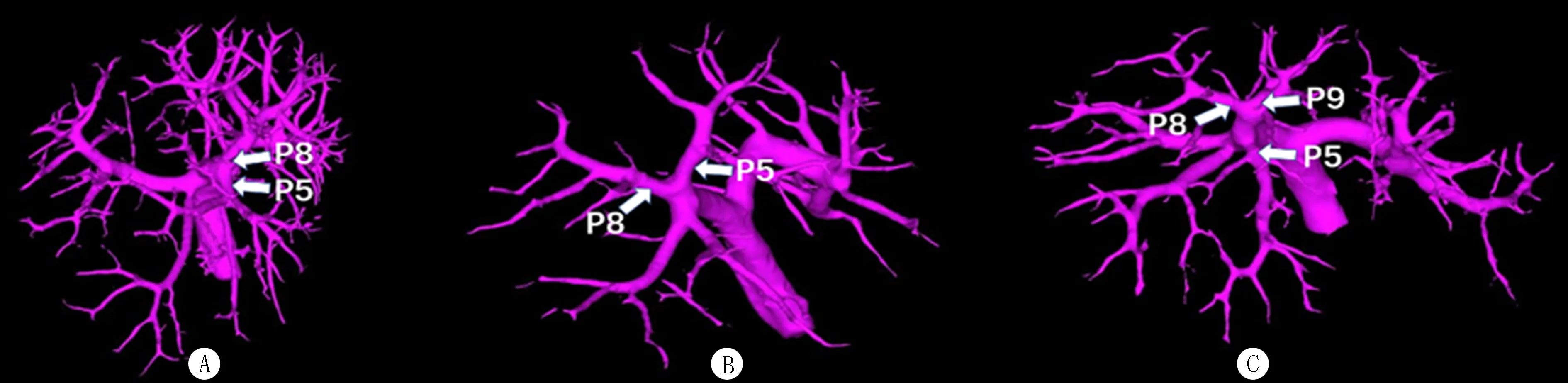
2.2.3C型 共71例,占8.77%。C-a型门静脉右前支呈两主支(Ⅴ段、Ⅷ段),右后支呈弓状型(RP段),共51例(6.30%),其中右前支呈头尾侧者共30例(3.70%),呈腹背侧者共21例(2.60%)。C-b型门静脉右前支呈三主支(Ⅴ段、Ⅷ段和Ⅸ段),右后支呈弓状型(RP段),共20例(2.47%)。右半肝各段流域体积见表2、图3(扫描或长按文后二维码观看相关视频)。
2.2.4D型 共134例,占16.54%。其中门静脉右前支呈四分叉者14例(1.73%),右半肝流域体积占全肝体积比例为(62.36±3.71)%;门静脉右前支呈一支主干多分叉者13例(1.60%), 右半肝流域体积占全肝体积比例为(61.33±4.90)%;门静脉右前支来自左主干者92例(11.36%),右半肝流域体积占全肝体积比例为(63.51±5.59)%,其中门静脉右前支呈头尾侧支者35例(4.32%),呈腹背侧支者29例(3.58%),呈三分叉者16例(1.98%),呈一支主干多分叉者9例(1.11%),而呈四分叉者仅3例(0.37%);6段门静脉未像典型的门静脉那样发自门静脉右后支而是发自右前支者15例(1.85%),右半肝流域体积占全肝体积比例为(63.17±5.92)%。见图4。

表1 A型右半肝门静脉各段流域体积占全肝体积比例(χ/%)
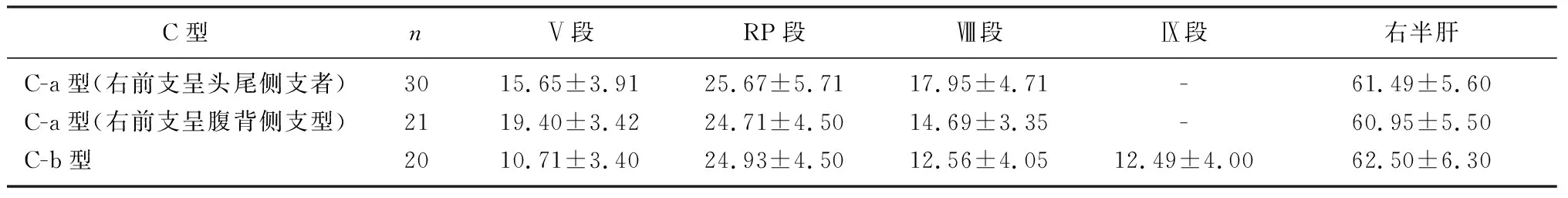
表2 C型右半肝门静脉各段流域体积占全肝体积比例(χ/%)
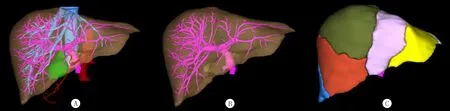
A:肝脏及脉管系统;B:门静脉血管;C:基于门静脉血管各分支及其流域边界,以不同颜色对4级门静脉血管支配各段流域体积进行标记。
图1计算机三维重建结果
A:A型右前支呈头尾侧; B:A型右前支呈腹背侧; C:B型右前支呈三分叉状。
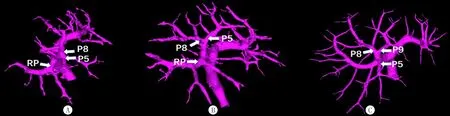
A:C-a型右前支呈头尾侧,右后支呈弓状型;B:C-a型右前支呈腹背侧,右后支呈弓状型;C:C-b型右前支呈三分叉状,右后支呈弓状型。
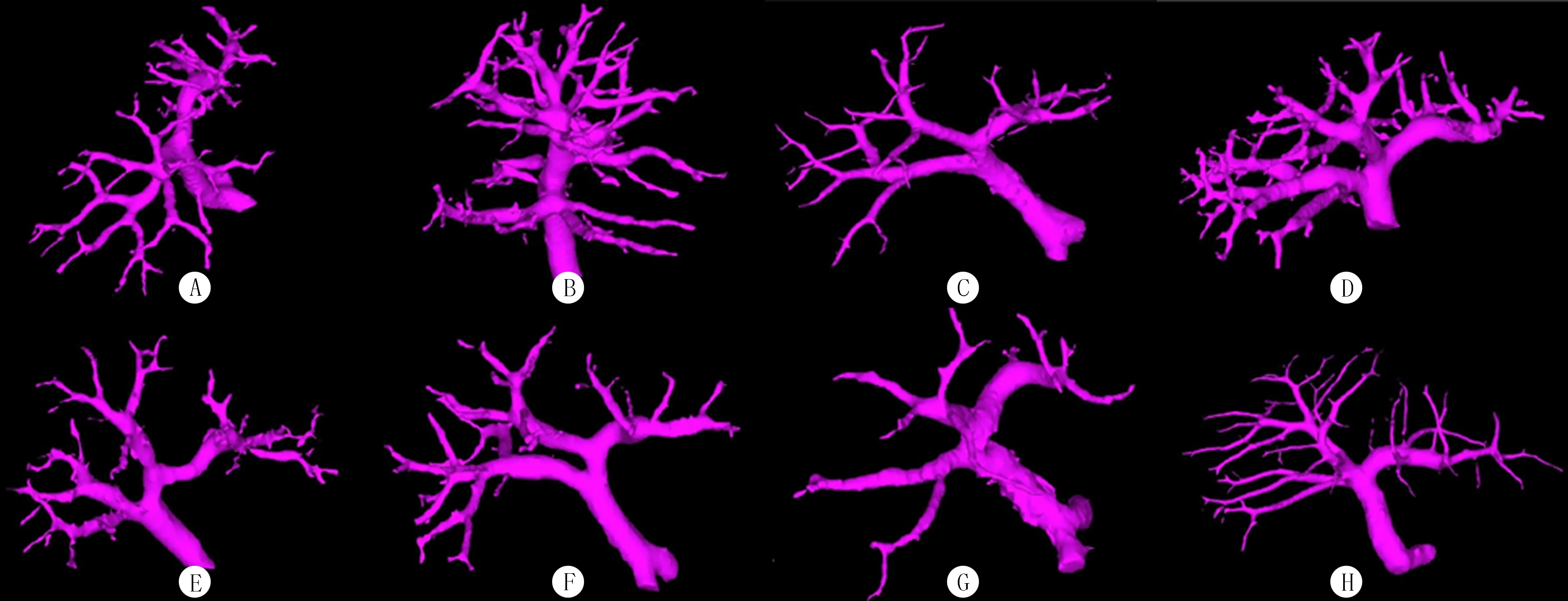
A:右前支呈四分叉;B:右前支呈一支主干多分叉状;C:右前支来自左干并右前支呈头尾侧;D:右前支来自左干并右前支呈腹背侧;E:右前支来自左干并右前支呈三分叉;F:右前支来自左干并右前支呈一支主干多分叉;G右前支来自左干并右前支呈四分叉;H:6段来自右前支。
图4Dong’s肝段分型D型右半肝门静脉分析
3 讨 论
肝段的概念最早由英国学者FRANCIS提出,其后又有了多个学者提出了不同的肝段划分的方法[4,11-13]。瑞士学者HJORTSJO等[11]基于肝脏管道铸型及胆管造影技术对肝脏进行研究,首次将肝脏分为5部分:左半肝的中段及外侧段,右半肝的背尾侧段、中段及腹头侧段;美国学者HEALEY等[12]进一步提出将左半肝分为中侧段、外侧段,肝右叶分为前段和后段的肝脏4段划分法;法国学者COUINAUD[4]通过对100多例离体肝脏铸型模型血管走行的观察,结合门静脉供血和肝静脉回流情况提出了著名的肝脏五叶八段分类法。在以上肝段分类方法中COUINAUD[4]的五叶八段分类法被视为肝脏外科手术中的指南,被世界各国医生所采用。然而由于肝脏铸型来源受到尸体例数以及灌注技术的限制使观察的结果准确性受限,比如当灌注后的离体肝脏标本放在平面上进行观察时,受重力影响,门静脉血管的走行会比其实际的血管走行更靠外侧[14-15]。因此,基于肝脏灌注标本的观察对肝脏进行肝段划分及血管走行的分析并不精确。随着医学影像学技术及三维重建技术的结合以及精准肝切除术的提出,使得三维立体的肝脏及脉管系统可以清晰呈现[16-20],为肝段划分以及精准肝切除提供了帮助。董蒨教授领衔的数字医学科研团队利用自主研发的Hisense CAS对1 260例正常人类上腹部增强CT数据进行肝脏及其脉管系统三维重建,可精确显示肝内4级门静脉血管,在四级门静脉的基础上提出了Dong’s肝段分型体系。Dong’s 肝段分型体系能够满足精准肝切除术要求的基本功能性肝切除单位,该体系的提出基于大样本量活体肝脏影像学数据的三维重建结果[1,21-22],更加真实地反映了肝脏真实的情况。
本研究基于已建立的Dong’s肝脏分段体系。采用Hisense CAS对810例人体上腹部增强CT数据进行肝脏及其脉管系统三维重建,对右半肝4级门静脉血管进行进一步分析,有助于更好地开展精准肝切除术,在术前针对不同的门静脉走行制定个性化的手术方案并进行术前模拟,可为安全地开展精准肝切除术保驾护航。对于A型和B型,在术前要仔细区分右前支门静脉的形状、走行,判断肿瘤所在位置及其与血管之间的关系,避免手术中损伤血管造成不必要的大出血[23]。对于C型,传统的COUINAUD分段将门静脉右后支分为向后上方走行的7段门静脉和向后下方走行的6段门静脉[4],然而C型门静脉右后支呈弓状型主干,从主干一次发出了5~11支分支,临床上进行手术时无法像传统的COUINAUD分段那样简单地结扎6段或7段门静脉即可进行6段或者7段的肝段切除术,在术中应针对肿瘤所在位置逐一结扎来自弓状主干的各分支,达到精准肝切除的目的。D型特殊变异类型较多,若门静脉右前支为4分叉者,当肿瘤所在位置为右前支4分支的某一分支时,则将此分支自其根部结扎连同肿瘤一起切除以达到解剖性肝切除目的;若门静脉右前支为一支主干,自主干根部至尾部发出多个分支,这种类型门静脉血管丰富,可根据肿瘤所在位置结扎相应的几支小分支;对于门静脉右前支来自左干者,当肿瘤来自肝左叶进行肝左叶切除时要特别注意保护来自门静脉左支的右前支门静脉,以免结扎门静脉左支时将门静脉右支一同结扎,造成肝脏右前叶缺血。6段来自门静脉右前支者与传统的COUINAUD分段中6段门静脉来自门静脉右后支不同,此变异类型的门静脉右前支流域体积明显增大,这对术前制定精准肝切除方案及残存肝体积评估至关重要。
综上所述,Hisense CAS 2.20系统运行速度快,可自动三维重建肝脏及其脉管系统,清晰显示4级门静脉血管及更细分支,在术前可准确判断肿瘤与周围血管的位置关系,并可在术前进行手术模拟,评估肿瘤切除范围,计算残存肝体积,降低实际手术操作中的创伤[24-26]。本研究通过对大样本量的右半肝4级门静脉血管的分析发现,右半肝门静脉存在较多变异,通过对这些门静脉解剖结构进行分析研究,可更好地指导个性化临床精准肝切除术及术前手术方案的制定。同时对肝脏解剖教学及门静脉分型的进一步研究有重要意义。

扫描或长按二维码 观看本文相关视频
