多囊卵巢综合征大鼠卵巢颗粒细胞中DR5、DcR2的表达变化
2018-09-26王立群周月希
张 娟,王立群,2,周月希,2,刁 波,周 蓉,解 迪
(1.中国人民解放军武汉总医院妇产科生殖中心,武汉 430070; 2.湖北中医药大学,武汉 430070; 3.中国人民解放军武汉总医院医学实验科,武汉 430070)
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是育龄妇女中最常见的内分泌失调性疾病之一,临床上主要以以下三种表现为特征:稀发排卵或者无排卵、高雄激素的临床或生化表现以及卵巢多囊改变。PCOS是引起无排卵性不孕的主要原因,其发病机制目前尚未完全阐明。在PCOS患者双侧卵巢中,可见多个囊性扩张的卵泡,而少有优势卵泡形成,这说明在PCOS患者的卵巢中,卵泡的发育过程存在着障碍。
大量研究表明,颗粒细胞在卵母细胞的成熟和卵泡的发育过程中起到重要作用,在卵泡选择闭锁的过程中,颗粒细胞是最早经历凋亡的细胞群[1],目前已知的细胞凋亡途径主要为两种,一种是由死亡受体介导的凋亡途径,一种是由线粒体介导的凋亡途径,许多学者认为,在卵泡颗粒细胞选择性凋亡的过程中,死亡受体介导的凋亡途径发挥了重要作用[2],其中,肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis inducing ligand,TRAIL)及其受体系统已经被证实在颗粒细胞的凋亡过程中发挥了重要作用[8-11],但它们在PCOS卵泡发育中的作用鲜有报道。本课题组前期的研究表明TRAIL及其受体——死亡受体-4(death receptor-4,DR4)和诱骗受体-1(decoy receptor-1,DcR1)在PCOS大鼠窦状卵泡颗粒细胞中有异常表达[3],提示TRAIL、DR4和DcR1的表达变化可能对PCOS卵泡的异常发育起到了一定作用,但是TRAIL另外两个受体——死亡受体-5(death receptor-5,DR5)、诱骗受体-2(decoy receptor-2,DcR2)的表达变化及其表达意义尚不清楚。
因此,笔者在本次研究中先采用皮下注射硫酸普拉睾酮钠(脱氢表雄酮硫酸钠盐制剂)来构建PCOS大鼠模型,然后分别用免疫组织化学染色、RT-qPCR分析观察并比较DR5、DcR2在PCOS组和对照组大鼠卵巢颗粒细胞的表达情况,综合前期的研究结果,来全面探讨TRAIL及其受体系统在PCOS大鼠卵泡发育中可能发挥的作用,从而更深入地了解PCOS卵泡发育障碍的可能机制,为PCOS卵泡发育障碍的治疗提供一个新的想法。
1 材料和方法
1.1 实验动物
雌性SD大鼠20只,SPF级,体重50~60 g,21日龄,由湖北省实验动物研究中心提供[SCXX (鄂) 2015-0018],在湖北省疾病预防控制中心SPF级屏障环境[SYXK (鄂) 2017-0065]中饲养,温度控制在(22±2)℃,相对湿度为50%~60%,自由饮食,光照周期为日夜各12 h。所有动物均为麻醉后处死。本次动物实验得到广州军区武汉总医院医学实验动物福利伦理委员会的许可(编号:20170238),在实验过程中,遵循实验动物使用的3R原则给予动物人道主义关怀。
1.2 主要试剂与仪器
硫酸普拉睾酮钠,青岛捷世康生物科技有限公司;注射用水,浙江瑞新药厂;TRIzol试剂盒,美国Invitrogene公司;逆转录试剂盒,美国Invitrogene公司;SYBR Green PCR试剂盒,美国Thermo Fisher公司;兔抗大鼠DR5、DcR2多克隆抗体,Abcam公司。PL303型电子天平,梅特勒-托利多仪器有限公司;L600型离心机,湘仪仪器厂;YD6L生物组织包埋机,金华市益迪医疗设备有限公司;RM2016轮转型切片机,上海徕卡仪器有限公司;BX51奥林巴斯荧光显微镜,日本Olympus公司;PTC-100TM全自动PCR仪,美国Bio-Rad公司;752-P紫外分光光度计,上海现科仪器有限公司;LC96荧光定量PCR仪,美国Roche公司;AJC-0501-P纯水蒸馏器,重庆艾科普;东方A型恒温烤箱,上海博讯实业有限公司;各种微量移液器,上海安亭科学仪器厂;医用手术器械,上海博讯实业有限公司。
1.3 实验方法
1.3.1 动物模型的建立[4]
21日龄雌性SD大鼠,断乳,适应性喂养两天,23日龄时随机分为两组,每组10只。其中一组大鼠每日按硫酸普拉睾酮钠90 mg/g行皮下注射,相当于DHEA(脱氢表雄酮)60 mg/g,0.4 mL注射用水溶解,连续注射20 d,用来建立PCOS大鼠模型,该组设为PCOS组。另一组设为对照组,每日皮下注射0.4 mL注射用水,连续注射20 d。所有大鼠于注射后第21天的早晨用4%水合氯醛麻醉,解剖取卵巢,分离表面多余组织,固定(4%多聚甲醛),石蜡包埋,制备4 μm厚切片,行HE染色和免疫组化染色。
1.3.2 卵泡发育级别判断
始基卵泡:初级卵母细胞停留于减数分裂双线期,其周围围绕了一层梭形前颗粒细胞。
窦前卵泡:初级卵母细胞增大,其周围围绕了数层立方形颗粒细胞。
窦状卵泡:卵泡内形成卵泡腔,由增加的卵泡液融合而成,卵母细胞被卵泡腔所围绕,颗粒细胞被分为围绕在卵母细胞周围的卵丘颗粒细胞和位于卵泡外周的基底膜颗粒细胞。此时卵泡直径可增大至500 μm。
1.3.3 卵巢HE染色
卵巢石蜡切片(4 μm)脱蜡至水,苏木素染色1.5 min,自来水洗返蓝,显微镜下观察核蓝紫色,100%乙醇浸泡3 min,伊红染色10 s,100%乙醇浸泡10 s,观察细胞质红色,晾干,中性树脂封片。
1.3.4 免疫组织化学染色检测DR5、DcR2蛋白的表达
采用免疫组织化学技术SABC(链霉亲和素-生物素-过氧化物酶复合物)法:大鼠卵巢石蜡切片,脱蜡至水,3% H2O2封闭内源性过氧化物酶,微波抗原修复,山羊血清封闭,加一抗(用PBS按1∶200稀释的兔抗大鼠DR5抗体和按1∶100稀释的兔抗大鼠DcR2抗体),以PBS替代一抗作阴性对照,4℃过夜;加二抗(生物素标记羊抗兔IgG,用PBS按1∶200稀释),37℃孵育35 min;加SABC(用PBS按1∶200稀释),37℃孵育30 min;DAB显色,显微镜下控制显色时间(5~10 min);自来水洗后苏木素复染,晾干,中性树胶封片。采用日本奥林巴斯BX51荧光显微镜成像,高倍视野(× 400)下,观察各级卵泡颗粒细胞DR5、DcR2蛋白的表达,阳性细胞被染成棕黄色,由Image-Pro Plus计算颗粒细胞内棕黄色区域面积(Area)及光密度值(IOD),平均光密度值(OD)为两者之比(IOD/Area),棕黄色着色越深,对应的OD值越大,蛋白表达越强,反之则反。
1.3.5 RT-qPCR法检测卵巢颗粒细胞的DR5和DcR2基因的表达
将上述摘取的卵巢,置于培养皿中,分离掉表面多余的脂肪组织,用1 mL注射器针头划破卵巢,用0.01 mol/L PBS反复冲洗卵泡,以充分释放颗粒细胞,将含颗粒细胞的PBS吸取至离心管中,2000 r/min离心10 min,丢弃上清,用PBS将颗粒细胞重悬,再将悬液移至45% Percoll液之上,2000 r/min离心10 min,颗粒细胞位于上层[3],将颗粒细胞移至TRIzol液中,按照试剂盒说明书提取细胞总RNA,逆转录合成cDNA(反应体系为20 μL。反应条件为42℃ 60 min,70℃ 5 min),然后按照SYBR Green PCR试剂盒说明书要求进行RT-qPCR(反应体系为20 μL。反应条件为95℃预处理3 min;95℃ 3 s,60℃ 10 s,共40个循环;最后95℃ 10 s,65℃ 10 s,97℃ 1 s。反应系统为Light Cycler 96系统)。各种引物序列见表1。
1.4 统计学方法


表1 引物序列Table 1 Primer sequences
2 结果
2.1 卵巢光镜HE染色检查
如图所示,PCOS组大鼠卵巢切面沿包膜下可见多个卵泡呈囊性扩张,黄体形成明显减少,囊性扩张的卵泡内不见卵母细胞或放射冠,卵泡周围颗粒细胞排列松散,层数变薄甚至消失,而卵泡膜细胞有增生(图1A)。而对照组大鼠卵巢切面可以看见许多处于不同发育时期的卵泡,并有多个黄体形成,成熟的卵泡内可见卵母细胞及放射冠,其周围颗粒细胞排列整齐,层数较厚,可达8~9层(图1B)。
2.2 DR5在卵巢各级卵泡的颗粒细胞中的表达
DR5的阳性表达主要表现为细胞胞质和胞膜的棕黄色染色。DR5在PCOS组和对照组大鼠各级卵泡的卵母细胞和颗粒细胞中均有阳性表达。经统计分析,DR5在PCOS组大鼠卵巢各级卵泡颗粒细胞的表达较对照组同级卵泡均明显增强,且多表达于PCOS组窦状卵泡的卵泡壁内层颗粒细胞(表2,图2)。
2.3 DcR2在卵巢各级卵泡的颗粒细胞中的表达
DcR2阳性表达主要表现为细胞胞质和胞膜的棕黄色染色。DcR2在PCOS组和对照组大鼠各级卵泡的卵母细胞和颗粒细胞均有阳性表达。经统计分析,DcR2在两组大鼠始基卵泡颗粒细胞的表达差异无显著性,而在PCOS组窦前卵泡和窦状卵泡颗粒细胞的表达较对照组同级别卵泡明显增强,且多表达于PCOS组窦状卵泡的卵泡壁内层颗粒细胞(表3,图3)。
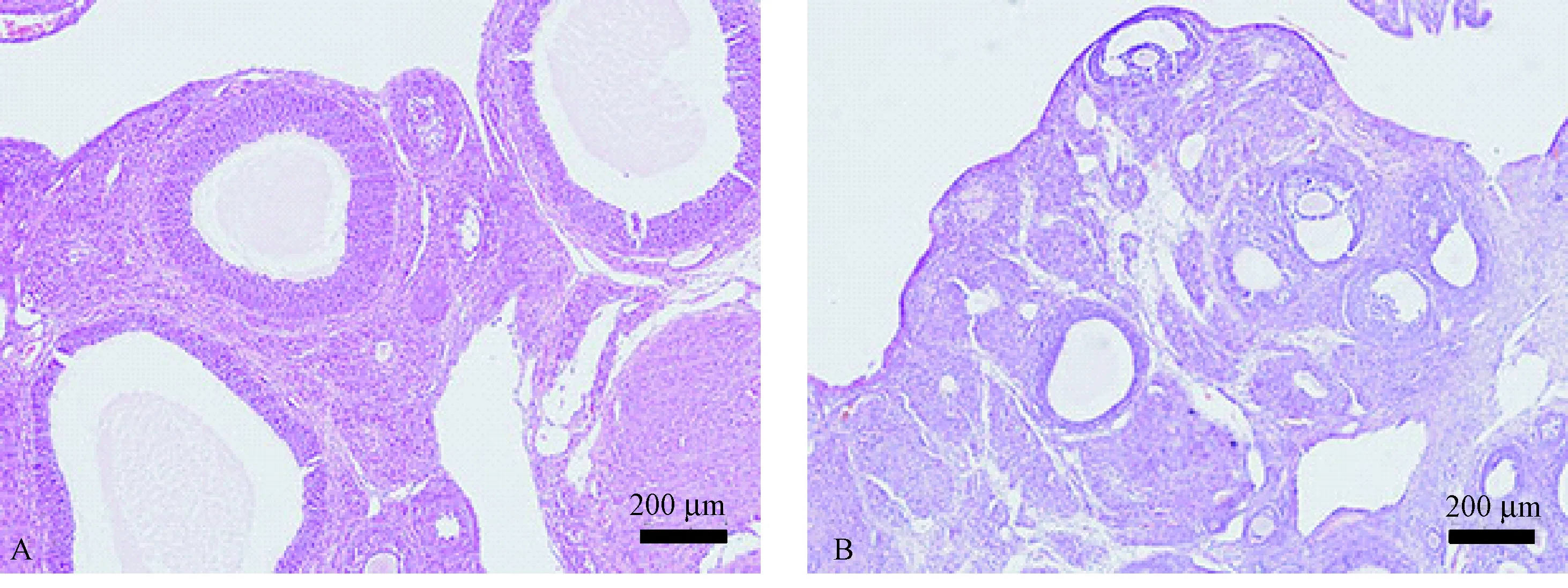
注:A:PCOS组;B:对照组。图1 大鼠卵巢(HE染色,× 100)Note. A: PCOS group; B: Control group.Figure 1 Rat ovary. HE staining

组别Groups始基卵泡Primordial follicles窦前卵泡Preantral follicles窦状卵泡Antral follicles对照组Control group0.1035±0.0036 (30)0.1177±0.0125 (29)0.1267±0.0115 (27)PCOS组PCOS group0.1466±0.0038* (29)0.1768±0.0160* (28)0.1944±0.0148* (26)
注:括号内为卵泡个数。与对照组同级别卵泡相比,*P< 0.05。
Note. The number of follicles is shown in parentheses. Compared with follicles at the same level in the control group,*P< 0.05.
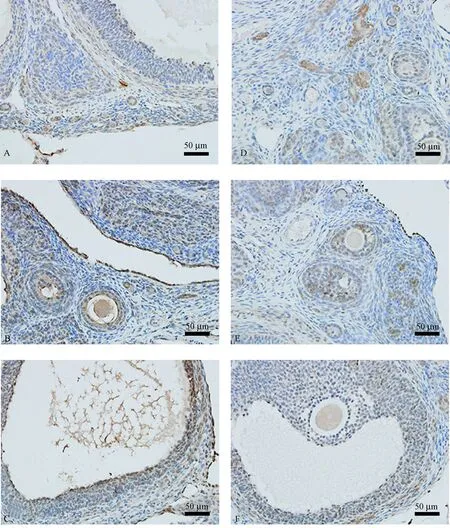
注:A~C:分别为PCOS组大鼠卵巢始基卵泡、窦前卵泡、窦状卵泡;D~F:分别为对照组大鼠卵巢始基卵泡、窦前卵泡、窦状卵泡。图2 DR5在大鼠卵巢各级别卵泡颗粒细胞的表达(SABC法,× 400)Note. A-C: The primordial follicle, preantral follicle, and antral follicle in rat ovary of the PCOS group, respectively. D-F: The primordial follicle, preantral follicle, and antral follicle in rat ovary of the control group, respectively.Figure 2 DR5 expression in different levels of follicle granulosa cells in rat ovary. SABC method
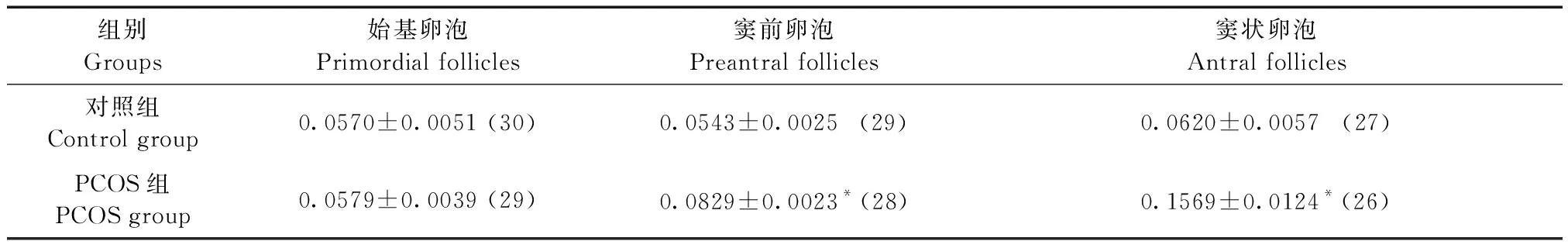
组别Groups始基卵泡Primordial follicles窦前卵泡Preantral follicles窦状卵泡Antral follicles对照组Control group0.0570±0.0051 (30)0.0543±0.0025 (29)0.0620±0.0057 (27)PCOS组PCOS group0.0579±0.0039 (29)0.0829±0.0023* (28)0.1569±0.0124* (26)
注:括号内为卵泡个数。与对照组同级别卵泡比较,*P< 0.05。
Note. The number of follicles is shown in parentheses. Compared with follicles at the same level in the control group,*P< 0.05.

注:A~C:分别为PCOS组大鼠卵巢始基卵泡、窦前卵泡、窦状卵泡;D~F:分别为对照组大鼠卵巢始基卵泡、窦前卵泡、窦状卵泡。图3 大鼠卵巢各级别卵泡颗粒细胞DcR2表达(SABC法,× 400)Note. A-C: The primordial follicle, preantral follicle, and antral follicle in rat ovary of the PCOS group, respectively. D-F: The primordial follicle, preantral follicle, and antral follicle in rat ovary of the control group.Figure 3 DcR2 expression in different levels of follicle granulosa cells in rat ovary. SABC method
2.5 颗粒细胞中DR5 mRNA及DcR2 mRNA的表达
RT-qPCR显示,DR5 mRNA和DcR2 mRNA在两组大鼠卵巢颗粒细胞中均有表达,经统计学分析,二者在PCOS组大鼠卵巢颗粒细胞中的表达较正常对照组均明显增强(P< 0.05)。详见图4。
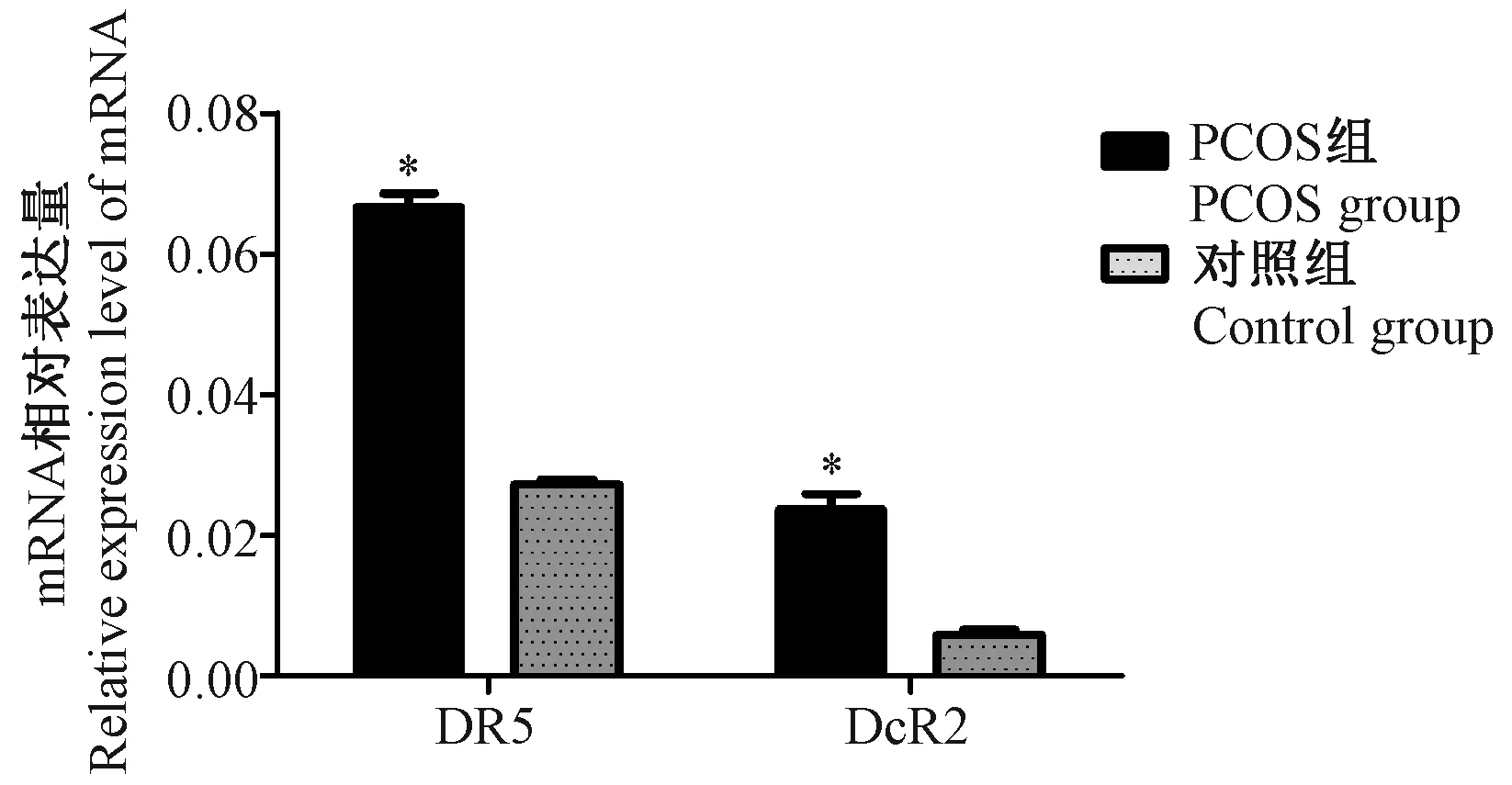
注:与对照组相比,* P< 0.05。图4 PCOS组和对照组颗粒细胞DR5 mRNA和DcR2 mRNA相对表达量Note. Compared with the control group,* P< 0.05.Figure 4 Relative expression of DR5 mRNA and DcR2 mRNA in granulosa cells of PCOS group and control group
3 讨论
在PCOS患者双侧卵巢中,可见多个囊性扩张的卵泡,它们既不闭锁也无法形成优势卵泡,这提示在PCOS患者卵巢中,卵泡的发育存在着障碍。卵泡中卵母细胞的正常发育不仅与促性腺激素的调节有关,还与颗粒细胞及膜细胞之间的联系密切相关[5]。颗粒细胞是卵泡里最大的细胞群,是最靠近卵母细胞的体细胞,大量研究表明,颗粒细胞在卵泡的发育过程中起到重要作用,在卵泡选择闭锁的过程中,颗粒细胞是最早经历凋亡的细胞群[1]。
目前已知细胞的凋亡途径主要为两种,一种是由死亡受体介导的凋亡途径,一种是由线粒体介导的凋亡途径。许多学者认为,由死亡受体介导的凋亡途径在卵泡颗粒细胞选择性凋亡过程中发挥着重要作用[2]。Wada等[8-10]研究表明TRAIL及其受体系统在猪卵巢颗粒细胞的凋亡过程中发挥了重要作用。Jääskeläinen等[11]研究了人不同时期卵巢TRAIL及其受体表达情况,发现DcR1在成人期卵巢颗粒细胞中有表达而不表达于胎儿期卵巢颗粒细胞,TRAIL、DR5、DcR2在成人期卵巢颗粒细胞的表达较胎儿期是明显增强的,而从胎儿期到成人期这个过程中,卵泡的数量是通过闭锁、退化而不断减少的,提示TRAIL及其受体系统可能协同调控着人卵巢颗粒细胞的凋亡过程。但是TRAIL及其受体系统在PCOS卵泡发育过程中的作用却鲜有报道。
Mikaeili等[6]通过对比PCOS患者和输卵管堵塞育龄期妇女卵巢颗粒细胞凋亡情况发现,PCOS患者颗粒细胞凋亡是明显增加的,本课题组前期的研究也表明,在PCOS大鼠卵泡发育过程中,窦状卵泡颗粒细胞凋亡发生率较对照组明显升高[7],同时本课题组还发现TRAIL及其受体DR4和DcR1在PCOS各级卵泡颗粒细胞中表达是有异常的[3]。本次研究结果发现,与对照组相比较,PCOS组各级卵泡颗粒细胞中DR5和DcR2表达是有异常的:在始基卵泡中,DR5表达增强,DcR2表达无明显差异,在窦前卵泡和窦状卵泡中,DR5、DcR2的表达均明显增强。在这三个级别的卵泡中,只有窦状卵泡颗粒细胞凋亡发生率明显升高[7],由于TRAIL与死亡受体结合会诱导细胞凋亡,与诱骗受体结合无法将凋亡信号传递至细胞内而无法诱导细胞凋亡[12],因此本课题组推测:在正常卵泡颗粒细胞中,TRAIL与不同受体结合后在诱导和抑制细胞凋亡之间可能存在着一种精妙的平衡,但是在PCOS窦状卵泡颗粒细胞中,由于TRAIL及其受体系统的表达均发生了比较大的变化,这种精妙的平衡被打破,由TRAIL参与的颗粒细胞自我稳定环境消失,这可能是PCOS窦状卵泡颗粒细胞凋亡发生率升高的原因之一。
在PCOS窦状卵泡颗粒细胞凋亡发生率升高的同时,DcR2的表达也是明显增强的,但是由于DcR2缺少完整的死亡结构域,它与TRAIL结合不仅不诱导靶细胞凋亡,还可与死亡受体竞争结合TRAIL,从而起到保护靶细胞的作用,这提示在PCOS大鼠窦状卵泡中,DcR2阳性的颗粒细胞可能发挥着凋亡抵抗的作用。有研究表明,DcR2在衰老的肿瘤细胞和成纤维细胞中有高表达[14],它在缺血再灌注后大鼠肾组织的表达量明显升高,与肾功能及肾组织损伤程度明显正相关[15],那么PCOS大鼠卵泡颗粒细胞上DcR2的表达量与颗粒细胞凋亡程度是否也有一定的相关性,目前未见报道,这有待于本课题组进一步的研究。本次研究结果还表明DR5和DcR2多表达于PCOS组大鼠卵巢窦状卵泡的内层颗粒细胞,本课题组之前的研究发现凋亡也多发生于PCOS组大鼠卵巢窦状卵泡的内层颗粒细胞[7],提示PCOS组窦状卵泡内层颗粒细胞中DR5和DcR2的异常表达,可能是导致卵泡内层颗粒细胞凋亡增多的原因之一,而Okutsu等[13]提出,处于发育后期卵泡的卵泡壁内层颗粒细胞的凋亡增加,可能是导致卵泡囊性扩张的主要原因,提示PCOS组窦状卵泡内层颗粒细胞中DR5和DcR2的异常表达,可能对PCOS卵泡的异常发育起到了一定作用。
综上所述,DR5和DcR2在颗粒细胞中的异常表达可能对PCOS大鼠卵泡的异常发育起到了一定作用,它们可能是通过参与颗粒细胞的凋亡过程而对PCOS卵泡的发育造成了一定影响,这为日后PCOS卵泡发育障碍的治疗提供了一个新思路。
