成纤维细胞向运动神经元的分化研究进展
2018-09-26施玉婷
施玉婷,李 峰
(1.首都医科大学2013级长学制临床医学(儿科医学方向),首都医科大学附属北京儿童医院,北京 100013; 2.首都医科大学神经生物学系,北京脑重大疾病研究院,北京神经再生修复研究重点实验室,北京 100069)
脊髓性肌萎缩症(spinal muscular atrophy,SMA)和肌萎缩性侧索硬化症(amyotrophic lateral sclerosis,ALS)等是一类不明原因的以运动神经元(motor neurons,MNs)进行性变性为主要特征的疾病,会引起肌萎缩无力、运动障碍,甚至瘫痪、死亡。对此尚无有效的治疗方法,细胞替代治疗是当前研究的主要手段,移植细胞主要包括MNs、神经干细胞(neural stem cells,NSCs)、胚胎干细胞(embryonic stem cells,ESCs)等。如何在体外获得大量上述细胞是问题的关键。
1998年11月,威斯康星大学的科学家[1]培育出了具有分化潜能的人ESCs,可利用其得到靶细胞甚至靶器官用以移植。但在对ESCs的研究中发现,该细胞具有致瘤性,异体移植存在免疫排斥,同时还存在伦理学争议,很大程度上限制了其应用。2006年日本京都大学的Yamanaka等人[2]将4个基因(OCT4,SOX2,C-MYC,KLF4)导入小鼠胚胎成纤维细胞(mouse embryonic fibroblasts,MEFs)内,转化得到形态和功能都和ESCs很相似的多能诱导干细胞(induced pluripotent stem cells,iPSCs),开创了细胞重编程技术的新时代。这种细胞来源于自身已成熟的体细胞,能避免免疫排斥。随后研究者们开始探索如何将已分化的细胞在特定条件下逆转为iPSCs,或是直接得到靶细胞,如MNs。本文就体外分化得到MNs的研究方法进行归纳和总结。
多种细胞均可用于体外分化,如间充质干细胞[3]、骨髓细胞[4]、成熟B淋巴细胞[5],但因成纤维细胞易于获得,目前研究最多。本文探讨以下三种由成纤维细胞获得MNs的方法,即经iPSCs中间状态、直接转化和经NSCs中间状态。
1 成纤维细胞经iPSCs中间状态转化成MNs
1.1 成纤维细胞转化成iPSCs
迄今已有很多方法可将体细胞诱导为iPSCs,包括体细胞核移植、细胞融合、细胞提取物重编程和直接重编程。其中,直接重编程是向体细胞内转入特定的转录因子或基因来诱导,如,SOX2、OCT4、C-MYC和KLF4,它们都与细胞全能性或多能性的维持有关。细胞的转化效率和速度与体细胞的来源、转录因子、转入途径和培养条件等因素息息相关。有些体细胞在重编程的过程中易于获得较高的转化效率,这是由于不同分化程度和种类细胞的蛋白质和DNA结合紧密程度不同,导致外源性转录因子结合到细胞DNA中的难易程度不同。Yamanaka等人[2]所用的四因子是细胞重编程实验中的标准转录因子,用其他因子替换原本的一种或几种转录因子,也能实现细胞重编程,但转化时效可发生改变。比如有些体细胞自身可内源性表达一种或几种特定Yamanaka因子,不需要外源添加,如成纤维细胞可表达C-MYC和KLF4,在重编程过程中就可不用添加KLF4因子,但会减小转化效率并延长转化时间。2006年Yamanaka等人[2]成功得到iPSCs后,由Takahashi等[6]、Brambrink等[7]、Kim等[8]、Ban等[9]、Mandal和Rossi[10]等进行的多项重编程实验陆续开展,他们通过把以Yamanaka因子为主的不同转录因子导入到逆转录病毒、慢病毒、仙台病毒、改良后的mRNA这几种载体中,将人成纤维细胞或脐带血细胞转化为iPSCs,转化时间由12 d到40 d不等,转化效率由0.001%~4.4%不等,进一步证实了重编程方法的可行性。
此外,利用一些小分子物质部分或者完全替代重编程因子可提高转化效率,由此得到的iPSCs被称为化学诱导多能诱导干细胞(chemically induced pluripotent stem cells,ciPSCs)。这些小分子物质通过调节细胞的表观遗传学、细胞信号通路、细胞凋亡、细胞衰老和代谢等机制来发挥作用[11]。Hou等人[12]利用7种小分子完全替代外源性转录因子,成功地由MEFs得到iPSCs,转化效率达到0.2%,相比于Yamanaka等[2]的转化方法(0.01%~0.1%)效率提高将近200倍,这7种分子分别是forskolin(FSK)、2-甲基-5羟色胺(2-Me-5HT)、D4476、VPA、CHIR99021(CHIR)、616452和tranylcypromine,前三种可以代替OCT4,后四种可联合OCT4完成细胞重编程。不过迄今仍未有人源ciPSCs体外获得的报道。
1.2 iPSCs转化为MNs
iPSCs转化成MNs的过程可以分成两个阶段,第一阶段通过向iPSCs培养基内添加不同的小分子得到拟胚体(embryoidbody,EB)或神经玫瑰花样结构(neural rosette),即神经前体细胞(neural precursor cells,NPCs);第二阶段通过添加特定因子可将NPCs分化成为MNs,这一过程主要依赖于RA的尾端化和SHH的腹侧化。
Santos等人[13]在EB培养阶段的第1~7天添加了SB431542和DM,随后在培养的第5~24天添加RA和SAG1.3(分别促进神经元的尾侧化和腹侧化),第24天选出单个细胞并将其置于MNs培养基中培养,2 d后可得到有丝分裂后的MNs,转化效率为15%~25%。
Shimojo等人[14]在分化早期应用GSK-3β抑制剂和SMAD抑制剂,用以抑制细胞凋亡和促进细胞的分化增殖,一周内诱导得到表达PAX6和SOX1基因的NPCs,随后应用RA和purmorphamine活化SHH信号通路以促进NPCs的分化和增殖,两周内可得到表达HB9和ISL-1的MNs,之后在促进MNs成熟的培养基中培养4周,可以得到成熟的MNs。
iPSCs技术在应用上的局限性主要体现在三个方面:一是诱导过程复杂,耗时较长(一般为3~4周);二是转化效率较低(一般为0.001%~0.01%);三是临床应用的安全性欠缺。在向供体细胞中引入外源基因时,病毒载体可能将外源基因整合到细胞基因组中,导致供体细胞发生基因突变,此外,C-MYC和KLF4是致癌基因,因此iPSCs技术的安全性有待提高,转入因子及载体的选择需进一步改进。
2 成纤维细胞体外直接转化为MNs
细胞直接转化的第一个证据来源于PAX6,这个基因的缺失会影响前脑发育过程中神经元的形成,而单个此基因能使从大脑皮层分离的神经胶质细胞转化成神经元[15]。由此发现成熟细胞的分化状态是可逆的,采用过表达转录因子或添加小分子等方法可改变细胞类型,这种方法即为细胞直接转化。
2.1 单纯利用转录因子进行直接转化
20世纪80年代,Davis等人[16]首次利用单一转录因子MYOD(在内源性肌细胞分化过程中起重要作用的因子)成功将MEFs转化为肌细胞,给细胞直接转化技术的发展带来了希望,随后研究者们陆续发现了一些新的转录因子。
Vierbuchen等人[17]首先找出了19种在神经发育过程中起重要作用的基因,转入小鼠成纤维细胞,成功得到诱导性神经元(induced neuronal cells,iNs)。随后,为减少转录因子数量,他们利用BRN2、MYTLl、ZIC1、OLIG2和ASCL1五因子成功得到了有高度复杂形态的iNs;进一步实验证实BAM(BRN2、ASCL1、MYTLl)或BAZ(BRN2、ASCL1、ZIC1)三因子得到神经元的效率比五因子高2~3倍,其中BAM三因子得到的神经元比BAZ三因子具有更复杂的生物学形态和功能特性。但该实验得到的神经元并不特异,要得到MNs还需要添加额外的转录因子,需要进一步的实验研究。
Son等人[18]首先挑选出MNs分化过程中起重要作用的8种转录因子(SOX1、PAX6、NKX6.1、OLIG2、NGN2、LHX3、ISL1、HB9),以及上述BAM三因子,先后单独利用BAM三因子和8种MNs分化因子,结果均未由MEFs直接得到MNs,而联合应用这11种因子能够获得MNs。通过逐一排除,最终确定7因子转化体系(BAM三因子加上LHX3、ISL1、NGN2和HB9四种转录因子),转化效率可达5%~10%。在此基础上若添加NEUROD1,就可将人成纤维细胞转化成MNs。
Zhang等人[19]将上述8种转录因子(包括NEUROD1)转入SMA患者的成纤维细胞可得到患者特异性的MNs,转染后第43天,部分细胞可表达MNs标志物ISL1、CHAT和HB9。在此实验中,正常对照组和SMA组的转化效率分别是5.5%和5.8%,相差不大。但与对照组相比,SMA组得到的诱导性MNs(iMNs)在第45~48天神经突起的生长速率显著减慢,60 d后神经元明显退化,数量显著减少。这一结果与SMA患者的临床表现相一致,证实了SMA的发生机制的确与运动神经元损害相关,因此iMNs可作为SMA发病机制研究和药物筛选的细胞模型。
2.2 联合应用小分子和转录因子进行直接转化
由于单纯利用转录因子的转化效率较低,研究者们开始寻找有效的小分子物质来提高转化效率。Liu等人[20]首先选出7种与神经元发育和存活相关的小分子,尝试联合转录因子NGN2将人胚肺成纤维细胞(human fetal lung fibroblasts,HFLFs)转化成神经元,结果证实FSK和DM能使NGN2将HFLFs成功转化成MNs。但应用于出生后和成人的皮肤成纤维细胞,获得神经元的效率很低,添加转录因子SOX11和小分子FGF2,并将培养时间由4 d延长至10 d,能显著提高神经元的转化效率(第21天20.3%~57.2%表达TUJ1),与单独应用转录因子相比增高4~10倍。但此方法培养时间相对较长,得到的胆碱能神经元不表达ISL1和LHX3这两种对于MNs发育非常重要的蛋白,Liu等人[21]在此基础上又用携有NGN2、SOX11、ISL1和LHX3的慢病毒载体感染ALS患者的皮肤成纤维细胞,并添加小分子FSK、DM和FGF2,成功得到ALS患者的iMNs。这种iMNs虽然具备一般MNs的细胞和电生理特性,但存活困难、胞体缩小、活动度降低,无法形成神经肌肉接头,用于药物筛选实验,结果发现小分子物质kenpaullone可以显著促进其树突向外生长,恢复胞体大小,并能使神经元的兴奋性趋于正常,帮助提高其形成神经肌肉接头和控制肌肉运动的能力。
2.3 单纯利用小分子进行直接转化
应用载体携带外源基因进行细胞转染存在基因整合突变的安全隐患,既然小分子物质部分替代转录因子能够提高细胞转化效率,有必要研究单纯利用小分子能否实现细胞直接转化。
Li等[22]首次单纯利用小分子物质forskolin、ISX9、CHIR99021和I-BET151进行小鼠成纤维细胞的转化,成功得到有原始神经元形态并能表达TUJ1的细胞,转化效率大于90%,这种单纯应用化学物质转化得到的神经元被命名为化学诱导神经元(chemical-induced neurons)。此方法便于操作和标准化,可避免病毒载体带来的免疫原性和基因整合等安全性问题,是一种新的体外细胞直接转化的研究思路。
既往将小鼠成纤维细胞体外直接转化成iNs或iMNs的实验多采用BAM这三种转录因子,而人成纤维细胞需要额外添加NGN2,并且联合应用小分子物质的转化效率要显著高于单纯利用转录因子。成纤维细胞直接分化为iMNs的方法相比于经过iPSCs这一中间状态来说转化时间更短,效率更高,但临床应用上存在缺陷,因为通常移植细胞的需求量大,而成熟iMNs无法进行分裂增殖,所以患者能应用的体细胞数量有限,因此有必要考虑将成纤维细胞转变成可以大量增殖且具有多能性的NSCs,再将其进一步分化为MNs。
3 成纤维细胞经NSCs这一中间状态分化为MNs
目前获得iNSCs的方法主要有两种:直接诱导法和间接诱导法。直接诱导法就是在体细胞内转入NSCs表达的特定基因,或者利用microRNA等其他小分子直接得到iNSCs;间接诱导法就是在体细胞重编程为iPSCs的过程中改变诱导环境,使其成为iNSCs。
3.1 直接诱导法
Zhu等人[23]用OCT4单个基因联合A83-01、CHIR99021、NAB、LPA、rolipram和SP600125成功将人成纤维细胞诱导成能表达PAX6、NESTIN和SOX1等泛神经化标志物的iNSCs,4周后可分化出成熟神经元,移植到小鼠脑内,无肿瘤形成。
Zhao等和Capetian等[24- 25]将转录因子OCT3/4、SOX2、KLF4、L-MYC、LIN28和抑制p53基因表达的干扰RNA转入健康人的皮肤成纤维细胞内,在含有神经营养因子bFGF、EGF和FGF4的特定神经元培养基中培养,30 d后得到iNSCs。
3.2 间接诱导法
在iPSCs的诱导早期改变诱导环境,使其向NSCs方向发展即可间接获得iNSCs。Lu等人[26]用携有Yamanaka四因子的仙台RNA病毒感染人成纤维细胞,再将其置于含有重组人白血病抑制因子(leukemia inhibitory factor,LIF)(一种与多种细胞的增殖分化相关的多功能细胞因子)、SB431542和CHIR99021小分子的条件培养基中培养,可得到LIF依赖性iNSCs(LIF dependent-iNSCs,LD-iNSCs)。但此细胞的神经分化潜能需要外源性转录因子持续存在才可维持,否则长期传代(> 20代)会逐渐丧失其潜能。
Miura等人[27]利用携有OCT4、KLF4、SOX2、L-MYC和NANOG这五种基因的慢病毒转染人子宫内膜的纤维化基质细胞(endometrial fibrotic stromal cells),并将其置于含有LIF和2i(MEK1/MEK2抑制剂PD0325901和GSK-3β抑制剂CHIR99021)的培养基中继续培养,可得到人LD-iNSCs,转化效率大概是0.01%~0.03%。得到的LD-iNSCs可继续分化为MNs、多巴胺能神经元、星形胶质细胞和少突胶质细胞,并能在体外扩增100代以上。
尽管通过直接或间接诱导将成纤维细胞转化为iNSCs的方法能增加MNs数量,弥补直接转化的缺陷,但是实验过程比较复杂,转化效率相对较低,应用病毒载体存在安全性问题,因此此类方法仍有待完善。细胞分化中所用小分子物质及其作用的汇总见表1。
4 存在问题及应用前景
自2006年Yamanaka等人[2]首次利用MEFs得到iPSCs以来,细胞重编程技术逐渐兴起,各国学者从体细胞来源、转录因子、转入途径和培养条件等各个方面寻求突破,本文主要介绍了成纤维细胞体外转化得到MNs的三类方法,其中由成纤维细胞体外得到胆碱能神经元的转化效率最高可达95%[20]。这些体外得到的MNs不仅能用于运动神经元病的替代治疗,还可用于疾病发病机制的研究和药物筛选。
目前仍然有一些问题需要继续研究。一是载体的选择:尽管非基因整合载体没有基因整合过程,相对安全,但其转化效率相比于基因整合载体更低(除mRNA外),需要关注如何提高非基因整合载体的转化效率问题;二是小分子物质的选择,虽然小分子物质应用于重编程技术能提高转化效率,但大多数小分子在重编程过程中的特定影响和作用机制并不清楚,不同的小分子可能会相互影响或者对人体产生毒性,因此在临床应用上受到限制,应用的最适浓度、暴露时间、协同效应等方面都需要更多的研究。总之,利用已成熟的体细胞体外分化得到运动神经元的工作意义重大且仍需深入。
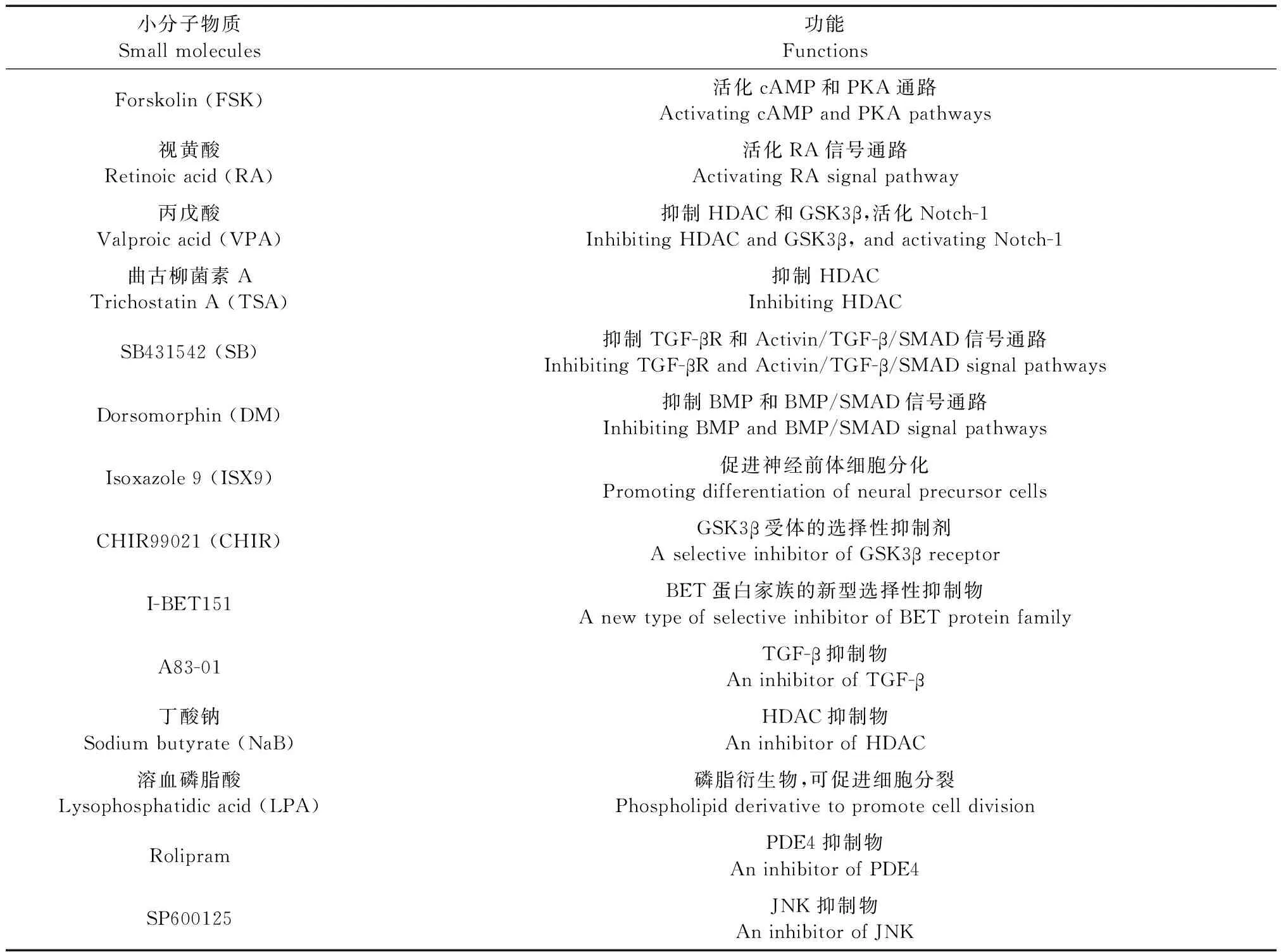
表1 细胞分化中所用小分子物质及其作用Table 1 Small molecules and their functions during cell differentiation
