建立高尿酸血症性肾损害小鼠模型的实验研究
2018-09-26裴忆雪刘永杰刘德俊徐凌云
裴忆雪,刘永杰,张 笛,刘德俊,徐凌云
(武汉轻工大学生物与制药工程学院,武汉 430023)
尿酸主要由肾脏排泄,长期高尿酸血症可导致肾脏病理性损害,可能比蛋白尿所致的肾损害更严重,约有三分之一的原发性高尿酸血症患者出现肾损害的临床表现,主要为痛风性肾病、尿酸结石或尿酸性肾病[1-2]。建立合理稳定的高尿酸血症肾损害动物模型是研究该病的病理机制及筛选治疗药物的关键。已有学者建立了多种高尿酸血症肾损害动物模型,主要采用增加尿酸前体物质、抑制尿酸酶活性及抑制尿酸排泄等方法,多采用大鼠进行造模[3-4]。这些方法有的关注于高尿酸血症、模型制作时间偏短、并未出现明显肾损害,有的是药物自身导致的肾损害、不符合高尿酸血症肾损害临床发病机制,大多数造模方法未对动物的一般情况和体重进行观察。本研究在文献调研的基础上,对多种造模剂单用、合用、不同时间不同剂量建立的小鼠病理模型进行平行比较,除观察小鼠尿酸和肾功能指标、肝脏黄嘌呤氧化酶(xanthine oxidase,XOD)和腺苷脱氨酶(adenosine deaminase,ADA)活性之外,还观察了小鼠一般情况和体重变化,为建立合理的符合临床特点的高尿酸血症肾损害动物模型提供实验依据。
1 材料和方法
1.1 实验动物
SPF级雄性KM小鼠,100只,体重25~30 g,华中科技大学实验动物中心提供[SCXK (鄂) 2016-0009],实验动物饲养于湖北省医药工业研究院有限公司动物实验中心[SYXK (鄂) 2016-0057],实验方案通过实验动物使用与管理委员会(IACUC)审批,IACUC号:20171125006,本研究过程符合实验动物使用的3R原则。
1.2 主要试剂与仪器
酵母膏,批号:20160628,北京奥博星生物技术责任公司;氧嗪酸钾盐,批号:P137112,次黄嘌呤,批号:G1725018,均购自上海阿拉丁生化科技股份有限公司;盐酸乙胺丁醇,杭州民生药业有限公司,每粒0.25 g,批号:T17A002;腺嘌呤,批号:Y26J8C40561,上海源叶生物科技有限公司;尿酸测定试剂盒(尿酸酶比色法),批号:20171201,黄嘌呤氧化酶(XOD)测试盒,批号:20180122,尿素氮试剂盒(脲酶法),批号:20171103,肌酐试剂盒,批号:20171102,考马斯亮蓝试剂盒,批号:20171219,腺苷脱氨酶(ADA)试剂盒,批号:20180122,均购自南京建成生物工程研究所。
AL204电子分析天平(梅特勒-托利多公司);SPS2001F电子天平(奥豪斯公司);TGL-16C台式离心机(上海安亭科学仪器厂);UV-2000紫外分光光度计(尤尼柯);FSH-2A可调高速匀浆机(金坛市医疗仪器厂);Eclipse Ci光学显微镜(尼康公司);ASP 200S全自动脱水机,5300全自动染封一体机,RM2016轮转式切片机(德国徕卡公司)。
1.3 实验方法
1.3.1 试剂的配制
用0.5%羧甲基纤维素钠(CMC-Na)做溶媒,分别配制20 mg/mL氧嗪酸钾混悬液、33.33 mg/mL次黄嘌呤混悬液、30 mg/mL次黄嘌呤和12.5 mg/mL乙胺丁醇混合溶液、12.5 mg/mL乙胺丁醇和5 mg/mL腺嘌呤混合溶液、1.5 g/mL酵母膏混悬液、1.5 g/mL酵母膏和5 mg/mL腺嘌呤混合溶液。
1.3.2 动物分组与造模
将小鼠随机分为正常组Ⅰ、正常组Ⅱ、正常组Ⅲ、模型A组(氧嗪酸钾)、模型B组(氧嗪酸钾)、模型C组(次黄嘌呤+氧嗪酸钾)、模型D组(次黄嘌呤+乙胺丁醇+氧嗪酸钾)、模型E组(乙胺丁醇+腺嘌呤)、模型F组(酵母膏+氧嗪酸钾)、模型G组(酵母膏+腺嘌呤+氧嗪酸钾),每组10只,正常组给予0.5% CMC-Na灌胃,模型组具体造模方法见表1。造模期间,各组小鼠自由饮水,喂饲相同质量的饲料。
1.3.3 检测指标
每天观察小鼠的一般情况并称重,计算每只小鼠的体重相对变化率(%)=(每次称量体重/实验开始时体重)× 100。
各组小鼠分别在末次造模后1 h或2 h眼球取血,室温静置1~2 h后3500 r/min离心10 min,取血清,冻存于-20℃备用,按照试剂盒的操作说明测定血清中尿酸、尿素氮、肌酐水平。颈椎脱臼处死小鼠,取肝脏,进行匀浆,3500 r/min离心10 min,取上清液,按照试剂盒操作说明测定上清液肝脏黄嘌呤氧化酶(XOD)、腺苷脱氨酶(ADA)活性。
1.3.4 肾脏病理组织学检查
实验结束后,摘取全肾组织,用10%福尔马林溶液固定。选取血尿酸、肾功能异常的造模组小鼠以及正常组肾组织进行脱水、石蜡包埋、制片(4 μm厚)、HE染色、光学显微镜观察并拍照。
1.4 统计学方法

2 结果
2.1 各组小鼠体重变化
造模7 d过程中,模型D、E组小鼠体重均呈上升趋势,但与正常组Ⅱ相比,差异均无显著性(P> 0.05),结果见图1。
造模14 d过程中,模型F、G组小鼠体重均呈上升趋势,但与正常组Ⅲ相比,差异均无显著性(P> 0.05);在造模第14天,模型F组与模型G组相比体重显著增加(P< 0.05)。结果见图2。

表1 动物分组与造模(n=10)Table 1 Test groups and the different schemes of animal modeling
注:“ig”表示灌胃;“ip”表示腹腔注射;“sc”表示皮下注射。
Note. “ig” means intragastric administration; “ip” means intraperitoneal injection; and “sc” means hypodermic injection.
2.2 各组小鼠血清尿酸、尿素氮及肌酐水平的变化
由表2可知,采用单次造模,与正常组Ⅰ相比,模型C组小鼠血清尿酸水平及尿素氮显著增高(P< 0.01),模型A组与模型B组小鼠血清尿酸、尿素氮及肌酐变化均不明显,差异无显著性(P> 0.05)。模型A组与模型B组比较,两者血清尿酸、尿素氮、肌酐水平差异均无显著性(P> 0.05),说明取血时间不影响氧嗪酸钾单次造模结果。
由表3可知,采用连续7 d造模方法,与正常组Ⅱ相比,模型D组血清尿酸水平显著升高(P< 0.01),模型E组血清尿酸水平有所降低,但差异无显著性(P> 0.05);模型D组和模型E组血清尿素氮值均显著增高(P< 0.01),但两组血清肌酐值差异均无显著性(P> 0.05)。
由表4可知,采用连续14 d造模方法,与正常组Ⅲ相比,模型F组和模型G组小鼠血清尿酸、尿素氮以及肌酐值均显著升高(P< 0.01)。
2.3 各组小鼠肝脏黄嘌呤氧化酶(XOD)、腺苷脱氨酶(ADA)活性的变化
由表5可知,与正常组Ⅰ比较,模型A、B、C组肝脏的XOD和ADA活性升高不明显,差异均无显著性(P> 0.05)。模型A组与模型B组比较,差异亦无显著性(P> 0.05)。
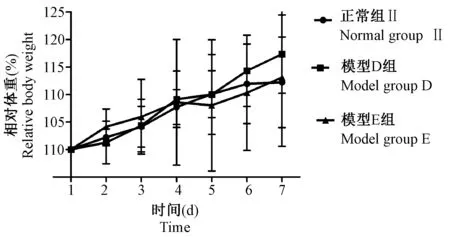
图1 连续7 d造模各组小鼠体重变化情况Figure 1 Changes in the relative mouse body weight of each group after 7-day consecutive modeling
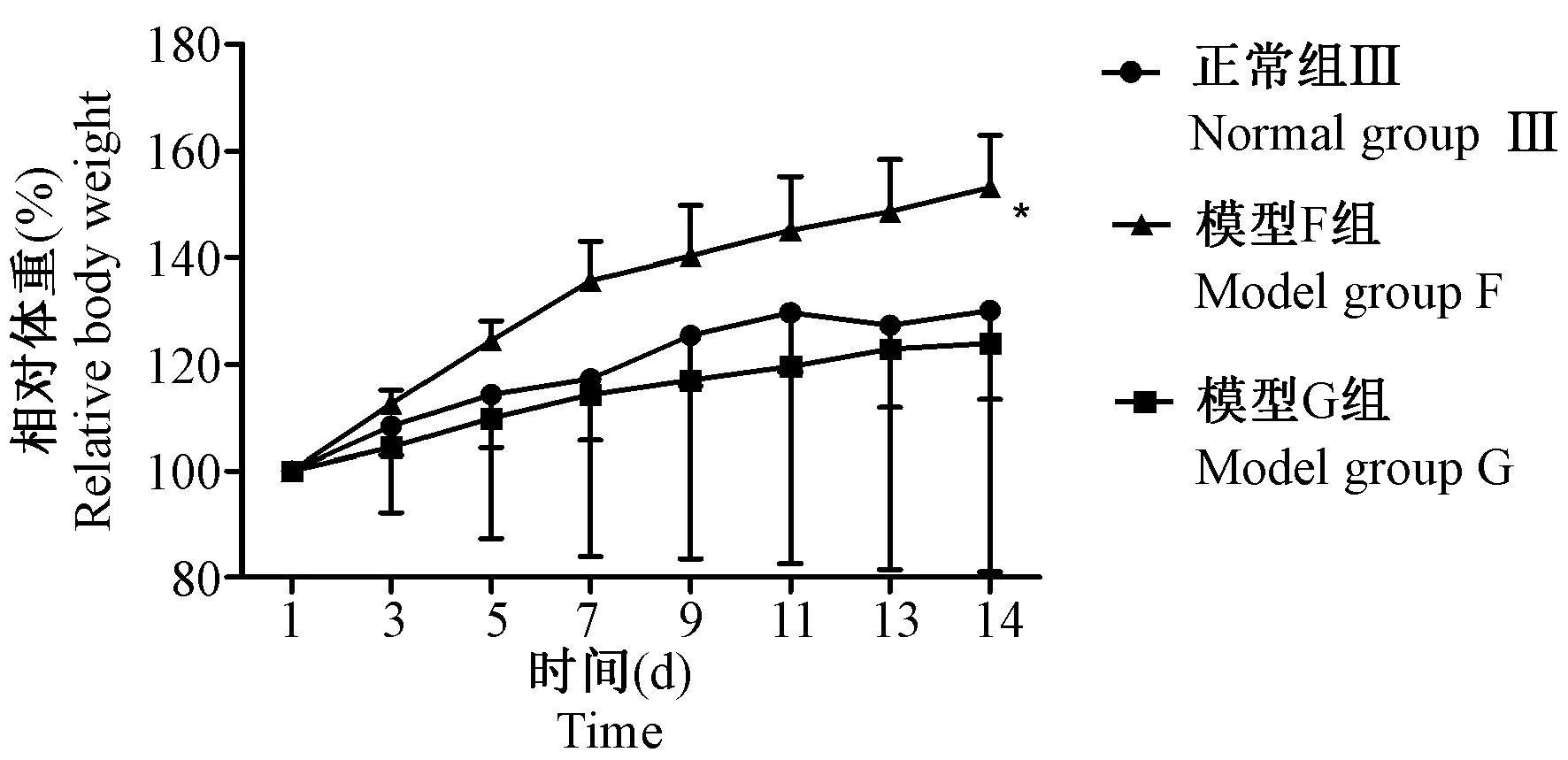
注:与模型G组比较,*P< 0.05。图2 连续14 d造模各组小鼠体重变化情况Note. Compared with the model group G,*P< 0.05.Figure 2 Changes in the relative mouse body weight of each group after 14-day consecutive modeling
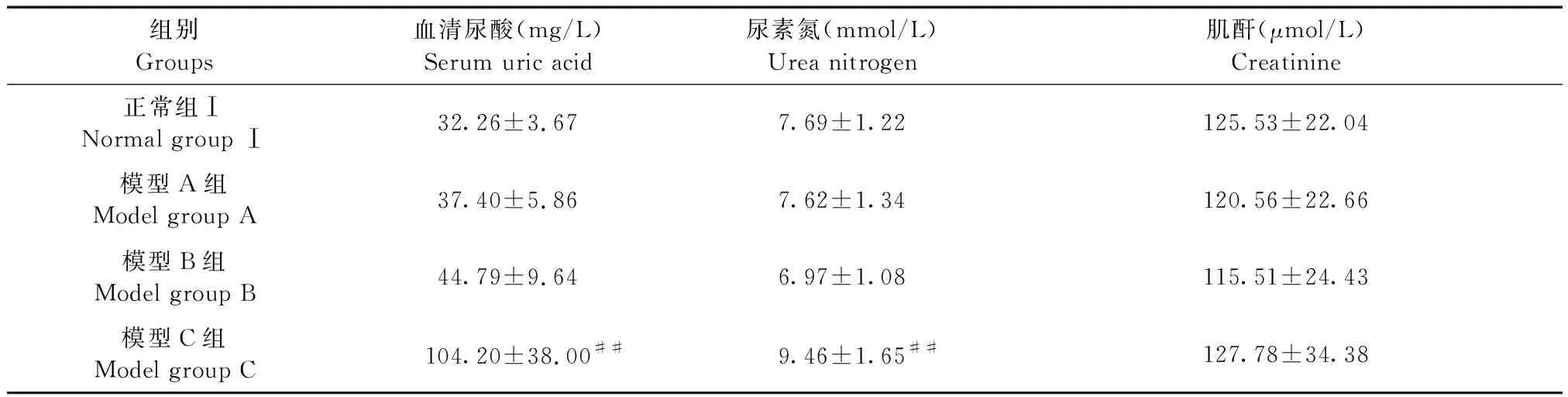
组别Groups血清尿酸(mg/L)Serum uric acid尿素氮(mmol/L)Urea nitrogen肌酐(μmol/L)Creatinine正常组ⅠNormal group Ⅰ32.26±3.677.69±1.22125.53±22.04模型A组Model group A37.40±5.867.62±1.34120.56±22.66模型B组Model group B44.79±9.646.97±1.08115.51±24.43模型C组Model group C104.20±38.00##9.46±1.65##127.78±34.38
注:与正常组Ⅰ比较,#P< 0.05,##P< 0.01。
Note. Compared with the normal group Ⅰ,#P< 0.05,##P< 0.01.
表3 连续7 d造模各组小鼠血清尿酸、尿素氮及肌酐水平变化情况Table 3 Changes in serum uric acid, urea nitrogen, and creatinine of the mice in each group after 7-day consecutive modeling
注:与正常组Ⅱ比较,#P< 0.05,##P< 0.01。
Note. Compared with the normal group Ⅱ,#P< 0.05,##P< 0.01.
由表6可知,采用连续7 d造模方法,与正常组Ⅱ比较,模型D组小鼠肝脏XOD活性明显降低(P< 0.05),但ADA活性升高不明显,差异无显著性(P> 0.05);模型E组的肝脏XOD和ADA活性差异均无显著性(P> 0.05)。
由表7可知,采用连续14 d造模方法,与正常组Ⅲ比较,模型F组、模型G组小鼠肝脏XOD和ADA活性差异均无显著性(P> 0.05)。
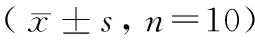
表4 连续14 d造模各组小鼠血清尿酸、尿素氮及肌酐水平变化情况Table 4 Changes in serum uric acid, urea nitrogen, and creatinine of the mice in each group after 14-day consecutive modeling
注:与正常组Ⅲ比较,#P< 0.05,##P< 0.01。
Note. Compared with the normal group Ⅲ,#P< 0.05,##P< 0.01.
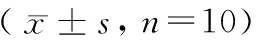
表5 单次造模各组小鼠肝脏黄嘌呤氧化酶、腺苷脱氨酶活性变化情况Table 5 Changes in liver xanthine oxidase activity and adenosine deaminase activity of the mice in each group after single modeling
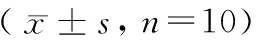
表6 连续7 d造模各组小鼠肝脏黄嘌呤氧化酶、腺苷脱氨酶活性变化情况Table 6 Changes in liver xanthine oxidase activity and adenosine deaminase activity of the mice in each group after 7-day consecutive modeling
注:与正常组Ⅱ比较,#P< 0.05。
Note. Compared with the normal group Ⅱ,#P< 0.05.
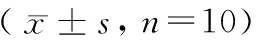
表7 连续14 d造模各组小鼠肝脏黄嘌呤氧化酶、腺苷脱氨酶活性变化情况Table 7 Changes in liver xanthine oxidase activity and adenosine deaminase activity of the mice in each group after 14-day consecutive modeling
2.4 肾脏组织病理学检测
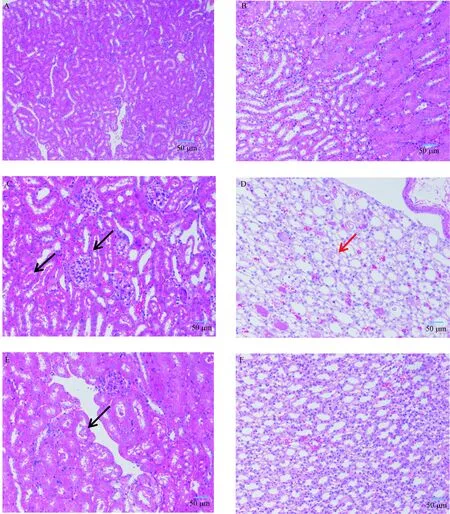
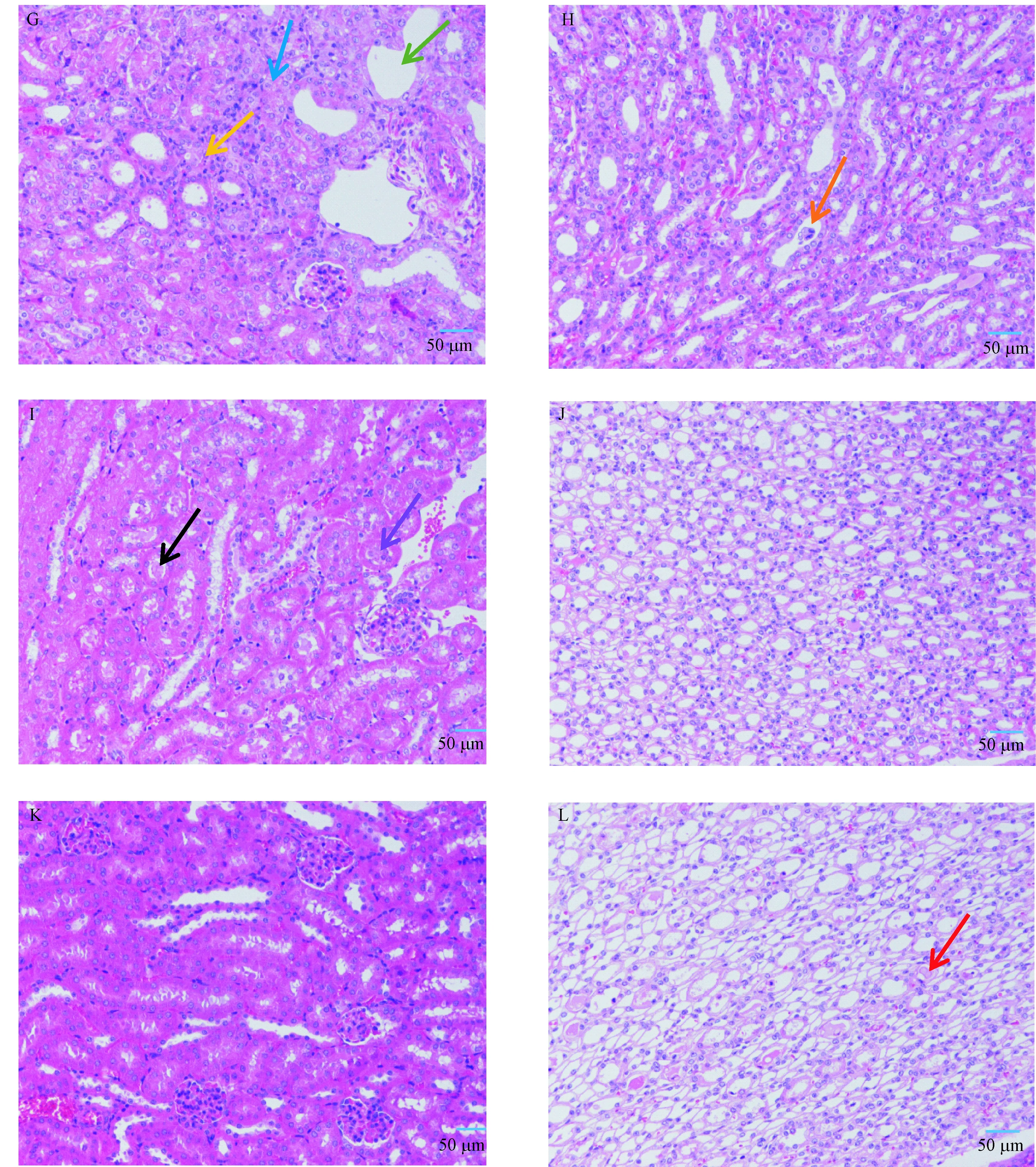
注:a:正常组肾髓质;b:正常组肾小管;c:模型C组肾皮质;d:模型C组肾髓质;e:模型D组肾皮质;f:模型D组肾髓质;g:模型E组肾皮质;h:模型E组肾髓质;i:模型F组肾皮质;j:模型F组肾髓质;k:模型G组肾皮质;l:模型G组肾髓质。黑色箭头指示嗜酸性不溶性蛋白;红色箭头指示盐类结晶;蓝色箭头指示肾小管上皮细胞水肿;黄色箭头指示肾小管上皮细胞坏死;绿色箭头指示核固缩、碎裂,肾小管扩张;橙色箭头指示肾小管核碎裂状的细胞;紫色箭头指示肾小管上皮细胞脱落。标尺=50 μm。图3 各组小鼠肾脏组织病理改变(HE染色,× 200)Note. a: Renal medulla in normal group. b: Renal tubule in normal group. c: Renal cortex in model group C. d: Renal medulla in model group C. e: Renal cortex in model group D. f: Renal medulla in model group D. g: Renal cortex in model group E. h: Renal medulla in model group E. i: Renal cortex in model group F. j: Renal medulla in model group F. k: Renal cortex in model group G. l: Renal medulla in model group G. Black arrow indicates eosinophilic insoluble protein. Red arrow indicates salt crystal. Blue arrow indicates renal tubular epithelial cell edema. Yellow arrow indicates renal tubular epithelial cell necrosis. Green arrow indicates nuclear pyknosis and fragmentation, and tubular dilation. Orange arrow indicates renal tubular cells with nuclear fragmentation. Purple arrow indicates renal tubular epithelial cell shedding. Bars=50 μm.Figure 3 Pathological changes of the renal tissues of the mice in each group. HE staining
选取正常组及模型C、D、E、F、G组的肾组织进行病理组织学检查,结果表明,正常组肾髓质皮质分界清晰,肾小球毛细血管襻结构清晰,肾小管上皮细胞结构正常,肾小管刷状缘排列整齐规则,未见明显炎症反应;模型C组肾皮质中肾小球毛细血管襻结构清晰,多见肾小管管型,近曲小管内可见嗜酸性不溶性蛋白,肾髓质中小管中少见嗜酸性不溶性蛋白,多见盐类结晶;模型D组肾皮质中部分近曲小管内可见嗜酸性不溶性蛋白,肾髓质中未见明显盐类结晶;模型E组肾皮质中多见肾小管上皮细胞水肿,少见肾小管上皮细胞坏死、核固缩、碎裂,少量肾小管扩张,肾髓质中少量小管中可见核碎裂状的细胞;模型F组肾皮质中部分肾小管上皮细胞脱落,部分近曲小管内可见嗜酸性不溶性蛋白,肾髓质中未见明显盐类结晶;模型G组肾皮质中肾小球毛细血管襻结构清晰,肾小管无明显异常,肾髓质小管中多见盐类结晶,结果见图3。
3 讨论
人体产生的尿酸约有2/3经肾脏随尿液排出,因此,高尿酸血症可导致肾功能的减退[5]。高尿酸血症引起的肾实质损害有三种类型[2]:①痛风性肾病,是由于长期轻中度高尿酸血症所致的肾脏损害,主要表现为痛风石沉积于皮髓质交界处及髓质深部呈慢性间质性炎症,导致肾脏缩小、瘢痕化;②尿酸性肾病,是大量尿酸盐结晶短时间沉积于肾脏集合管、肾盂及输尿管并堵塞肾小管,引起肾小管近端扩张,导致肾功能急性、严重损伤,引发急性肾功能衰竭;③尿酸结石,是由尿酸盐结晶形成的结石沉积于肾乳头和集合管内引起结石性梗阻。
尿酸是大多数动物体内嘌呤代谢的终产物,主要由黄嘌呤氧化酶(XOD)催化次黄嘌呤与黄嘌呤而产生,文献中常用以下方法建立高尿酸血症肾损害小鼠模型[6]:①抑制尿酸分解,尿酸酶为嘌呤代谢酶,可以将尿酸转化成尿囊素排出体外。氧嗪酸钾是尿酸酶抑制剂,通过抑制尿酸酶活性,使小鼠血尿酸水平升高。大鼠、小鼠等啮齿类动物体内存在尿酸酶,但人体内没有此酶,故采用氧嗪酸钾制备高尿酸血症肾损害模型,即使造模成功此方法也与人类高尿酸血症发病机制不尽相符。②增加尿酸的前体物质,如腺嘌呤、酵母膏、次黄嘌呤等。给予大剂量的腺嘌呤可以增强体内黄嘌呤氧化酶活性以及促进谷酰胺磷酸核糖焦磷酸转移酶的合成,加快尿酸的生成,同时异常高浓度的腺嘌呤在黄嘌呤氧化酶的作用下转变为极难溶于水的2, 8-二羟基腺嘌呤,沉积于肾小管,引起肾小管阻塞,进而导致血清尿酸、肌酐、尿素氮显著上升[7]。给予酵母膏,正常的嘌呤代谢受到大量含丰富蛋白质类的酵母的影响,致使嘌呤代谢开始紊乱,从而诱发高尿酸血症,由于血尿酸浓度的升高出现肾小管功能异常,渐至肾小球的损害而造成肾功能受损[8-9];给予次黄嘌呤,它在黄嘌呤氧化酶的作用下生成尿酸前体物质黄嘌呤,进而形成尿酸。③抑制尿酸排泄,乙胺丁醇其代谢产物吡嗪酸可抑制肾小管对尿酸的分泌,从而抑制肾脏对尿酸的排泄使血尿酸升高[10]。
本研究使用氧嗪酸钾、次黄嘌呤、腺嘌呤、乙胺丁醇、酵母膏5种造模剂,单用或联用这些造模剂,即单用尿酸酶抑制剂氧嗪酸钾;联用尿酸前体物质(次黄嘌呤、酵母膏或腺嘌呤)和尿酸酶抑制剂(氧嗪酸钾);联用尿酸前体物质(腺嘌呤)和抑制尿酸排泄药(乙胺丁醇);联用尿酸前体物质(次黄嘌)、尿酸酶抑制剂(氧嗪酸钾)以及抑制尿酸排泄药(乙胺丁醇)。观察不同造模机制、造模时间、造模剂量对病理模型的影响,从而设定了7个造模组。
本研究用氧嗪酸钾400 mg/kg单次腹腔注射,造模后1 h和2 h取血,其尿酸水平与正常组相比无明显差异,造模不成功,文献也报道此种造模方法不稳定,重复性不好[11-12]。本研究采用500 mg/kg次黄嘌呤与300 mg/kg氧嗪酸钾联合单次给药造模,小鼠血清尿酸及尿素氮水平显著升高,肾脏组织病理学检查也发现其肾小管受损伴有尿酸盐结晶沉积,说明此造模方式可诱导高尿酸血症并对肾功能有一定损害,与文献报道相符[13],但此方法为单次造模,可观察预防性给药的疗效,对治疗性用药的疗效无法观察。
本研究采用250 mg/kg乙胺丁醇与100 mg/kg腺嘌呤连续7 d造模,血清尿酸水平与正常组相比没有明显变化,但尿素氮水平显著升高,组织病理学检测发现其肾皮质中可见肾小管上皮细胞水肿,少量肾小管上皮细胞坏死,核固缩、碎裂,少量肾小管扩张,肾髓质中少量小管中可见核碎裂状的细胞,此种造模方法可造成显著的肾功能损害,考虑是由造模剂直接引起肾功能损伤,与高尿酸血症导致肾损害病理机制不符。
施琬等[14]采用25 g/kg次黄嘌呤饲料喂养联合250 mg/kg乙胺丁醇灌胃,同时皮下注射200 mg/kg氧嗪酸钾制备高尿酸血症大鼠模型,Han等[15]采用100 mg/kg次黄嘌呤联合250 mg/kg乙胺丁醇灌胃,同时皮下注射200 mg/kg氧嗪酸钾,连续17 d,制备大鼠高尿酸血症肾损害模型,其血清尿酸、尿素氮、肌酐水平均显著升高,组织病理学检查发现明显的肾功能损害。由于饲料中加用次黄嘌呤,其造模剂量不可控,且本研究采用小鼠进行造模,因此将次黄嘌呤改为用600 mg/kg直接灌胃,并与乙胺丁醇和氧嗪酸钾联合造模7 d,结果表明小鼠血清尿酸、尿素氮水平均明显升高,组织病理学检查发现肾脏近曲小管内可见嗜酸性不溶性蛋白,此造模方法能够造成小鼠高尿酸血症性肾损害,但该模型中小鼠肝脏XOD活性显著降低,有文献报道肝脏中XOD活性降低时伴随血清中XOD活性升高[16],因此考虑其血清中XOD有变化,这提示应同时测定血清中XOD活性。此种造模方式小鼠精神状态不佳,体重无明显降低,同时乙胺丁醇竞争性抑制肾小管分泌尿酸,导致肾脏受损,因此采用乙胺丁醇造模不符合高尿酸血症肾损害临床发病机制[17]。
本研究采用30 g/kg酵母膏+ 300 mg/kg氧嗪酸钾联合和30 g/kg酵母膏+ 100 mg/kg腺嘌呤+ 300 mg/kg氧嗪酸钾联用连续14 d造模,结果表明小鼠血清尿酸、尿素氮、肌酐水平均明显升高,肾脏组织病理观察发现酵母膏+氧嗪酸钾联用组肾小管上皮细胞脱落,部分近曲小管内可见嗜酸性不溶性蛋白,酵母膏+腺嘌呤+氧嗪酸钾联用组小鼠肾髓质小管中多见盐类结晶,两种造模方法均可造成显著的肾功能损害,但是酵母膏+氧嗪酸钾组小鼠体重较酵母膏+腺嘌呤+氧嗪酸钾组显著增加,而且腺嘌呤可导致大鼠慢性肾功能疾病[18-19],其造模引起的肾脏病变也并非全因高尿酸血症引发,故采用酵母膏和氧嗪酸钾联用长期造模方式更为合适。
综上所述,单次造模对小鼠肾脏损伤不大,而长期造模均能够导致小鼠肾脏损害,因此笔者建议采用酵母膏和氧嗪酸钾联合连续14 d造模建立小鼠高尿酸血症肾损害模型更合适。
