528例先天性心脏病患儿心内直视手术无血预充体外循环的管理
2018-09-25崔洁姚尧徐红珍吴春
崔洁,姚尧,徐红珍,吴春
方法:回顾性分析重庆医科大学附属儿童医院2013-11至2016-11收治的先心病528例患儿心内直视手术无血预充体外循环情况。所有患儿均行气管插管全身麻醉,体外循环下完成心内畸形矫治手术,选用改良体外循环管路减少预充量,依据患儿术前红细胞压积(HCT)水平,选用急性等容性血液稀释性自体输血技术,使用血液回收机行回收式自体输血技术减少血液丢失,依据体外循环情况行常规超滤、平衡超滤及改良超滤,实现无血体外循环。
结果:528 例不同体重患儿的预充量:<5 kg(160~180)ml,5~12 kg(220~250) ml,12~28 kg(300~350 ml),>28 kg(600~650)ml;入室后的平均HCT(36.1±5.9)%,实施无血预充,体外循环 5 min时HCT(24.3±3.1)%,停机前HCT(24.8±3.0)%,出室前HCT(32.1±3.8)%。其中有43例(8.1%)患儿体外循环过程中输注库存血,停机后有25例(4.8%)患儿输注库血。行急性等容性血液稀释性自体输血的患儿共72例(13.6%),共放血15 520 ml。术中195例复杂先心病患儿中有189例(96.9%)使用血液回收机,333例单纯房间隔缺损、室间隔缺损及合并动脉导管未闭患儿中,仅有3例(9.0%)使用血液回收,且均为稀有血型患儿。体外循环过程中使用常规超滤 223例(42.2%),平衡超滤211例(40.0%)及改良超滤247例(46.8%)。
结论:小儿先心病手术的无血体外循环有其复杂性及特殊性。对于体重和HCT水平合适的患儿,使用改良体外循环管路,结合急性等容性血液稀释及回收式自体输血、超滤技术,无血预充能够安全地在儿童先心病手术体外循环中实施,从而实现节约用血,减少异体输血的并发症,促进患儿早日康复。
随着医学的发展,越来越多的研究证明了术中输注库血与患者预后有着直接关系[1],其中包括库血输注导致的血液传染病传播;机体内环境紊乱(酸血症、高血钾、低血钙、高乳酸血症等);细胞免疫功能抑制,增加炎症反应及院内感染的风险[2];Silliman等[3]学者提出输血增加术后脏器功能不全的风险,并且有研究报道陈旧库存血的输注与术后严重并发症的发生和机械通气时间也密切相关[4,5];除此之外,日益增长的手术量对血液的需求也日益增加,各地医院出现因“血荒”造成手术无法实施的现象。因此实施无血预充体外循环(CPB)心脏手术意义重大。众所周知,在儿童先天性心脏病(先心病)矫治手术中,由于儿童体重小,相对预充量大,新陈代谢旺盛,对氧及底物的需求较高,但氧储备能力较差,故常需预充库存红细胞以满足体外循环中红细胞压积(HCT)及氧供。本研究通过使用改良微型体外循环管道,尽量减少预充量;结合急性等容性血液稀释性自体输血及回收式自体输血及超滤技术的综合方式实施儿童无血预充体外循环。
1 资料与方法
临床资料:我院自2013-11至2016-11,共完成无血预充体外循环先心病手术528例,男298例,女230例,年龄(47.4±39.1)个月,体重(15.0±7.31)kg。其中单纯房间隔缺损、室间隔缺损及合并动脉导管未闭共333例( 63.1 %),复杂性先心病共195例(36.9%),其中法乐四联症66例,右心室双出口38例,完全型及部分型肺静脉异位引流27例,完全型及部分型房室间隔缺损17例,三尖瓣闭锁、下移畸形14例,肺动脉(瓣)闭锁13例,大动脉转位7例,主动脉弓离断及缩窄7例,右心室发育不良及单心室5例,主肺动脉窗1例。患儿术前常规行X线胸片、超声心动图、心电图检查,复杂畸形行计算机断层摄影术(CT)血管重建明确诊断。
设备及预充:体外循环采用Stockert S3人工心肺机(德国史托克有限公司),动脉微栓一体化Maquet11000( 德 国Maquet CARDIOPULMONARY AG公 司 )、Maquet 31000( 德 国 Maquet CARDIOPULMONARY AG公司)、Dideco 100(意大利索林集团有限公司)、Dideco 101(意大利索林集团有限公司)、Inspire 6(意大利索林集团有限公司)膜式氧合器,动静脉插管(中国宁波菲拉尔医疗用品有限公司),改良A、B、C、D 型(图1~4)循环管路(中国宁波菲拉尔医疗用品有限公司),改良后A、B、C、D型管路预充量分别为250 ml、180 ml、110 ml、70 ml,Dideco 570小儿超滤器(意大利索林集团有限公司),血液回收机(德国-费森尤斯);血气分析仪(丹麦雷度米特公司),活化凝血时间(ACT)检测仪(美国美敦力公司)。精确计算预充量,使患儿预充液晶:胶体 =(0.3~0.5):1,体外循环中晶:胶体 =(0.5~0.6):1,使胶体渗透压维持在12~14 mmHg(1mmHg=0.133 kPa),预冲液成分有复方电解质、20%人血白蛋白、万纹、5%碳酸氢钠,甲泼尼龙、乌司他丁、磷酸肌酸钠、呋塞米、氨基己酸及各种电解质成分等。
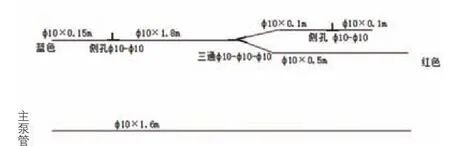
图1 改良后A型体外循环管路
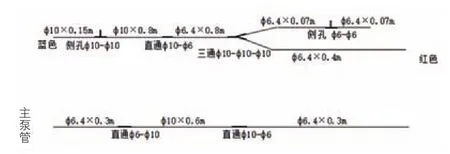
图2 改良后B型体外循环管路
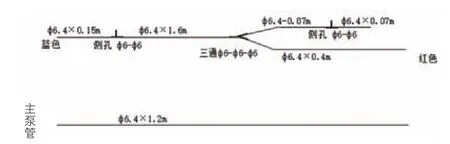
图3 改良后C型体外循环管路
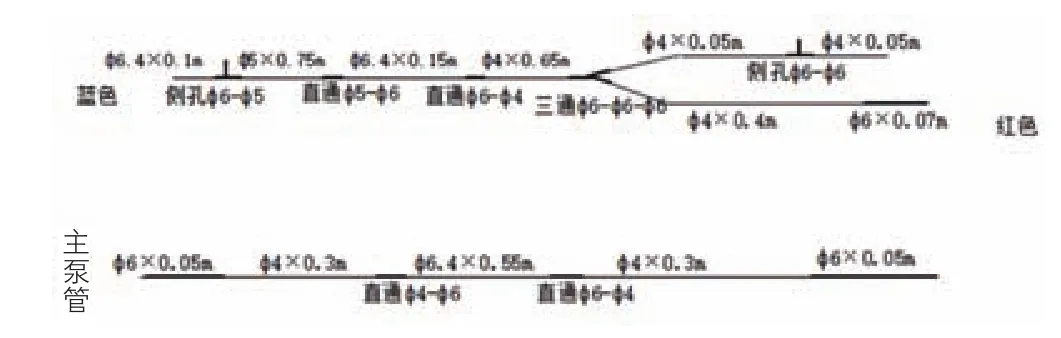
图4 改良后D型体外循环管路
体外循环方法:528例患儿均采用气管内插管静吸复合麻醉,行动静脉穿刺测压。入室后精确测量体重,依据患儿体重选择相应的膜肺、体外循环管路及动静脉插管。常规胸部正中切口,经升主动脉、右心房插管建立体外循环,为减少预充量,将上下腔静脉通过Y型接头与同一根静脉连接,转流开始后待温度降至需要的温度时阻断上下腔静脉,确定引流良好后阻断主动脉,在主动脉根部通过停跳液针灌注康斯特保护液(HTK液)或者托马斯心肌保护液。依据患儿病情、体重及手术方式选择相应的体外循环温度、合适的灌注流量及氧流量、氧浓度,并且依据血气分析结果进行调整。转流中依据患儿病情选择使用超滤器(动脉-静脉连接)进行常规超滤、平衡超滤及改良超滤。
选用无血预充标准:入室后行血气分析,对于体重< 5 kg患儿及术前有红细胞代偿性增多的紫绀型先心病患儿,依据所选膜肺及体外循环管路的预充量,估算血液稀释后HCT不低于25%(8.5 g/dl),一般病种不低于21%(7 g/dl)[6-8]。
体外循环中输血标准:当HCT低于上述标准,且混合静脉血氧饱和度下降或<60%,血气中碱剩余(BE) <-3,通过超滤和增加灌注流量后机体缺氧改善不佳,可考虑为“低血红蛋白浓度引起的缺氧症状”,则需要立即输注库存红细胞[7]。
体外循环后输血标准:停体外循环后出手术室前,麻醉医师复查血气,对于术前心肺功能良好的一般病种患儿,HCT应维持在30%以上,对于术前有红细胞代偿性增多的紫绀型先心病患儿HCT应维持在40%~45%,当血气分析结果低于上述值时,则考虑输注库存血,同时根据纵隔引流量及伤口渗血情况给与补充[8]。
入室后行急性等容性血液稀释性自体输血标准:患儿行急性等容性血液稀释后,仍能够满足无血预充体外循环的标准。体外循环前放血量满足公式 :(患儿血容量-放血量)×患儿入室HCT/(患儿血容量+管路预充量)≥25%或21%。
选择使用超滤的标准:对于体外循环时间>90 min,血液过度稀释,心肺功能差、心力衰竭的患儿,常规使用超滤技术(常规超滤、平衡超滤及改良超滤)。
资料收集:记录患儿一般资料,转流预充量,入室后、体外循环5 min、停机前及出室前血气分析结果,术中用血情况,体外循环时间及主动脉阻断时间,术前行急性等容性血液稀释放血量及行超滤情况。
统计学方法:计量资料以均数±标准差( ±s),计数资料采用频率和率表示。
2 结果
528例不同体重的患儿预充量情况(表1):依据患儿年龄体重选择相应的膜肺及改良管路,精确计算患儿预充量,其中体重<5 kg患儿预充量为160~180 ml,体重 5~12 kg患儿预充量为 220~250 ml,体重12~28 kg患儿预充量为300~350 ml,体重>28 kg 患儿预充量为 600~650 ml。

表1 528例不同体重患儿的预充量
528例患儿术前的基本情况: (1)血气分析HCT结果:所有患儿入室后、体外循环 5 min 、停体外循环 前及出手术室前患儿HCT分别为(36.1±5.9)%、(24.3±3.1)%、(24.8±3.0)%、(32.1±3.8)%。(2)输血情况: 体外循环中有43例(8.1%)患儿输注库存血,共输注21.5 U,停机后有25例(4.8%)患儿输注库存血,共输注17.25 U。(3)体外循环 时间:所有患儿体外循环时间23~313 min,平均89 min。主动脉阻断时间0~155 min,平均47.3 min。
528例患儿的术中情况:528例患儿中,行急性等容性血液稀释性自体输血的患儿共72例(13.6%),共放血15 520 ml。体外循环过程中使用常规超滤223例(42.2%),平衡超滤211例(40.0%)及改良超滤247例(46.8%)。195例复杂先心病患儿中有189例(96.9%)使用血液回收机,共回收20 979 ml自体血;333例单纯房间隔缺损、室间隔缺损及合并动脉导管未闭患儿中,仅有3例(9.0%)使用血液回收,共回收295 ml自体血,且均为稀有血型患儿。
528例不同体重患儿实施无血预充体外循环的结果(表2):528例患儿随着体重的增加,无血预充体外循环的比例逐渐增加,较大的患儿较易实现无血体外循环。其中7例体重<5 kg(3.5~5 kg)患儿,且均为复杂性紫绀型先心病,1例大动脉转位,2例肺动脉瓣闭锁,2例三尖瓣闭锁,2例肺静脉异位引流;患儿术前HCT为40%~64%,均选用Dideco100婴儿型膜肺和改良D型体外循环 管路,使预充量为160~180 ml,体外循环 5 min后 HCT为 27%~40%,满足安全的血液稀释要求;术中均运用超滤及血液回收技术;有2例患儿因体外循环时间过长,血液丢失及破坏过多,输注100 ml库存血,其余5例均为无血手术;出室前HCT为35%~44%。
528例患儿的术后结果:本研究中有3例患儿体外循环后渗出血较多,胸腔引流管引流量大,补充凝血因子及血小板后引流量无明显改善,考虑存在外科活动性出血,行开胸探查找到出血点,其中2例为胸腺部分切除处小血管出血,1例为胸壁处小血管出血,结扎出血血管后出血明显改善。

表2 528例不同体重患者实施无血预充体外循环情况
3 讨论
婴幼儿体重小,相对预充量大,因而实现无血体外循环需要相应的技术支持,我院采用综合策略实现无血体外循环:包括使用改良微型体外循环管道,根据体重精确的计算预充量减小预充,运用急性等容性血液稀释性自体输血及回收式自体输血实现自体血回输以及合理运用平衡超滤、常规超滤、改良超滤。
实现无血预充,选择合适的患者是首要步骤。体重< 5 kg患儿及术前有红细胞代偿性增多的发绀型先心病患儿,估算血液稀释后HCT不低于25%(8.5 g/dl),一般病种HCT不低于21%(7 g/dl),此标准为国内外公认的安全的血液稀释标准,并且体外循环过程中伴随不同程度降温,机体的氧耗减少,故此标准下患儿不会因为血液过度稀释而导致机体缺氧。本研究显示行无血预充的患儿入室前HCT(36.1±5.9)%,即入室前HCT大于36%患儿较易实现无血预充,与阜外医院所得结论相一致[9]。
使用微型管道以降低预充量是实现无血预充的关键。同时还可以降低血液与体外循环管路的接触面积,有助于降低全身炎症反应程度[10],我院麻醉科体外循环小组将儿童所使用的管路套包进一步缩小、简化,大大减小了患儿所需的预充量。
运用急性等容性血液稀释性自体输血。对于部分体重较大、高HCT及发绀型先心病患儿在麻醉后、体外循环之前,采集适量的血液用枸橼酸钠液保存,同时输注适量晶体及胶体,维持循环及胶体渗透压稳定,体外循环之后将这类富含凝血因子、血浆、血小板的自体血(新鲜全血)回输给患者。这样既减少体外循环过程中对血液的破坏及术中丢失的各类血液成分,同时也减少异体输血带来的各类并发症,大大减少术后库血及血浆、冷沉淀及血小板的输注。
超滤技术在提高体外循环中HCT和改善患儿心肺功能、减轻组织水肿等方面有着明显的效果,尤其在儿童体外循环管理中的优势已经被广泛认可。改良超滤技术是由英国儿童医院Naik等[11]发明并运用于临床的,通过A-V回路的连接,对于部分HCT未达到满意状态的患儿,在体外循环结束后立即实施。大量报道显示,改良超滤对于提高新生儿和婴儿的HCT水平,改善血液动力学及对患儿术后早期心肺保护有着积极作用[12,13],并且有研究表明,在体外循环中使用改良超滤可以提高体外循环后的血小板计数、血浆蛋白、白蛋白、凝血酶原及纤维蛋白原水平,减少术后胸腔引流量,从而减少患儿术后对红细胞、新鲜冰冻血浆、血小板及白蛋白等血液制品的需求[14]。我科对于体外循环时间超过90 min、血液过度稀释、心肺功能差、心力衰竭的患儿,常规使用超滤技术。
在本研究中,无血预充体外循环占总体外循环量的比例三年中均在30%以上,体重较大的患儿较易实现无血体外循环,5~12 kg的患儿中只有15.70%实现了无血预充体外循环,而对于低体重患儿(<5 kg)行无血预充是极大的挑战。Boettcher 等[15]与 Ging等[16]对3~5 kg的新生儿实行无血预充体外循环下先心病手术有过个案报道,报道均表示,减小预充量是实现新生儿无血体外循环的关键。有研究[17,18]通过使用一种新型的微小体外循环系统,对1.7 kg和2.2 kg的2例新生儿实施了无血体外循环。我院通过改良体外循环管路,在安全的前提下尽可能的减少预充量,在传统体外循环机及膜肺下结合血液回输及超滤技术也同样完成了对低体重患儿的无血体外循环 。
本研究中有43例患儿体外循环中输注了库存血,分析其原因:(1)术中较多血液通过外吸丢失而未通过心内吸引器进入储血罐。我院对于手术时间长、出血量多的复杂先心病患儿及稀有血型患儿术中常规使用血液回收机,但对于手术时间短,出血量少的房间隔缺损、室间隔缺损修补手术没有常规使用血液回收机。因此个别患儿术中部分血液通过外吸丢失。(2)部分停跳液及术中冲洗用水通过吸引泵管进入储血器使血液过度稀释。(3)手术及体外循环时间长,血液破坏较多。停机后有25例患儿输注库存血,分析其原因为:(1)部分复杂先心病手术患儿手术时间长,凝血功能受到破坏,渗出血较多。Lyengar等[19]报道显示,体外循环时间与输血明显相关,长时间的体外循环使血液与管路内表面接触,激活了内源性凝血途径,纤维蛋白原及纤维蛋白在管路中沉积,形成微血栓,进一步消耗了凝血因子及血小板,并且影响了血小板功能和凝血系统功能,同时炎症反应的发生几率也增加,引起溶血或失血。(2)鱼精蛋白未充分中和肝素。肝素中和不足是小儿体外循环后出血的重要因素,当鱼精蛋白过量时也会损害血小板功能,同样影响凝血功能,当对肝素和鱼精蛋白的使用进行个体化指导,患儿去肝素化后的出血量明显减少[20]。即通常鱼精蛋白(mg):肝素(mg)≈(1.2~1.5):1,去肝素化后复查ACT,若ACT明显高于患儿入室时的基础ACT值,并结合外科医师术野渗出血情况,适当补充5 mg鱼精蛋白并再次复查ACT值,若ACT恢复正常,手术术野渗出血减少则考虑为肝素中和不足,若ACT无明显改善则考虑凝血因子及血小板不足,进一步行血栓弹力图检测明确原因。(3)可能存在外科出血。因此针对以上输血因素,我们建议在儿童先心病手术体外循环管理中,合理使用血液回收机,将无菌术野的血液回收,然后进行洗涤,将血液浓缩至一定的HCT后输回至患儿体内,以减少血液丢失;适度血液稀释,合理使用超滤浓缩血液;停机后充分中和肝素,输注体外循环余血每100 ml后补充5 mg鱼精蛋白,对于手术时间长,血液破坏重的患儿停机后补充凝血因子、血浆及血小板改善凝血功能;外科医生做到彻底止血。
综上所述,选择合适的患者(血液稀释后HCT不低于21%或25%),使用改良体外循环管路,小预充,结合急性等容性血液稀释及回收式自体输血,超滤技术,无血预充能够安全地在儿童先心病手术体外循环中实施。这对于减少异体输血的并发症,缓解血源紧张,遵循规范合理安全用血的原则有着重大意义。
