一氧化氮对常温贮藏下芒果果实软化 和细胞壁代谢的影响
2018-09-22何俊瑜任艳芳陈元有王艳玲
何俊瑜,任艳芳,,*,陈元有,王艳玲,林 肖,刘 冬
(1.常州大学环境与安全工程学院,江苏常州 213164; 2.贵州大学农学院,贵州贵阳 550025)
芒果(MangiferaindicaL.)是世界上重要的热带水果,不仅风味独特、色泽诱人,而且富含多种营养成分,因此深受消费者喜爱,被誉为“果中之王”[1]。然而,芒果采后生理代谢依然十分旺盛,后熟软化迅速,不仅导致果实品质降低,而且软化的果实更易引起病原微生物的侵染,给贮藏、运输、销售等环节带来极大困难,造成巨大的经济损失[2]。据估计,芒果从采收到消费阶段,损失率可以达到25%~40%[3]。因此,采取有效措施延缓采后芒果软化和品质劣变,是目前芒果贮藏保鲜中亟待解决的重要问题。
一氧化氮(Nitric oxide,NO)是存在于植物体内的一种重要的信号分子,其广泛参与植物的生长、发育、成熟、衰老等生理过程[4-6]。近年来,有关外源NO调控果蔬成熟、抗病和保鲜的研究报道越来越多,已成为采后生物学领域的研究热点之一。已有研究表明,适宜浓度的NO处理可有效延缓桃子[7]、番茄[8]、木瓜[5]、荔枝[9]、香蕉[10]、柑橘[11]等采后果蔬的成熟衰老,延缓果实的褐变,维持果实贮藏品质和提高其对采后冷害和病害的抵抗能力。此外,研究表明,NO可以通过调节果实中的细胞壁水解酶,如多聚半乳糖醛酸酶(Polygalacturonases,PG)、果胶甲酯酶(Pectin methylesterase,PME)、纤维素酶(Cellulose,CX)、β-半乳糖苷酶(β-galactosidase,β-Gal)活性和基因的表达,从而延缓果实的软化进程[8,13-16]。
目前,NO在芒果保鲜上的作用效果已有报道[17-19],但对于其在芒果后熟软化和细胞壁代谢方面的研究报道还较为缺乏。本实验在前期实验的基础上[1],研究SNP处理对芒果常温后熟软化和细胞壁代谢的影响,探讨采后NO处理延缓芒果果实软化的作用机理,旨在为采后芒果的贮藏保鲜提供的理论和实践依据。
1 材料与方法
1.1 材料与仪器
“台农”芒果(MangiferaindicaL. cv. Tainong) 贵阳市石板镇农产品批发市场,购买当天运回实验室进行处理;硝普钠(SNP)、柑橘果胶、D-(+)-半乳糖醛酸、羧甲基纤维素钠、对硝基苯-α-D-阿拉伯呋喃糖苷、对硝基酚、对硝基苯-β-D-半乳糖苷 美国Sigma公司。
GY-1型水果硬度计 杭州托普仪器有限公司;HH-S6数显电热恒温水浴锅 金坛市国旺仪器厂;T6新世纪紫外可见分光光度计 北京普析通用仪器有限责任公司;5804R型高速冷冻离心机 上海艾本德中国有限公司。
1.2 实验方法
1.2.1 芒果果实的处理方法 选择大小、成熟度基本一致(硬度14.4 kg/cm2,可溶性固形物8.5%)、无病虫害、无畸形、无机械损伤、未经过催熟处理的芒果果实,以0.5%次氯酸钠溶液(有效氯≥10%)浸泡3 min,清水冲洗干净。将挑选出的芒果果实随机分为2组,分别置于清水(CK)和0.25 mmol/L SNP溶液中浸泡20 min后[1],自然晾干。将芒果果实装入铺有多层软纸的塑料框中,于常温(20±2 ℃)条件下贮藏20 d。每个处理60个果实,重复3次。贮藏期间每5 d取样一次,每个重复取5个芒果,用于测定果实硬度、果胶物质含量、纤维素含量和细胞壁水解酶活性。
1.2.2 相关指标的测定方法
1.2.2.1 硬度 果实硬度采用果实硬度计测定。单果取去皮赤道部位果肉4个点测定,取平均值,以kg/cm2表示。
1.2.2.2 果胶物质含量 原果胶含量及水溶性果胶含量的测定采用咔唑比色法[20]。以半乳糖醛酸标品作标准曲线,y=0.5139x+0.2127(R2=0.9981),根据标准曲线计算半乳糖醛酸质量,以样品中生成的半乳糖醛酸质量占样品质量的百分数(%)表示原果胶和水溶性果胶含量。
1.2.2.3 纤维素含量 纤维素含量测定采用蒽酮比色法[21]。以葡萄糖标品作标准曲线,y=0.031x+0.0306(R2=0.9987),根据标准曲线计算葡萄糖含量,以样品中葡萄糖含量占样品质量的百分数(%)表示纤维素含量。
1.2.2.4 细胞壁水解酶 取果肉2.0 g,样品放于冷冻过的研钵内,加入6 mL Tris-HCl溶液(50 mmol/L,pH7.0),内含 2 mol/L NaCl、10 mmol/L EDTA 和 5 g/L(W/V)PVPP,冰浴上研磨匀浆,于4 ℃、12000 r/min离心20 min,取上清液用于酶活性测定。
PG活性的测定采用3,5-二硝基水杨酸比色法[20]。以D-(+)半乳糖醛酸为标样作标准曲线,y=0.1061x-0.0388(R2=0.9995)。以每小时每克鲜样37 ℃分解多聚半乳糖醛酸钠产生1 mg游离半乳糖醛酸为1个PG活力单位(U),即表示为U/(h·g FW)。
PME活性的测定参考徐晓波[22]的方法。反应液含有2 mL 0.5%柑橘果胶、0.3 mL 0.01%溴麝香草酚兰,加水使总体积为3 mL,最后加入400 μL酶液,测定波长620 nm处吸光值。以每克鲜样每分钟620 nm处吸光值变化0.01为一个酶活力单位(U),即表示为U/(min·g FW)。
CX活性的测定采用3,5-二硝基水杨酸比色法[20]。以葡萄糖为标样作标准曲线,y=0.1196x-0.0205(R2=0.9994)。以每毫升酶液每分钟产生相当于1 mg葡萄糖的还原糖为1个酶活性单位(U),即表示为U/(h·g FW)。
β-Gal活性的测定参考Ali等[23]的测定方法。以对硝基酚为标样作标准曲线,y=0.2238x-0.2101(R2=0.9998)。以每分钟每克鲜样37 ℃分解对硝基苯-β-D-半乳糖苷产生1 μmol对硝基酚量为1个β-Gal酶活性单位(U),即表示为U/(h·g FW)。
α-阿拉伯呋喃糖苷酶(α-L-arabinofuranosidase,α-L-Af)活性的测定参考Ali等[23]的测定方法。以对硝基酚为标样作标准曲线,y=0.0623x+0.0137(R2=0.9989)。以每分钟每克鲜样37 ℃分解对硝基苯-α-D-阿拉伯呋喃糖苷产生1 μmol对硝基酚量表示为1个α-L-Af酶活性单位(U),即表示为U/(h·g FW)。
1.3 数据处理
运用SPSS 20.0软件对试验数据进行分析,p<0.05、p<0.01分别表示差异显著、极显著。采用Origin Pro 8.0 软件绘制曲线。
2 结果与分析
2.1 SNP对芒果果实硬度的影响
硬度是衡量果实软化衰老程度的重要指标。图1表明,贮藏期间芒果果实硬度呈现逐渐降低的趋势。与贮藏前相比,在贮藏5 d时,对照和SNP处理中果实硬度分别降低了27.2%和14.9%。随着贮藏时间的延长,对照和SNP处理的果实硬度迅速降低。然而与对照相比,整个贮藏期间,SNP处理显著延缓了果实硬度下降的程度。至贮藏第20 d时,SNP处理中果实硬度为对照的3.0倍,极显著高于对照(p<0.01)。这与NO对“Kensington Pride”芒果[17]和Keitt芒果[24]的研究结果相一致。

图1 贮藏期间芒果果实硬度的变化Fig.1 Changes in firmness of mango fruit during storage注:“*”和“**”分别表示同一时间点不同处理间存在 显著差异(p<0.05)和极显著差异(p<0.01);图2~图7同。
2.2 SNP对芒果果实果胶含量的影响
果胶是构成细胞壁和胞间层的主要成分,采后果实中原果胶会在相关酶的作用下发生水解,导致细胞壁结构溶解,细胞间粘合力下降,果实软化[25]。由图2A可以看出,随着芒果贮藏时间的延长,对照和SNP处理果实中可溶性果胶的含量均呈增加趋势。与对照相比,SNP处理果实中可溶性果胶的增加较少,至贮藏第20 d时,SNP处理中可溶性果胶含量仅为对照的83.8%,差异达到显著水平(p<0.05)。与可溶性果胶含量的变化趋势相反,贮藏期间,对照和SNP处理果实中原果胶的含量均逐渐降低(图2B)。然而,SNP处理明显降低了原果胶的水解程度,在贮藏第20 d时,SNP处理中原果胶含量为对照的1.8倍,极显著高于对照(p<0.01)。相关性分析表明:果实硬度与原果胶含量具有极显著的正相关性(r=0.989,p<0.01),而与可溶性果胶含量呈极显著负相关(r=-0.959,p<0.01)(表1)。由此可见,果实软化与果胶物质的降解极显著相关(p<0.01)。SNP通过抑制果实中原果胶的降解,减少可溶性果胶的增加,维持了细胞壁结构的完整性,从而这有助于延缓果实软化进程。SNP对芒果果实细胞壁果胶物质的作用效果与NO在肥城桃[13]和鸭梨[15]上的效果相一致。
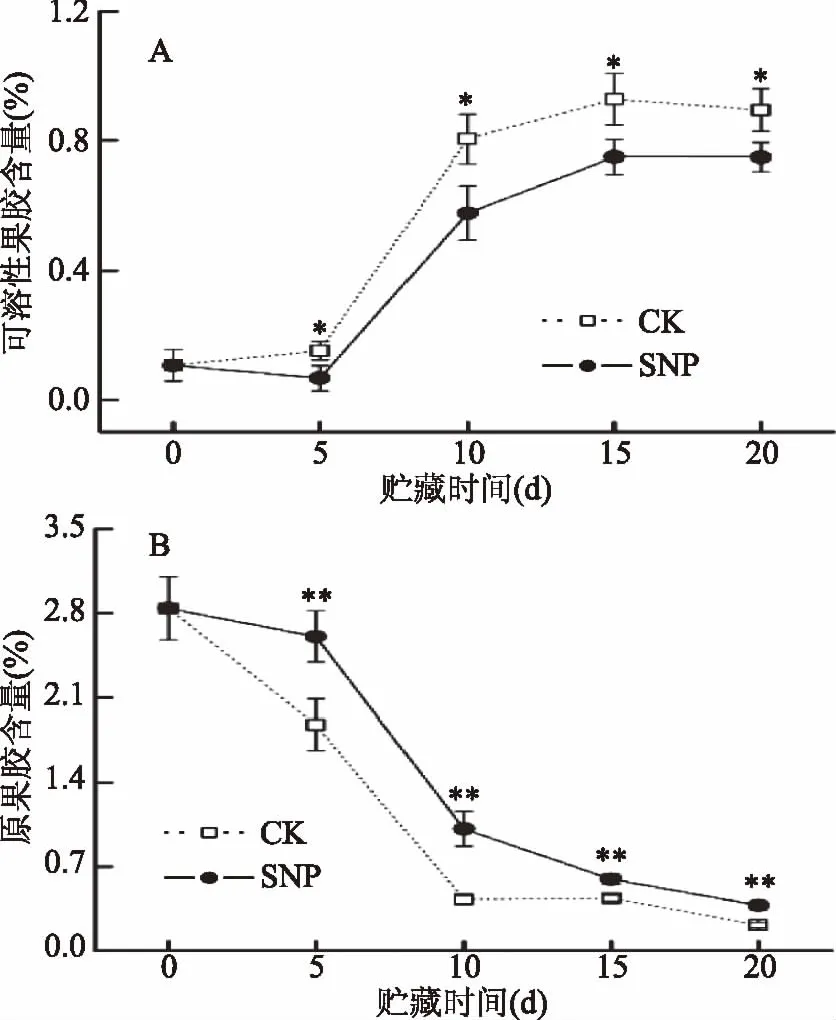
图2 贮藏期间芒果果实可溶性果胶含量(A) 和原果胶含量(B)的变化Fig.2 Changes in soluble pectin content(A) and propectin content(B)of mango fruit during storage
2.3 SNP对芒果果实纤维素含量的影响
纤维素参与构成植物细胞壁网络结构,对细胞起着骨架支持和保护作用,在果实成熟过程中,纤维素会发生降解,从而导致细胞壁结构的解体和果实的软化。图3结果表明,随着芒果采后贮藏时间的延长,果实中纤维素含量逐渐降低,这与Yashoda等[26]和Chourasia等[2]在芒果上的研究结果相一致。当芒果贮藏至第20 d时,对照果实中纤维素含量仅为贮藏前的36.4%。然而,SNP处理显著减轻了果实中纤维素的损失,此时,SNP处理中纤维素含量为贮藏前的57.4%,为对照的1.6倍,极显著高于对照(p<0.01)。相关性分析结果表明:纤维素含量与果实硬度、原果胶含量均呈极显著正相关(r=0.925,p<0.01;r=0.922,p<0.01)(表1),而与可溶性果胶含量呈极显著负相关性(r=-0.817,p<0.01)。赵云峰等[27]认为,纤维素降解会导致构成细胞壁纤维素微纤丝-半纤维素交联网络结构松弛,果胶物质外露,这将有利于细胞壁水解酶攻击底物,从而促进了细胞壁组分的解聚。本研究结果表明,SNP处理能够有效减缓芒果贮藏期间纤维素降解,从而保护果胶物质免受水解酶的作用,从而减少了原果胶的降解和可溶性果胶的增加,维持果实正常的细胞壁结构,延缓了果实软化进程。这与朱树华等[13]在肥城桃和高维亚等[28]在莲雾果上的研究结论相一致。

图3 贮藏期间芒果果实纤维素含量的变化Fig.3 Changes in cellulose content of mango fruit during storage
2.4 SNP对芒果果实PG和PME活性的影响
PG是果实成熟软化的关键酶之一,主要作用是将果实细胞壁果胶糖中多聚半乳糖醛酸降解为半乳糖醛酸,使细胞壁中胶层解体,导致果实软化[29]。由图4A可以看出,随着芒果贮藏时间的延长,对照和SNP处理果实中PG活性整体表现为增加的趋势。然而,SNP处理能明显推迟PG活性的升高,显著降低PG活性(p<0.05)。在整个贮藏期间,SNP处理果实中PG活性平均为对照的85.9%。相关性分析表明,PG活性与硬度、原果胶和纤维素含量均呈极显著负相关(r=-0.870,p<0.01;r=-0.844,p<0.01;r=-0.919,p<0.01),但与可溶性果胶含量呈极显著正相关(r=0.836,p<0.01),表明PG与芒果果实软化和细胞壁物质的降解和转化密切相关。SNP处理可以通过调节PG活性,延缓贮藏芒果细胞壁的降解,进而降低果实软化程度。这与Zaharah等[17]在Kensington Pride芒果上的研究结论相一致。
PME主要作用是水解果胶分子中甲酯化的C6羧基,使之生成多聚半乳糖醛酸和甲醇,增加了果胶在水中的溶解性,是PG作用的必要前提[30]。图4B表明,贮藏后的5 d内,对照中PME活性明显增加,随后PME活性呈波动式降低。然而,与对照相比,SNP处理显著抑制了贮藏前期果实中PME活性的升高(p<0.05),在贮藏第5 d时,SNP处理中PME活性仅为对照的84.5%。随后PME活性缓慢升高,至贮藏第15 d时达到最大值,之后快速降低。进一步分析可知,尽管SNP处理降低了果实贮藏前期(0~5 d)PME活性的增加,但是却保持了贮藏后期(10~20 d)果实中较高的PME活性。这可能是由于,在贮藏前期SNP处理通过对PME活性的抑制,减少了PG作用底物,从而降低果胶水解,而后期一方面保持较高的PME活性,另一方面抑制PG活性的增加,从而导致水解产物果胶酸积累,并与游离的钙离子结合,强化了细胞壁结构,因此减缓了果实的软化[17,31]。Vázquez-Celestino等[31]研究也表明,NO+涂蜡处理在减缓Manila芒果采后软化过程中保持了较高的PME活性。相关性分析表明,PME活性与果实硬度具有正相关性(r=0.484),但未达到显著水平(表1),说明PME参与果实软化进程,但可能不是关键酶。Zaharah等[17]研究发现,NO处理降低贮藏期间“Kensington Pride”芒果果实硬度的损失与其保持果实中较高的PME活性具有明显的正相关性。然而在肥城桃[13]、木瓜[16]和日本李[32]的研究中,却发现NO对果实硬度的保持与抑制PME活性有关。这可能与不同果实细胞壁组成和成熟软化特性之间存在的差异有关。
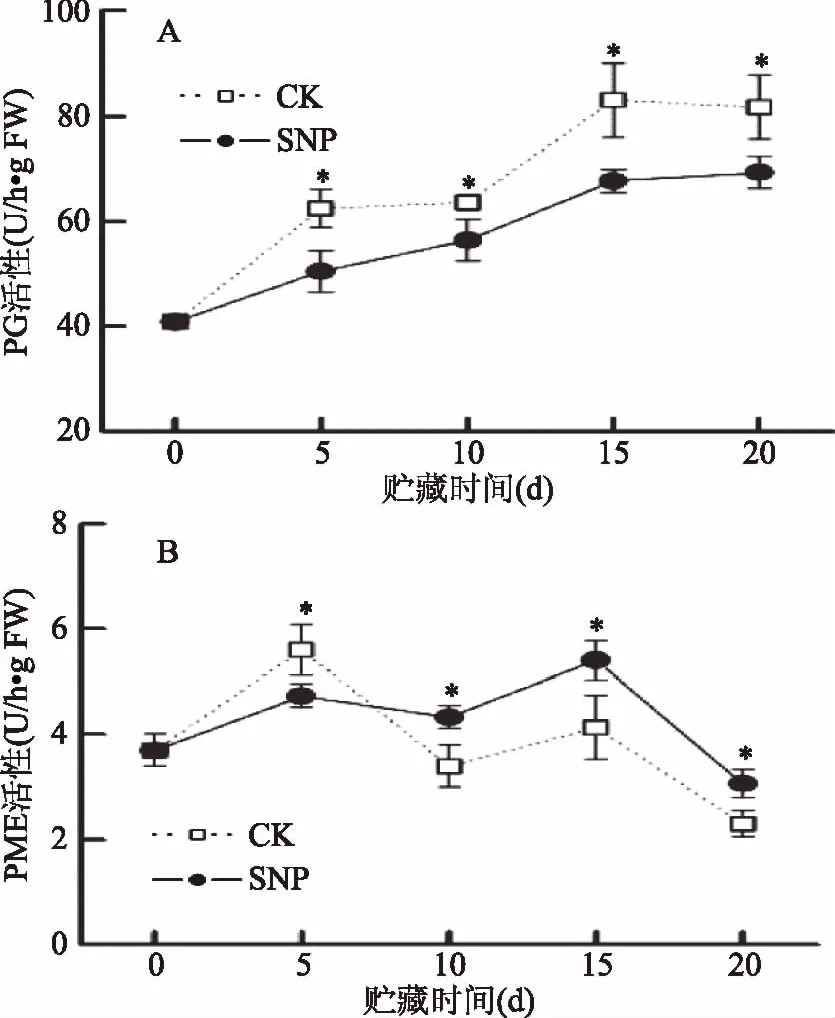
图4 贮藏期间芒果果实中PG活性(A) 和PME活性(B)的变化Fig.4 Changes in PG activity(A)and PME activity(B)of mango fruit during storage
2.5 SNP对芒果果实CX活性的影响
纤维素酶能促进纤维素的降解,在果实软化和衰老等过程中起着重要的调节作用[33]。已有研究表明,随着芒果果实的成熟软化,CX活性逐渐增加[2,34]。图5结果表明,随着芒果贮藏时间的延长,对照和SNP处理中果实CX活性均表现为先增加后降低的变化趋势。对照果实中,CX活性在贮藏前期升高较快,于贮藏第10 d达到最大值,随后快速降低。而SNP处理极显著降低了贮藏前期(0~5 d)果实中CX活性的增加(p<0.01),并且推迟CX活性的峰值到贮藏第15 d。相关性分析表明,CX活性与果实硬度、原果胶和纤维素含量呈显著负相关(r=-0.557,p<0.05;r=-0.612,p<0.05;r=-0.534,p<0.05)(表1)。由此可见,SNP处理能够通过调节果实中CX活性的变化,维持细胞壁中纤维素和果胶的结构,从而延缓果实的软化进程。NO对果实CX活性的作用效果也在香蕉[14]、木瓜[16]和“Kensington Pride”芒果[17]的研究中得到证实。朱树华等[13]认为,在果实中NO会部分地被氧化为亚硝酸,从而降低CX中色氨酸微域的pH,导致一些色氨酸更加暴露;配基结合改变了色氨酸的微环境,同时使酶分子构象发生变化,从而引起CX构象和生理功能的改变。
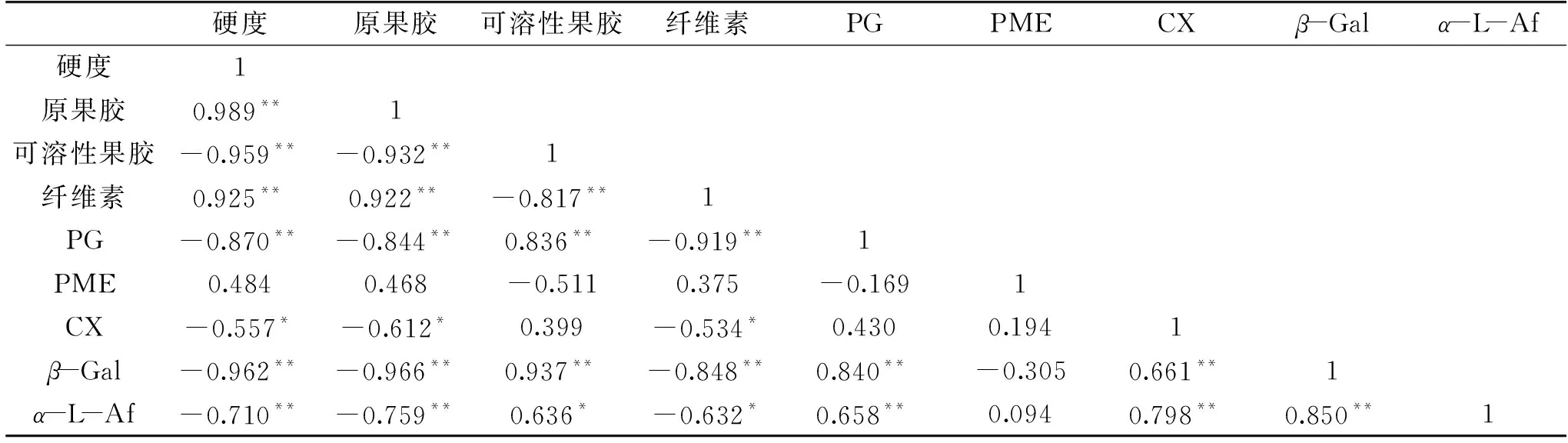
表1 果实硬度、细胞壁组分和水解酶活性变化的相关性分析Table 1 Correlation analysis between fruit firmness,cell wall components and cell wall enzymes
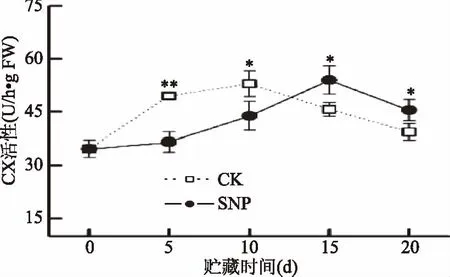
图5 贮藏期间芒果果实中CX活性的变化Fig.5 Changes in CX activity of mango fruit during storage
2.6 SNP对芒果果实β-Gal活性的影响
β-Gal是与细胞壁多糖组分降解相关的重要糖苷酶之一,可通过降解具有支链的多聚醛酸,使细胞壁组分变得不稳定,从而使果胶降解或溶解[35]。已有研究表明,在芒果成熟期间,果实中的β-Gal活性会明显升高,并伴随有果胶的溶解和果实的软化[34,36-37]。本研究结果表明,在芒果贮藏期间,对照果实中,β-Gal活性迅速增加,至贮藏第10 d达到最大值,随后逐渐降低(图6),这与前人研究结果相似[34,36-37]。SNP处理中β-Gal活性变化趋势与对照相似,但是在贮藏前期,β-Gal活性上升速度较为缓慢,在贮藏10 d内活性极显著低于对照(p<0.01),而其活性最大值出现在贮藏第15 d。相关性分析结果表明,β-Gal活性变化与硬度、原果胶含量和纤维素含量呈极显著负相关(r=-0.962,p<0.01;r=-0.966,p<0.01;r=-0.848,p<0.01),而与可溶性果胶含量呈极显著正相关(r=0.937,p<0.01)(表1)。因此,β-Gal可能在芒果软化和细胞壁成分降解中具有重要的作用。SNP处理对芒果果实中β-Gal活性的影响可以进一步说明果胶溶解性降低(图2A和2B)和果实硬度提高(图1)的原因。Liu等[15]研究也发现,NO处理可以明显抑制鸭梨冷藏期间果实中β-Gal活性,从而维持较高的果实硬度,这与本研究结果一致。

图6 贮藏期间芒果果实中β-Gal活性的变化Fig.6 Changes in β-Gal activity of mango fruit during storage
2.7 SNP对芒果果实α-L-Af活性的影响
α-L-Af主要是通过降解植物细胞壁果胶和半纤维素多聚体中阿拉伯糖支链,从而破坏细胞壁的完整性,参与调节果实的成熟软化[35,38-39]。已有研究发现,多种果实采后成熟软化与α-L-Af活性作用具有明显的相关性[40-42]。图7结果表明,随着芒果贮藏时间的延长,对照组中α-L-Af活性快速增加,至贮藏第10 d达到最大值,随后逐渐降低。然而Ali等[23]研究却发现,在“Harumanis”芒果成熟软化过程中,α-L-Af活性并没有明显的变化。其原因可能与不同品种的果实中细胞壁的组成和结构不同有关[43]。由图7也可以看出,SNP处理中α-L-Af活性总体表现为增加的趋势,然而与对照相比,贮藏5~10 d时,SNP处理极显著降低了贮藏前期果实中α-L-Af活性的增加(p<0.01),并推迟其最大值出现的时间至20 d。相关性分析结果表明,α-L-Af活性变化与硬度、原果胶含量均呈极显著负相关(r=-0.710,p<0.01,r=-0.759,p<0.01),与纤维素含量呈显著负相关(r=-0.632,p<0.05),而与可溶性果胶含量呈显著正相关(r=0.636,p<0.05)(表1)。因此,SNP减缓果实软化与其抑制α-L-Af活性相关。目前还未见其他有关NO调节果实成熟软化过程中α-L-Af活性的报道。

图7 贮藏期间芒果果实中α-L-Af活性的变化Fig.7 Changes in α-L-Af activity of mango fruit during storage
3 讨论与结论
芒果采后极易软化,而果实硬度的降低与细胞壁原果胶含量和纤维素含量的下降具有极显著正相关性(p<0.01),而与可溶性果胶含量的增加极显著负相关(p<0.01)。因此,果胶物质和纤维素等细胞壁组分的降解可能是采后芒果软化的重要原因。
芒果软化过程中有多种细胞壁水解酶的参与。硬度的降低与PG、β-Gal和α-L-Af活性的增加具有极显著的负相关性(p<0.01),与CX活性的增加具有显著的负相关性(p<0.05),而与PME具有一定的正相关性,但相关性不显著(p>0.05)。表明PG、CX、β-Gal和α-L-Af在果实软化过程中起重要作用,PME虽然参与果实软化进程,但可能不是关键酶。
SNP处理明显降低了贮藏期间“台农”芒果果实中PG、CX、β-Gal和α-L-Af的活性,降低贮藏前期PME活性,而保持贮藏后期较高的PME活性,从而降低了细胞壁中果胶物质和纤维素的水解和转化,较好地维持细胞壁结构的完整性,减缓了果实软化的进程。
