响应面法优化橄榄果渣羟基酪醇提取工艺
2018-09-22黄梅桂谢跃杰赵富昌任彦荣任贵礼
王 强,黄梅桂,谢跃杰,3,赵富昌,任彦荣,3,王 波,任贵礼
(1.重庆第二师范学院生物与化学工程学院,重庆 400067; 2.南京林业大学轻工与食品学院,江苏南京 210037; 3.重庆第二师范学院脂质资源与儿童日化品协同创新中心,重庆 400067; 4.重庆江源油橄榄开发有限公司,重庆 404100; 5.甘肃出入境检验检疫局检验检疫综合技术中心,甘肃兰州 737100)
油橄榄(OleaeuropaeaL.)属木犀科、木犀榄属常绿乔木,是世界著名的木本油料树种,有4000多年的栽培历史。以油橄榄果实榨取的橄榄油富含不饱和脂肪酸、酚类物质和脂溶性维生素等多种活性成分,具有多重保健功效[1-2]。近年来,橄榄的主要用途是生产初榨橄榄油,在橄榄油加工过程中,油橄榄鲜果经磨浆、离心分离制取初榨橄榄油后,产生大量的果渣,果渣中含有果渣油、多酚和萜类化合物等多种活性成分[2],其中酚类物质中的橄榄苦苷含量占25%,橄榄苦苷的性质不稳定,在酸、碱和酶的作用下易降解为羟基酪醇和榄香酸[3]。有研究报道,羟基酪醇具有抗氧化、抗炎、抗癌、抗血栓、抗菌、抗病毒等功能[4-7],尤其是其抗氧化活性高,被称为是最具清除自由基能力的天然抗氧化剂之一,其对自由基清除率是槲皮素的2倍[8-9]。此外,大多数橄榄油生产企业将橄榄果渣直接丢弃或作堆肥及饲料,果渣中有效成分未充分开发与利用。橄榄果渣中有机物含量高,致使化学需氧量(COD)和生物需氧量(BOD5)较高[1],随雨水或其他方式进入土壤或湖水,影响水体或土壤的污染物承载能力,长期堆放使得周围蝇虫飞舞、臭气熏天,造成了资源浪费和环境污染。
目前,超声辅助提取法与振荡水浴法是最常用的两种前处理提取方法[10],尽管有研究将两种方法用于橄榄果渣中羟基酪醇的提取,但此前的研究对橄榄果渣中羟基酪醇提取率无法达到满意的效果。本文分别讨论超声辅助水解与振荡水浴水解两种提取工艺中的各因素对橄榄果渣中羟基酪醇的提取效果,并进行对比,得出较优的提取工艺,进而通过Box-Behnken响应面设计进行优化,以期找到适合橄榄果渣中羟基酪醇的提取工艺,从而提高羟基酪醇的提取率,为橄榄果渣中有效成分的开发利用提供数据支持。
1 材料与方法
1.1 材料与仪器
油橄榄果渣 重庆江源油橄榄开发有限公司,羟基酪醇 纯度>98%,中国标准物质中心,北京世纪奥科生物技术有限公司;乙腈、甲醇 色谱纯,德国Merck公司;其余试剂 如无特殊说明均为分析纯。
UPLC超高效液相色谱仪、二极管阵列检测器(ACQUITY UPLC) 美国Waters公司;电子天平(±0.01 g) 常熟双杰测试仪器厂;BL610分析天平(0.1 mg) 德国Sartorius公司;SIGMA-K615冷冻离心机 德国SIGMA公司;IKA MS3涡旋仪 德国IKA公司;Thermo Electron移液枪(100~1000、20~100 μL) 美国Thermo公司;DKZ-3恒温水浴振荡器 上海一恒科技有限公司;Elmasonic S 300 H超声仪 德国 Elma 公司;4001型旋转蒸发仪 德国Heidolph公司。
1.2 实验方法
1.2.1 色谱条件 色谱柱:BEH C18(50 mm×1.0 mm,1.7 μm);流动相:A为0.1%(v/v)甲酸乙腈,B为0.1%(v/v)甲酸水;流速0.1 mL/min;进样量:2.0 μL;柱温35 ℃;检测波长为280 nm;梯度洗脱:流动相A初始为5%,0.0~5.0 min流动相A比例由5%变为10%,5.0~8.0 min流动相A由10%变为70%,8.0~9.0 min流动相A比例回到5%,平衡2.0 min。
1.2.2 标准品溶液的制备 称取羟基酪醇标准品适量,用0.1%(v/v)甲酸乙腈溶液溶解并定容至100 mL,配制成含羟基酪醇为203.4 mg/L的标准储备液,4 ℃下冷藏待用。标准工作液:分别准确移取10、5、2.5、0.63、0.16、0.063 mL标准贮备液至10 mL容量瓶中,0.1%(v/v)甲酸乙腈溶液准确定容,配制成相应的标准工作液,4 ℃下冷藏待用。
1.2.3 样品处理
1.2.3.1 超声波辅助盐酸水解提取橄榄果渣中羟基酪醇 超声波辅助盐酸水解提取橄榄果渣中羟基酪醇参见李春燕等[10]的方法,并作一定修改:称取1.0 g橄榄果渣放入50 mL聚乙烯管中,加入一定量的盐酸溶液,置于适当温度的超声装置(超声功率1400 w)中,超声反应一定时间后取出,用2 mol/L氢氧化钠溶液中和至中性,并将水解液定容,经0.22 μm 微孔滤膜后,UPLC检测。
1.2.3.2 振荡水浴盐酸水解提取橄榄果渣中羟基酪醇 称取1.0 g橄榄果渣置于50 mL聚乙烯管中,加入一定量的盐酸溶液,置于适当温度的水浴振荡器中,振荡频率100 r/min,反应一定时间后取出,用2 mol/L氢氧化钠溶液中和至中性,并将水解液定容,经过0.22 μm微孔滤膜后,UPLC检测。
1.2.4 单因素实验
1.2.4.1 超声辅助盐酸水解法 盐酸浓度对羟基酪醇提取量的影响 设定料液比为1∶20 g/mL、提取温度为40 ℃、超声时间为30 min,考察盐酸溶液浓度为0.02、0.05、0.2、0.5、1.0 mol/L时,对橄榄果渣中羟基酪醇提取量的影响。
超声时间对羟基酪醇提取量的影响:设定料液比为1∶20 g/mL,提取温度40 ℃,盐酸溶液浓度为0.5 mol/L,考察超声时间为15、30、45、60、80、100、120 min时,对橄榄果渣中羟基酪醇提取量的影响。
料液比对羟基酪醇提取量的影响:设定提取温度为40 ℃,超声时间为60 min,盐酸浓度为0.5 mol/L,考察料液比为1∶5、1∶10、1∶15、1∶20、1∶30 g/mL时,对橄榄果渣中羟基酪醇提取量的影响。
提取温度对羟基酪醇提取量的影响:设定超声时间为60 min,盐酸浓度为0.5 mol/L,料液比为1∶20 g/mL,考察提取温度为40、60、80、90、100 ℃时,对橄榄果渣中羟基酪醇提取量的影响。
1.2.4.2 振荡水浴盐酸水解法 提取温度对羟基酪醇提取量的影响 设定盐酸溶液浓度为0.2 mol/L,料液比为1∶15 g/mL,水解时间30 min,考察提取温度为40、60、80、90、100 ℃时,对橄榄果渣中羟基酪醇提取量的影响。
盐酸浓度对羟基酪醇提取量的影响:设定料液比为1∶15 g/mL,水解时间30 min,提取温度为90 ℃,考察盐酸溶液浓度为0.25、0.5、1.0、1.5、2.0 mol/L时,对橄榄果渣中羟基酪醇提取量的影响。
料液比对羟基酪醇提取量的影响:设定水解时间为30 min,盐酸溶液浓度为1.5 mol/L,提取温度为90 ℃,考察料液比为1∶20、1∶30、1∶40、1∶50、1∶60 g/mL时,对橄榄果渣中羟基酪醇提取量的影响。
水解时间对羟基酪醇提取量的影响:设定盐酸溶液浓度为1.5 mol/L,提取温度为90 ℃,料液比为1∶30 g/mL,考察水解时间为30、60、120、180、240 min时,对橄榄果渣中羟基酪醇提取量的影响。
1.2.5 对比试验 将上述2种酸解方式中单因素的最佳条件进行对比试验,找出水解提取羟基酪醇含量最高的水解方法。
1.2.6 响应面试验设计 在对比试验结果的基础上,选取最佳酸解方式,并且选取盐酸浓度、料液比、提取温度、水解时间作为影响因素,根据Box-Behnken实验设计原理,响应面分析实验为四因素三水平共29个点,这些实验点分为两类:一类是自变量取值在各水平所构成的三维析因点,共24个;一类是区域的中心点,零点实验重复5次,用来估计实验误差。响应面实验的因素与水平见表1。

表1 响应面实验因素与水平Table 1 Experimental factors and levels of response surface
1.2.7 羟基酪醇提取量的计算 计算方法如下所示:
羟基酪醇提取量(mg/g)=提取液中羟基酪醇的质量(mg)/称取的橄榄果渣的质量(g)。
1.3 数据处理
利用Design-Expert 8.0.6软件进行实验设计和分析。实验数据以平均数±标准差表示。
2 结果与分析
2.1 方法学考察
2.1.1 线性范围和最低检出限 分别准确移取标准工作液按“1.2.1”色谱条件进行测定,以峰面积Y为纵坐标,浓度X为横坐标进行线性回归,得到回归方程:Y=5962.8X-18124,r=0.9991,结果表明羟基酪醇在1.28~203.40μg/g的范围内线性关系良好,能满足对橄榄果渣中羟基酪醇提取量的检测要求。当信噪比(S/N)为3和10时,该方法的最低检出限为0.22 μg/g,定量限为0.67 μg/g。
2.1.2 加标回收率和精密度 在混匀的橄榄果渣样品中添加高(50 μg/g)、中(25 μg/g)、低(5 μg/g)浓度的羟基酪醇标准溶液,涡旋2.0 min后静置10 min,按“2.5.4”最佳优化的实验条件处理样品,“1.2.1”色谱条件进样测定,以浓度值计算加标回收率。每一添加浓度样品重复测定6次来计算其精密度。结果显示,加标回收率在81.73%~104.09%之间,相对标准偏差(RSD)在3.7%~4.9%之间。
2.1.3 稳定性实验 取橄榄果渣样品,按照“2.5.4”最佳优化的实验条件处理样品,“1.2.1”所述色谱条件分析,在室温条件下,分别经0、4、12、24、48、72 h进样分析可知,橄榄果渣中羟基酪醇在12 h后开始降解,在48 h内降解超过23.56%,故样品处理完成后需在12 h内进行分析。
2.1.4 重复性实验 准确称取混匀的橄榄果渣样品6份,按“2.5.4”最佳优化的实验条件处理样品,“1.2.1”所述的色谱条件进样分析,通过计算提取的羟基酪醇含量及RSD,可以看出,6份同一橄榄果渣样品中羟基酪醇提取量的RSD分别为1.94%和3.07%,表明方法重复性较好。
2.2 超声辅助水解提取橄榄果渣中羟基酪醇单因素实验
2.2.1 盐酸浓度对羟基酪醇提取量的影响 不同盐酸浓度对羟基酪醇提取量的影响结果见图1A。由图1A可知,羟基酪醇提取量随着盐酸浓度的增加而增加,当盐酸浓度达到0.5 mol/L时,羟基酪醇提取量趋于平稳,说明此时橄榄果渣中的橄榄苦苷已水解完全[11],故试验选择盐酸浓度为0.5 mol/L。
2.2.2 超声时间对羟基酪醇提取量的影响 不同超声时间对羟基酪醇提取量的影响结果见图1B。由图1B可知,超声时间为60 min时,羟基酪醇提取量达到最高,超声60 min后,其提取量有所下降,主要原因是,橄榄果渣在长时间水解的过程中导致部分羟基酪醇被氧化[11],因此,试验选水解时间为60 min。
2.2.3 料液比对羟基酪醇提取量的影响 不同料液比对羟基酪醇提取量的影响结果见图1C。由图1C可知,羟基酪醇提取量随着料液比的增加呈先上升后下降趋势,因为适当的料液比可以提高羟基酪醇的溶出率,料液比过小,溶剂量少,导致物料的黏度大,羟基酪醇的扩散速度慢会阻止其的有效溶出,提取不完全,提取量较低,随着料液比的增加,羟基酪醇提取量先呈上升趋势,而当料液比达到1∶20 g/mL时,羟基酪醇提取量最高,几乎所有的羟基酪醇已经全部溶出,再增加溶剂的量会使这种扩散平衡被打破,提取量下降。考虑到提升羟基酪醇的提取量和尽量减少用水的情况下[3],选取料液比为1∶20 g/mL。
2.2.4 提取温度对羟基酪醇提取量的影响 不同提取温度对羟基酪醇提取量的影响结果见图1D。从图1D可知,提取温度越高,羟基酪醇提取量越高,过低的提取温度不利于最大限度地提取羟基酪醇[3]。但当提取温度达到80 ℃时,羟基酪醇提取量基本趋于平稳,说明在此条件下就水解完全。因此选择提取温度为80 ℃。

图1 盐酸浓度、水解时间、料液比和提取温度对羟基酪醇含量的影响Fig.1 Effect of hydrochloric acid concentration,time,solid-liquid ratio and temperature on the hydroxytyrosol extraction content
2.3 振荡水浴提取橄榄果渣中羟基酪醇单因素实验
2.3.1 提取温度对羟基酪醇提取量的影响 不同提取温度对羟基酪醇提取量的影响结果见图2A。由图2A可知,提取温度越高,羟基酪醇提取量越高,当提取温度达到90 ℃时,羟基酪醇提取量基本趋于平稳,说明羟基酪醇在此条件下就可水解完全[3]。因此选择提取温度为90 ℃。
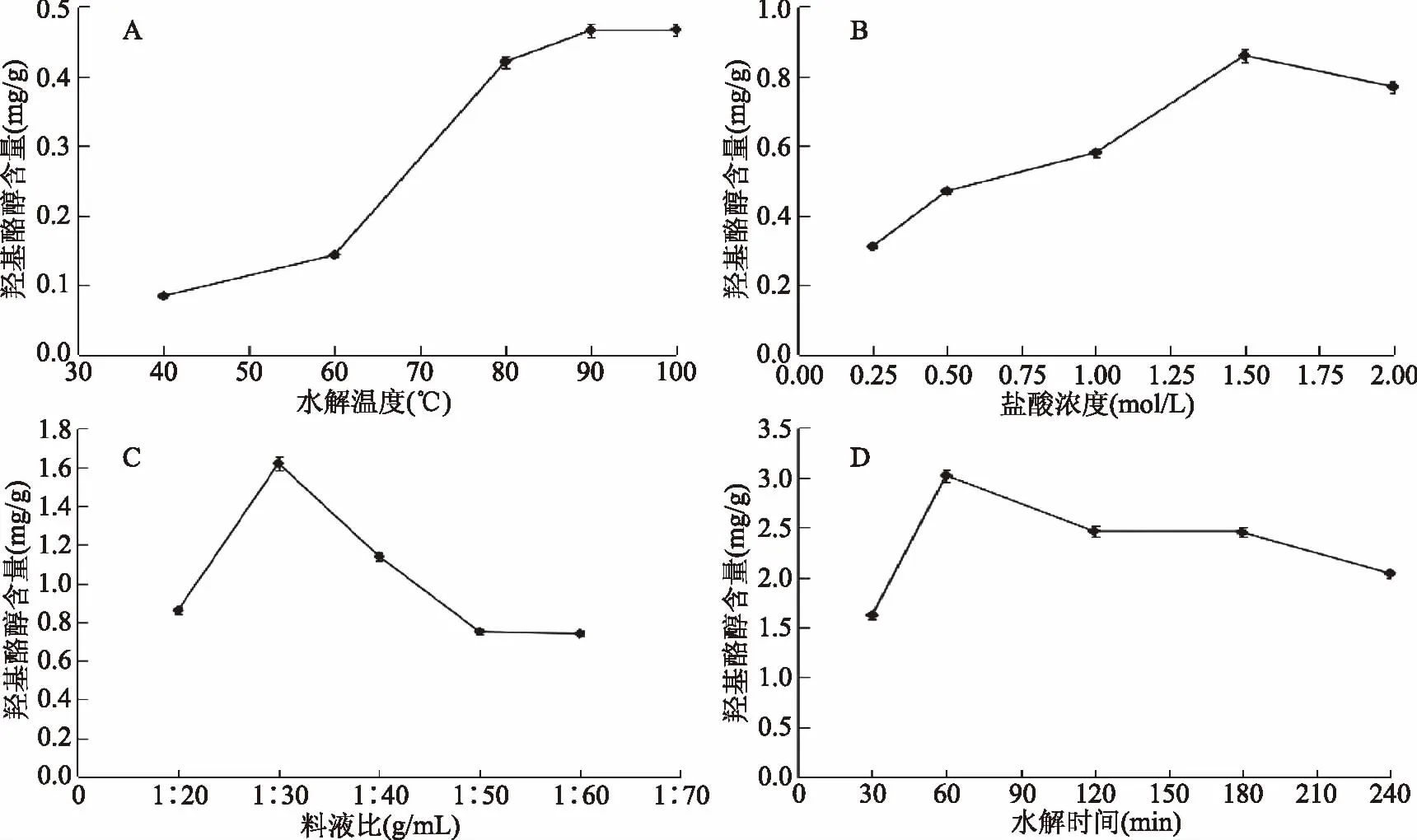
图2 水解时间对羟基酪醇含量的影响Fig.2 Effect of hydrolysis temperature,hydrochloric acid concentration, solid-liquid ratio and time on the hydroxytyrosol extraction content
2.3.2 盐酸浓度对羟基酪醇提取量的影响 不同盐酸浓度对羟基酪醇提取量的影响结果见图2B。从图2B可以看出,羟基酪醇提取量随着盐酸浓度的增加而逐渐增大,当浓度增加至1.5 mol/L时,羟基酪醇提取量达到最高,随着盐酸浓度的进一步增加,羟基酪醇提取量逐渐减少,说明此时橄榄果渣中的橄榄苦苷已水解完全[11],故试验选择盐酸浓度为1.5 mol/L。
2.3.3 料液比对羟基酪醇提取量的影响 不同料液比对羟基酪醇提取量的影响结果见图2C。由图2C可知,羟基酪醇提取量随着料液比的增加先上升后下降再趋于平稳,当料液比达到1∶30 g/mL时,羟基酪醇提取量最高。因此,选择料液比为1∶30 g/mL。
2.3.4 水解时间对羟基酪醇提取量的影响 不同水解时间对羟基酪醇提取量的影响结果见图2D。由图2D可知,羟基酪醇提取量在60 min时达到最高,60 min以后提取量有所下降,时间越长,导致橄榄苦苷分解,羟基酪醇提取量减少[12],因此,选择水解时间为60 min。
2.4 超声辅助水解与振荡水浴水解提取橄榄果渣中羟基酪醇对比实验
针对2种水解工艺的单因素试验,选取超声辅助水解工艺参数:盐酸浓度为0.5 mol/L,超声时间为60 min,提取温度为80 ℃,料液比为1∶20 g/mL;振荡水浴水解工艺参数:提取温度为90 ℃,盐酸浓度为1.5 mol/L,料液比为1∶30 g/mL,水解时间为60 min,分别平行制备6份样品,考察方法的重现性,结果显示2种水解工艺重现性均较好,RSD均小于2%。其中,振荡水浴水解工艺所得的羟基酪醇提取量为(1.51±0.23) mg/g,超声辅助水解工艺所得的羟基酪醇提取量为(0.84±0.11) mg/g,可知,振荡水浴水解工艺所得的羟基酪醇提取量约为超声辅助水解工艺的2倍,基于此,试验拟采用响应面法对振荡水浴水解提取羟基酪醇工艺进行优化。
2.5 响应面试验结果
2.5.1 响应面试验设计及结果 见表3。
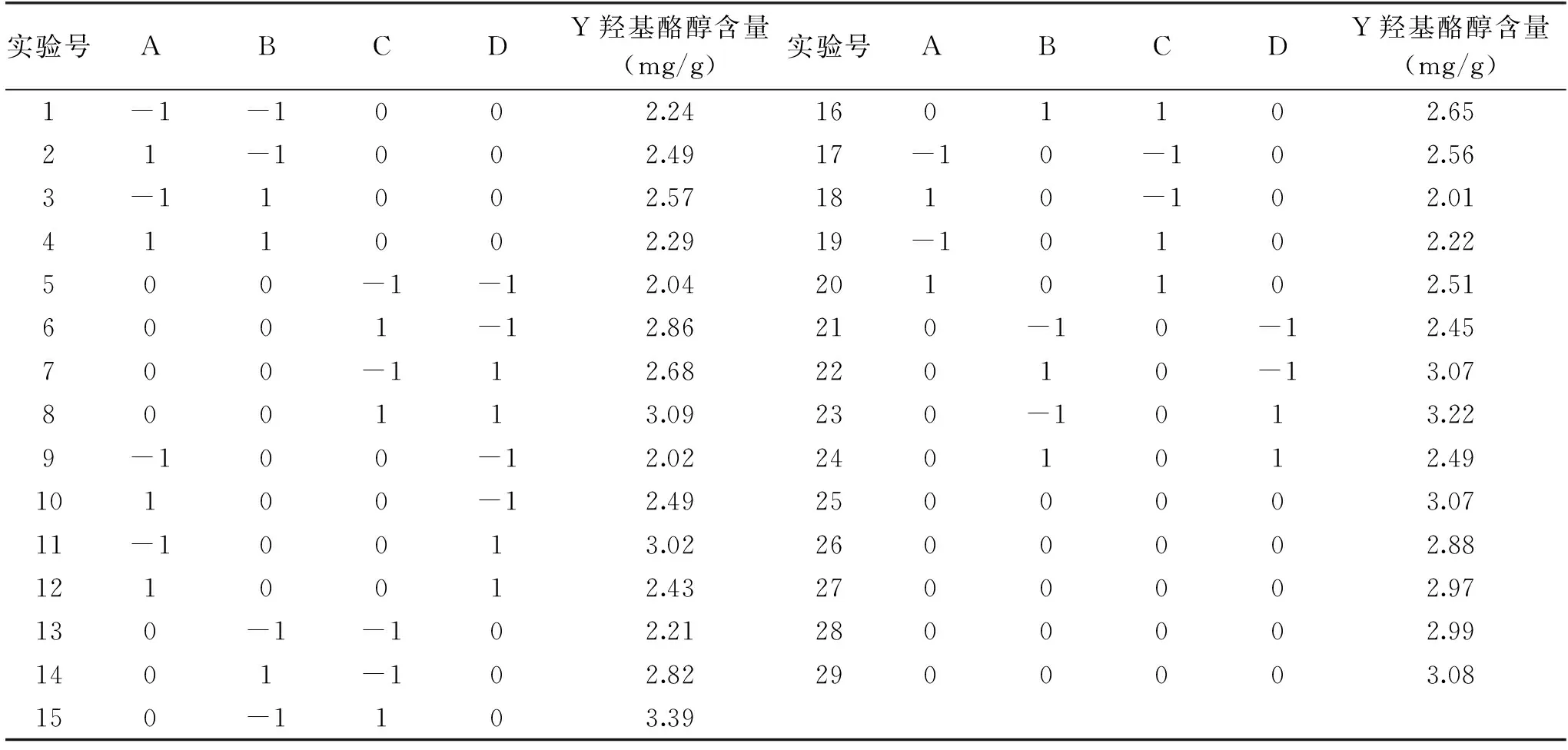
表3 响应面法试验设计与结果Table 3 Experimental results and analysis of response surface method
2.5.2 响应面曲面方差分析 运用Design Expert 8.0.6软件对表3数据进行统计分析,可得出四因素与羟基酪醇提取量之间的多元二次方程关系式:羟基酪醇提取量Y=3.00-0.034A-9.167E-003B+0.20C+0.17D-0.13AB+0.21AC-0.27AD-0.34BC-0.34BD-0.10CD-0.47A2-0.089B2-0.19C2-0.092D2。
由表4方差分析可知,本实验拟合的模型p<0.0001,表明响应回归模型极显著,决定系数R2=0.9209,表明92.09%的数据可以用此方程来解释,该模型与实际数据相关性较好;失拟项p=0.07987>0.05不显著,说明回归方程与实际拟合性好,因此,此拟合模型适用于对振荡水浴盐酸水解橄榄果渣中羟基酪醇的提取量进行分析和预测。通过该模型的方差分析可知:料液比(C)、水解时间(D)对羟基酪醇提取量的影响差异均显著(p<0.05),而提取温度(A)、盐酸浓度(B)对羟基酪醇提取量的影响差异不显著(p>0.05)。这四个因素对橄榄果渣中羟基酪醇提取量的影响效应大小依次为料液比(C)>水解时间(D)>提取温度(B)>盐酸浓度(A)。
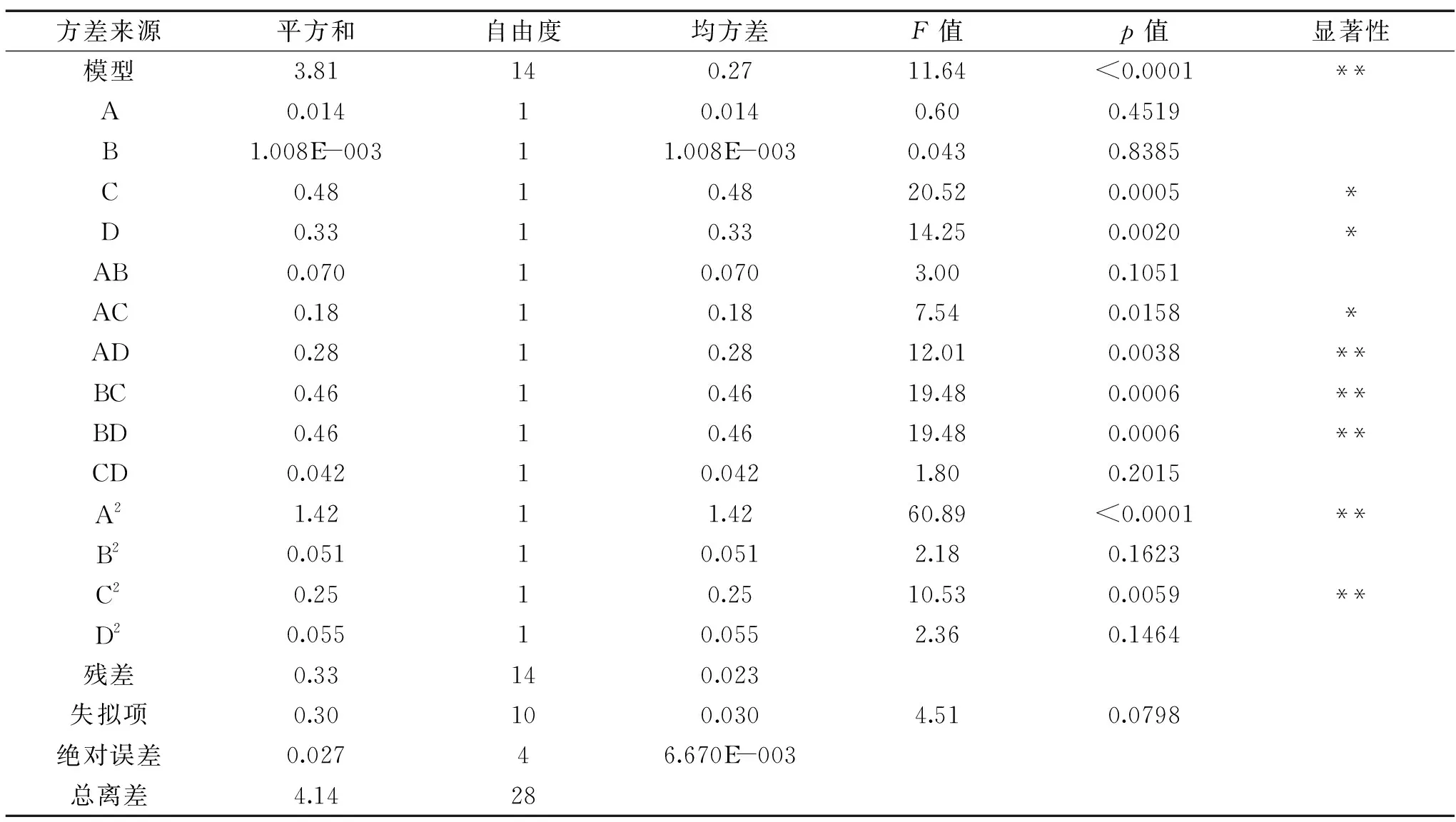
表4 方差分析Table 4 Variance analysis
2.5.3 两因素交互作用的响应曲面分析 吸附率对应于提取温度、盐酸浓度、料液比、水解时间所形成的三维空间曲面,可直接形象地反映各因素及其之间的交互作用对羟基酪醇提取量的影响。
运用Design Expert 8.0.6软件分析得到的响应曲面如下图3所示。由图3可以看出,(b)、(d)、(e)呈现的是曲面较陡峭的曲线,说明提取温度与料液比、温度与水解时间、盐酸浓度与料液比、盐酸浓度与水解时间的交互作用对羟基酪醇提取量的影响较大,而温度与盐酸浓度、料液比与水解时间的交互作用曲面更平缓,说明它们的交互作用对羟基酪醇提取量的影响较小,这与上表中的交互作用结果的趋势也是一致的。

图3 两因素交互影响吸附率响应曲面图Fig.3 Response surface plot
2.5.4 回归方程及验证实验 借助Design Expert 8.0.6软件中多元二次回归模型对羟基酪醇提取量进行估算,对二次函数模型进行极值分析,预测四因素的最佳组合为:提取温度(A)87.8 ℃、盐酸浓度(B)1.14 mol/L、料液比(C)1∶35.8 g/mL、水解时间(D)86.4 min,此时模型预测羟基酪醇提取量极大值为3.39 mg/g。考虑到实际操作的便利,在预测的最佳优化条件的基础上将工艺参数修正为提取温度88 ℃、盐酸浓度1.2 mol/L、料液比1∶36 g/mL、水解时间86 min,并验证实验,平行制备6份样品进行测定,实测羟基酪醇提取量为(3.38±0.12) mg/g,与预测值无明显差异。
3 结论
本研究建立了分离检测橄榄果渣中羟基酪醇的超高效液相色谱方法,其在1.28~203.40 μg/g范围内线性关系良好,方法的重现性、稳定性、精密度均达到要求。同时,分别讨论了超声辅助酸解与振荡水浴盐酸酸解提取橄榄果渣中羟基酪醇的单因素条件,再进行实验对比,发现振荡水浴盐酸水解工艺所得羟基酪醇的提取量约为超声辅助水解工艺的2倍。在振荡水浴水解单因素的基础上,对其工艺条件进行响应面优化,最终确定最优的水解工艺条件为提取温度88 ℃、盐酸浓度1.2 mol/L、料液比1∶36 g/mL、水解时间86 min,优化工艺后得到橄榄果渣中羟基酪醇的提取量为(3.38±0.12) mg/g。通过验证实验说明所建立的模型可以很好的应用于实践,为橄榄果渣中羟基酪醇的提取开发利用提供可靠的技术支持。
