植物乳杆菌发酵 黑果腺肋花楸果汁的工艺优化
2018-09-22张海平韦玉龙甘芝霖孙爱东
张海平,朱 月,韦玉龙,李 腾,于 宁,朱 宁,甘芝霖,孙爱东
(北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083)
黑果腺肋花楸(Aroniamelanocarpa),又名野樱莓、不老莓,蔷薇科、多年生落叶灌木,原产于美国东北部地区[1]。20世纪90年代初,由前苏联及欧洲引入我国辽西地区,开展黑果腺肋花楸的引进栽培和果实的加工研究[2]。
黑果腺肋花楸果实中含有丰富的营养物质,具有较高的营养价值和药用价值,果实中富含维生素、有机酸、矿物质和多酚类化合物等物质[3]。对20种富含多酚类物质的鲜果进行抗氧化能力研究发现,黑果腺肋花楸清除自由基能力最强,显著高于黑加仑等水果[4]。多酚类物质是黑果腺肋花楸果实中重要的活性物质,黑果腺肋花楸果实中提取的多酚类物质可以促进胰岛素酶分泌,控制胰腺炎症,调节血糖水平[5],且对乳房癌具有抑制作用[6]。黑果腺肋花楸提取物对于抗诱变和预防冠状动脉疾病发挥积极作用[7-8]。
目前,国内研究多集中于果实有效成分和功能性的研究,对于黑果腺肋花楸果实中多酚类物质、花青素、原花青素等物质的超声辅助提取已有大量报道[9-11],但是将其果实加工为高附加值的产品较少,综合利用较低,相关产品研发较少,市场鲜有以黑果腺肋花楸为原料而制成的产品,精深加工能力不足[12]。
黑果腺肋花楸果实中含有大量的单宁物质,鲜食及鲜榨果汁口感酸涩,不易直接食用,消费者接受程度低[13],但乳酸菌发酵能够改善果蔬制品风味及口感,使得发酵香与果蔬香浑然一体。植物乳杆菌(Lactobacillusplantarum)是乳酸菌的一种,属于乳杆菌科乳杆菌属。植物乳杆菌相比于其他乳杆菌,优势在于此菌的活菌数较高,且在生长过程中能够产生特有的具有防腐功能的生物型乳酸菌素[14]。
因此,本研究以黑果腺肋花楸为原料,利用植物乳杆菌发酵,并通过单因素和正交试验对黑果腺肋花楸发酵饮料的发酵条件进行优化,以确定最佳发酵条件,为黑果腺肋花楸发酵饮料的开发提供理论依据,为黑果腺肋花楸综合利用开拓新途径。
1 材料与方法
1.1 材料与仪器
黑果腺肋花楸 吉林省延边市;植物乳杆菌C8-1 北京林业大学生物科学与技术学院食品系张柏林老师赠与;MRS培养基 北京奥博星生物科技有限公司;无水乙醇 国药集团化学试剂有限公司;福林酚、DPPH 上海源叶生物科技有限公司;七水合硫酸亚铁 西陇化工股份有限公司;三氯乙酸 上海麦克林生化科技有限公司;无水三氯化铁 国药集团化学试剂有限公司;铁氰化钾 天津市津渴精细化工研究所;以上试剂均为分析纯;其他试剂 均为国产分析纯。
JYL-C010打浆机 九阳股份有限公司;LQ-A30002电子天平 瑞安市乐祺贸易有限公司;DHP-927电热恒温培养箱 上海一恒科技有限公司;L3660D低速离心机 上海知信实验仪器有限公司;SW-CJ-2D超净工作台 北京天林恒泰科技有限公司;LDZX-30KB立式压力蒸汽灭菌器 上海申安医疗器械厂;手持折光仪 上海勃基仪器仪表有限公司;UV-6100分光光度计 上海元析仪器有限公司;pH计 梅特勒-托利多仪器(上海)有限公司;SC-80全自动色差计 北京京仪康光光学仪器有限公司。
1.2 实验方法
1.2.1 生长曲线的绘制 菌种活化:制备MRS肉汤培养基,120 ℃灭菌20 min。挑取4 ℃斜面保存的菌种,接种于25 mL已灭菌的MRS肉汤培养基中,37 ℃培养箱中培养12 h,进行菌种活化。
取活化后的菌悬液,按1%接种量(v/v)接种到装有10 mL MRS肉汤培养基的试管中,从接种开始,每隔2 h测OD580 nm值(每次取三支试管,做平行实验),并各取1 mL菌液,梯度稀释,接种于MRS琼脂平板培养皿中,37 ℃培养箱中倒置培养48 h(每组做三次平行实验),采用平板计数法计算活菌数(CFU/mL)。以OD580 nm值及活菌数为纵坐标,时间为横坐标,绘制植物乳杆菌生长曲线[15-17]。
1.2.2 黑果腺肋花楸乳酸菌发酵最优条件的优化
1.2.2.1 单因素实验 将活化培养后的菌悬液接种于经80 ℃,15 min巴氏灭菌的黑果腺肋花楸果汁中,以总酸含量为指标,接种量、发酵时间、发酵温度、料液比和蔗糖添加量为影响因素进行单因素实验。
接种量的确定:在发酵时间为20 h,发酵温度为37 ℃,料液比为1∶1(v∶v),蔗糖添加量为7%的条件下,按不同接种量(6、7、8、9、10)lg(CFU/mL)进行黑果腺肋花楸植物乳杆菌发酵,根据总酸含量确定发酵接种量。
发酵时间的确定:在接种量为7 lg CFU/mL,发酵温度为37 ℃,料液比为1∶1(v∶v),蔗糖添加量为7%的条件下,按不同发酵时间(14、16、18、20、22 h)进行黑果腺肋花楸植物乳杆菌发酵,根据总酸含量确定发酵时间。
发酵温度的确定:在接种量为7 lg CFU/mL,发酵时间为20 h,料液比为1∶1(v∶v),蔗糖添加量为7%的条件下,按不同发酵温度(31、33、35、37、39 ℃)进行黑果腺肋花楸植物乳杆菌发酵,根据总酸含量确定发酵温度。
料液比的确定:在接种量为7 lg CFU/mL,发酵时间为20 h,发酵温度为37 ℃,蔗糖添加量为7%的条件下,按不同料液比(3∶1、2∶1、1∶1、1∶2、1∶3(v∶v))进行黑果腺肋花楸植物乳杆菌发酵,根据总酸含量确定发酵料液比。
蔗糖添加量的确定:在接种量为7 lg CFU/mL,发酵时间为20 h,发酵温度为37 ℃,料液比为1∶1(v∶v)的条件下,按不同蔗糖添加量(0%、3%、5%、7%、9%)进行黑果腺肋花楸植物乳杆菌发酵,根据总酸含量确定蔗糖添加量。
1.2.2.2 正交试验 根据单因素实验的结果,选择接种量、发酵时间、发酵温度和料液比为影响因素,设计L9(34)正交试验,以总酸含量为指标,优化最佳发酵条件。正交因素与水平见表1。
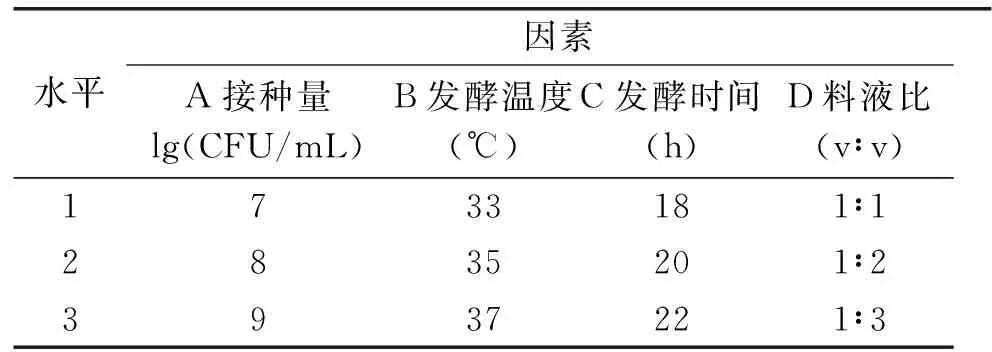
表1 正交实验因素与水平表Table 1 Factors and levelsTable of orthogonal experiment
1.2.3 总酸含量的测定 参照国标GB/T 12456-2008。
1.2.4 pH的测定 用pH计测定。
1.2.5 可溶性固形物含量的测定 手持折光仪测定。
1.2.6 总酚含量的测定 根据Li等[18]的方法略作修改。参考王行等[19]的方法,配制浓度梯度的焦性没食子酸溶液,准确吸取2 mL不同浓度的焦性没食子酸与2 mL Folin-Ciocalteu试剂反应,在765 nm处测定吸光度,绘制标准曲线,得方程:y=0.0109x+0.0015,R2=0.9995。
用蒸馏水按1∶10(v∶v)将Folin-Ciocalteu试剂稀释,吸取0.4 mL样品与2 mL稀释的Folin-Ciocalteu试剂于试管中,再加入7.5%的Na2CO3溶液1.8 mL,混合均匀,常温下反应1 h,在765 nm 处测得吸光值。总酚含量以mL-1样品含有量相当于μg焦性没食子酸表示。
1.2.6 还原糖含量的测定 参照国标GB 5009.7-2016。
1.2.7 色差的测定 采用全自动色差仪对黑果腺肋花楸果汁CIE-L*a*b*值测定,得到亮度值L*、红色色调a*、黄色色调b*,通过公式计算ΔE,ΔE=[(ΔL*)2+(Δa*)2+(Δb*)2]1/2。
1.2.8 抗氧化活性的测定 DPPH自由基清除能力的测定参照陈建国等[20]方法;OH自由基清除能力的测定参照李艳伏等[21]的方法;总还原能力的测定参照郑义等[22]的方法。
1.2.9 感官评价 对鲜榨果汁和发酵果汁进行感官评价,将样品随机编号,装在相同的一次性水杯中。选15位有经验的评价人组成评审小组,从色泽、香气、口感和组织状态对果汁进行综合评分,对15组数据求平均值进行统计分析。感官评价标准见表2。

表2 花楸饮料的感官评分标准Table 2 Sensory evaluation criteria of Aronia juice
1.3 数据处理
本实验利用Excel和IBM SPSS Statistics 21软件,对单因素实验数据进行处理并作图,结果以平均值±标准差表示;利用IBM SPSS Statistics 21对正交实验结果进行方差分析,并对结果进行显著性分析,p<0.05为显著性差异水平。
2 结果与分析
2.1 生长曲线的绘制
植物乳杆菌生长变化情况如图1所示。0~4 h植物乳杆菌处于生长适应期,培养液中的活菌数基本不变。4~10 h植物乳杆菌处于对数生长期,此阶段,植物乳杆菌大量繁殖增长,菌体数目呈几何倍数增加[18]。当对数生长期结束时,培养基中活菌数从7.5 lg CFU/mL增加到9.8 lg CFU/mL。10 h以后进入稳定期,此阶段,培养液中的植物乳杆菌增殖与死亡处于平衡状态,活菌数不会出现较大波动[18-19]。为保证后续实验中植物乳杆菌最大接种活力,综合考虑,选取培养时间为10 h的植物乳杆菌进行实验。
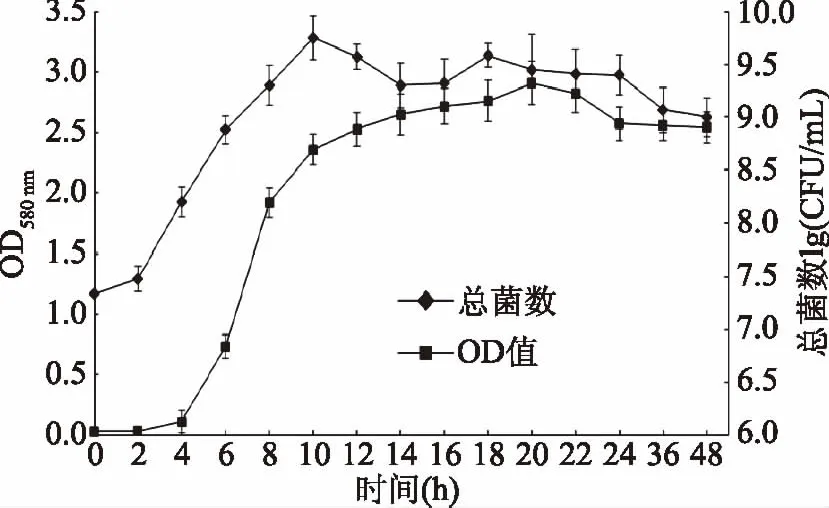
图1 植物乳杆菌C8-1生长曲线Fig.1 Growth curve of Lactobacillus plantarum C8-1
2.2 单因素实验结果
2.2.1 接种量对植物乳杆菌发酵黑果腺肋花楸的影响 由图2可知,随着接种量的增加,发酵后黑果腺肋花楸果汁中总酸含量逐渐升高,接种量达到9 lg CFU/mL后,随接种量增加,总酸含量无显著变化(p>0.05)。可能的原因是,黑果腺肋花楸果汁中的营养物质不能满足过量植物乳杆菌生长的需要[23-24]。综合经济效益,选择接种量7、8、9 lg CFU/mL三个水平进行正交试验。
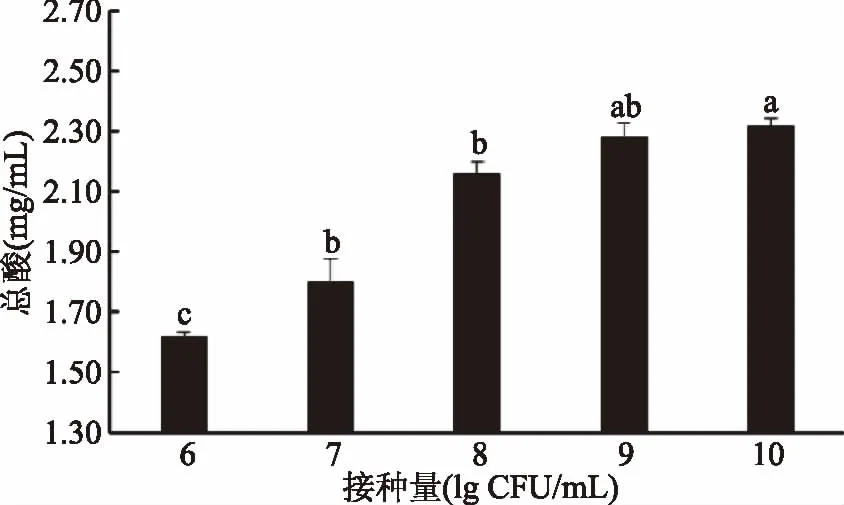
图2 接种量对植物乳杆菌发酵黑果 腺肋花楸果汁总酸含量的影响Fig.2 Effect of inoculation amount on total acid content of Lactobacillus plantarum fermented Aronia juice
2.2.2 发酵时间对植物乳杆菌发酵黑果腺肋花楸的影响 由图3可知,随发酵时间的延长,经过发酵的黑果腺肋花楸果汁中总酸含量逐渐增多,当发酵时间达到18 h时,总酸含量达到最高,之后变化不显著(p<0.05)。随发酵时间的延长,黑果腺肋花楸果汁基质中营养物质逐渐被消耗,植物乳杆菌增殖生长逐渐减弱。继续延长发酵时间,植物乳杆菌发酵效果变化不显著(p<0.05),因此选择发酵时间18、20、22 h三个水平进行正交试验。
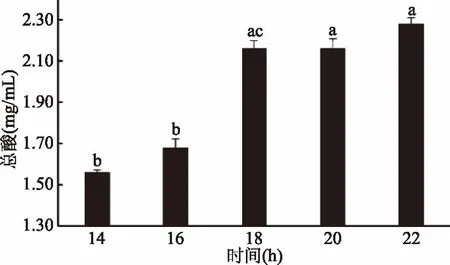
图3 发酵时间对植物乳杆菌发酵黑果 腺肋花楸果汁总酸含量的影响Fig.3 Effect of fermentation time on total acid content of Lactobacillus plantarum fermented Aronia juice
2.2.3 发酵温度对植物乳杆菌发酵黑果腺肋花楸的影响 由图4可知,在一定温度范围(31~35 ℃)内,随着温度升高,菌种活力逐渐增强,产酸量提高;当温度超过35 ℃,发酵后的黑果腺肋花楸果汁中产酸量呈现下降趋势。可能的原因有:一是温度升高,超过植物乳杆菌最适生长温度,影响植物乳杆菌生长作用,加速菌种衰老,产酸量降低[25];二是发酵过程中,样品中酒石酸被植物乳杆菌降解为乙酸和乳酸,挥发性有机酸含量增加,随着温度的升高,挥发性有机酸受温度影响,导致更多的挥发散失[26]。因此选择发酵温度33、35、37 ℃三个水平进行正交试验。

图4 发酵温度对植物乳杆菌发酵黑果 腺肋花楸果汁总酸含量的影响Fig.4 Effect of fermentation temperature on total acid content of Lactobacillus plantarum fermented Aronia juice
2.2.4 料液比对植物乳杆菌发酵黑果腺肋花楸的影响 由图5可知,当液体与物料比超过1∶1(v∶v)时,随料液比中水分含量的增加,总酸含量逐渐增多,当料液比为1∶3(v∶v)时,发酵后的黑果腺肋花楸果汁中总酸含量达到最高。考虑到发酵果汁的营养价值及感官品质,不进行更低料液比的实验研究,因此选择料液比1∶1、1∶2、1∶3(v∶v)三个水平进行正交试验。

图5 料液比对植物乳杆菌发酵黑果 腺肋花楸果汁总酸含量的影响Fig.5 Effect of feed/water ratio on total acid content of Lactobacillus plantarum fermented Aronia juice
2.2.5 蔗糖添加量对植物乳杆菌发酵黑果腺肋花楸的影响 由图6可知,蔗糖添加量为0的植物乳杆菌发酵果汁中,总酸含量低,发酵效果差,可能是黑果腺肋花楸果汁中的碳水化合物不能够满足植物乳杆菌生长与繁殖的需求,因此导致没有足够的植物乳杆菌参与整个发酵。随蔗糖添加量的增加(3%~7%),发酵后的黑果腺肋花楸果汁中总酸含量显著增多(p<0.05),植物乳杆菌的发酵效果明显增强。当蔗糖添加量为9%时,黑果腺肋花楸果汁中总酸含量显著减少(p<0.05),可能是果汁中蔗糖含量过高,果汁渗透压增大,超过植物乳杆菌对渗透压的抵抗能力,影响植物乳杆菌正常生长[27]。

图6 蔗糖添加量对植物乳杆菌发酵黑果 腺肋花楸果汁总酸含量的影响Fig.6 Effect of sucrose supplementation on total acid content of Lactobacillus plantarum fermented Aronia juice
2.3 正交试验结果
正交试验结果及极差结果见表3。由表3可知,极差RD>RA>RC>RB,植物乳杆菌发酵黑果腺肋花楸果汁总酸含量影响因素的强弱顺序为:料液比>接种量>发酵时间>发酵温度。

表3 正交实验结果及极差分析Table 3 Results and range analysis of orthogonal experiment
表4为方差分析结果。由表4可知,因素A对实验结果的影响极显著(p<0.01),因素D对实验结果的影响显著(p<0.05)。

表4 正交试验方差分析Table 4 Analysis of variance in orthogonal test
正交实验分析可知,最优组合为A3B2C3D3,即接种量9lg CFU/mL,发酵温度35 ℃,发酵时间22 h,料液比1∶3(v∶v)。由于最优组合不在所设计的9组实验中,因此选择该实验方案进行验证试验。在此条件下,经植物乳杆菌发酵黑果腺肋花楸果汁中,总酸含量6.60 mg/mL,综合总酸含量最高。
2.4 发酵对黑果腺肋花楸果汁理化品质的影响
表5~表6显示了发酵对黑果腺肋花楸果汁理化性质和色泽的影响。由表5可知,黑果腺肋花楸果汁经发酵处理后,总酚含量增加了10.51%,可能是发酵处理过程中,大分子的酚类物质在植物乳杆菌的作用下,分解为小分子的酚类物质[28];同时,一些与蛋白质和多糖结合的酚类物质在发酵过程中被释放出来[29]。总酸含量增加了74.60%,这是由于植物乳杆菌属于同型发酵乳酸菌,在发酵期间,能够大量产酸,同时引起pH的降低。由于植物乳杆菌的生长代谢以葡萄糖及蔗糖为碳源,导致发酵后的黑果腺肋花楸果汁中的还原糖及可溶性固形物含量减少。由表5可知,发酵后的黑果腺肋花楸果汁亮度L*值增大,红色色调a*值增大,黄色色调b*值增大,说明发酵对黑果腺肋花楸果汁的亮度、红色及黄色均有加强作用。其中红色色调受花青素的影响较大,可能是发酵产生的乳酸使得黑果腺肋花楸果汁的pH降低,花青素的红颜色深浅同pH成负相关[29-30],进而导致红色色调增强;黄色色调受总酚和总黄酮等酚类物质影响较大,可能是因为植物乳杆菌发酵促进了多酚类物质的释放及产生,导致发酵后的黑果腺肋花楸果汁中的多酚类物质增加,进而导致黄色色调增强[31-32]。

表5 发酵对黑果腺肋花楸果汁理化性质的影响Table 5 Effects of fermentation on physico-chemical properties of Aronia

表6 发酵对黑果腺肋花楸果汁色泽的影响Table 6 Effect of fermentation on the color of Aronia juice
由表7可知,发酵处理后的黑果腺肋花楸果汁的DPPH清除率为65.13%,羟自由基清除率为63.75%,总还原能力为0.720,极显著高于对照组果汁的52.25%、49.69%、0.372(p<0.01),发酵处理能够显著增强黑果腺肋花楸果汁抗氧化能力(p<0.01)。总酚含量与抗氧化活性呈正相关,多酚类物质含量越高,抗氧化能力越强[33],发酵处理的黑果腺肋花楸果汁中总酚含量极显著提高(p<0.01),因此,发酵后的黑果腺肋花楸果汁的抗氧化能力极显著高于鲜榨果汁(p<0.01)。

表7 发酵果汁与对照组的DPPH自由基清除率、 OH自由基清除率和总还原能力的比较Table 7 Comparation of OH clearance,DPPH clearance and the total reducing power of fermented juice and control
15位评价员按制定的评价指标对发酵果汁和鲜榨果汁进行感官评价,评价结果如图7所示。由图7可知,果汁经过发酵处理后,香气和口感的评分较鲜榨果汁有明显提高,这说明发酵处理能够有效改善黑果腺肋花楸果汁酸涩的口感和浓厚的青草味。实验结果与文献报道相似,众多研究人员表明,乳酸菌发酵能够在很大程度上改善果蔬制品和奶制品的风味及质地[34-35]。
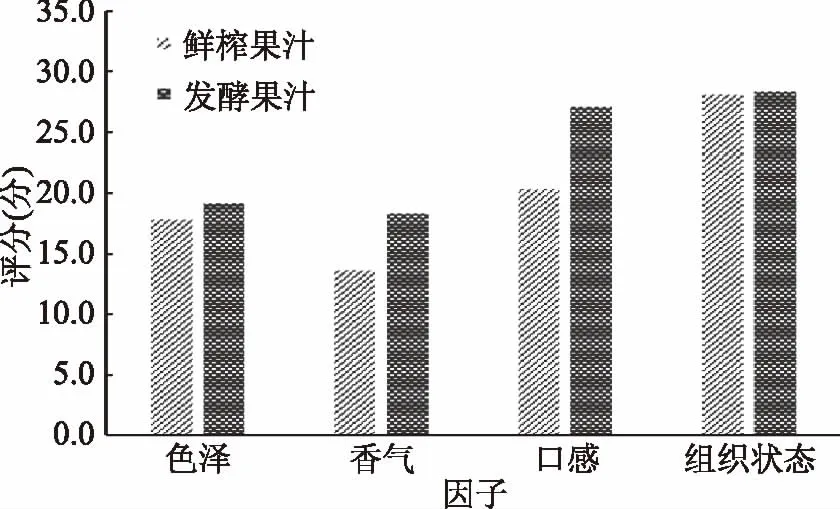
图7 感官评价评定结果Fig.7 Results of the sensory evaluation
3 结论
本实验首次利用植物乳杆菌C8-1对黑果腺肋花楸果汁进行发酵研究,对其生长周期研究可知,植物乳杆菌C8-1的生长适应期为4 h,4~10 h为对数期,10 h达到生长稳定期。经单因素实验以及正交试验对发酵条件进行优化,得到的最佳发酵条件为:接种量9lg CFU/mL,发酵温度35 ℃,发酵时间22 h,料液比1∶3(v∶v),在此条件下,总酸含量为6.60 mg/mL,发酵达到最佳状态,产品感官评分较鲜榨果汁提升明显。果汁发酵前后品质对比实验表明,发酵处理对黑果腺肋花楸果汁的亮度、红色及黄色均有加强作用;总酸含量增加了74.60%;总酚含量增加了10.51%;还原糖含量降低4.41%,可溶性固形物含量降低6.15%;发酵处理后的黑果腺肋花楸果汁的DPPH清除率为65.13%,羟自由基清除率为63.75%,总还原能力为0.720,极显著高于对照组果汁的52.25%、49.69%、0.372(p<0.01),发酵处理能够显著增强黑果腺肋花楸果汁抗氧化能力(p<0.01);感官评分较鲜榨果汁有明显提高,这说明发酵处理能够有效改善黑果腺肋花楸果汁的口感和风味。本实验为黑果腺肋花楸精深加工和综合利用提供了新思路。
