超高压和高温短时杀菌对樱桃汁品质的影响
2018-09-22彭思嘉侯志强徐贞贞廖小军
彭思嘉,侯志强,徐贞贞,廖小军,*
(1.中国农业大学食品科学与营养工程学院,国家果蔬加工工程技术研究中心, 农业部果蔬加工重点实验室,食品非热加工北京市重点实验室,北京 100083; 2.中国农业科学院农业质量标准与检测技术研究所,农业部农产品质量安全重点实验室,北京 100081)
樱桃(Cerasuspseudocerasus)是维生素C、多酚、花色苷等抗氧化物质含量丰富的果品。由于樱桃成熟期短、集中上市,不耐贮藏,其远销和大规模生产种植被限制。我国的樱桃以鲜食为主,加工约占10%。目前樱桃汁采用传统高温杀菌方式,高温杀菌虽然能够很好的杀灭食品中的微生物,保证食品安全,延长货架期,但不可避免的存在一些缺陷,比如易导致其色泽破坏、风味丧失、营养损失等。
超高压技术(high pressure processing,HPP)是指将食品密封在柔性容器内,以水或其他液体作为传压介质,在常温或稍高于常温(25~60 ℃)下进行100~1000 MPa的加压处理,维持一定时间后以达到杀灭食品中微生物、钝化内源酶的目的[1]。HPP处理使渗透入微生物体内的水或其它物质膨胀,从而破坏细胞壁,改变蛋白质结构,抑制遗传物质复制,使菌体破碎,从而导致微生物体的死亡[2],几乎可以杀灭所有微生物。由于HPP处理不会破坏共价键,能够较好地保护食品的风味、营养、色泽等[3],越来越多的应用于食品加工中。近些年来,HPP技术已经成为食品领域可行的加工手段,在果蔬、肉、乳制品的商业化应用达到了较高的水平[4]。目前,有诸多利用超高压技术对果蔬汁杀菌、钝酶及品质变化的研究,包括苹果复合汁[5]、草莓汁[6]、葡萄柚汁[7]等,但尚未见超高压技术在樱桃汁加工中的应用研究。
本文比较了超高压和高温短时(high temperature short time,HTST)杀菌对樱桃汁品质影响及贮藏期间樱桃汁品质变化,旨在为超高压技术在樱桃汁产业化的应用提供理论支持。
1 材料与方法
1.1 材料与仪器
新鲜成熟樱桃(品种红灯) 山东省青岛市;PET瓶 康通塑料包装用品;甲醇、乙腈 色谱纯,德国Merck公司;甲酸 色谱纯,MREDA公司;Folin-Ciocalteu试剂 分析纯,北京拜尔迪生物技术有限公司;Trolox、DPPH、2,4,6-三(2-吡啶)-1,3,5-三吖嗪(TPTZ)、对照品维生素C、绿原酸、儿茶酚、矢车菊素-3-芸香糖苷、天竺葵素-3,5二葡萄糖苷 分析纯,均购自Sigma-Aldrich上海贸易有限公司;其他试剂 均为国产分析纯。
JYL-C051料理机 九阳股份有限公司;BYTQG脱气机 温州滨一机械科技有限公司;PB-10 pH计 德国赛多利斯公司;WAY-2S数字阿贝折射仪 上海精密科学仪器有限公司;T6紫外分光光度计 北京普析通用有限公司;Metrohm自动电位滴定仪 瑞士万通公司;KQ-500DE型超声波清洗器 昆山市超声仪器有限公司;LC-20AT高效液相色谱仪 日本岛津公司;FT74X高温瞬时杀菌系统 英国Armfield公司;HPP-30L-600 MPa超高压设备 包头科发高压科技有限公司。
1.2 实验方法
1.2.1 樱桃汁的制备 樱桃清洗、去梗,按总重35%的比例加入含3%VC的水溶液打浆,采用四层纱布过滤后,向其中加入1%的白砂糖,充分搅拌溶解。真空脱气后灌装到60 mL PET瓶中,封口。
1.2.2 超高压处理 将灌装好的樱桃汁放入超高压设备中,室温下采用压力550 MPa、保压2 min处理样品,处理后样品一部分立即用于测定微生物及品质指标,其余放于4 ℃贮藏用于品质变化分析。
1.2.3 高温短时处理 采用超高温瞬时杀菌系统对樱桃汁进行杀菌,条件为95 ℃/15 s。热杀菌的樱桃汁于无菌超净工作台中灌装到60 mL PET瓶中,封口。处理后样品一部分立即用于测定微生物及品质指标,其余放于4 ℃贮藏用于品质变化分析。
1.2.4 指标测定
1.2.4.1 微生物的测定 采用平板计数法,根据GB4789.2-2010《食品微生物学检验菌落总数测定》进行菌落总数的测定,及GB4789.15-2010《食品微生物学检验霉菌和酵母计数》进行霉菌和酵母菌数的测定。
1.2.4.2 pH的测定 取10 mL样品于烧杯中,采用pH计室温下测定HPP处理和HTST处理樱桃汁的pH。
1.2.4.3 可滴定酸(titratable acid,TA)的测定 取20 mL樱桃汁,记录质量,用0.1 mol/L NaOH溶液滴定至pH8.1[8]。样品TA用柠檬酸的百分含量表示,计算公式如下:
式(1)
其中,TA为可滴定酸含量(%);C为NaOH溶液浓度(0.1 mol/L);V1为滴定所用样品体积(mL);V2为消耗NaOH溶液体积(mL);K为折算系数(以一水柠檬酸计,0.070);V0为樱桃汁样品总体积(mL);m为样品质量(g)。
1.2.4.4 可溶性固形物(soluble solids,SS)的测定 使用数字阿贝折光仪室温下测定。
1.2.4.5 色泽 采用全自动色差仪在反射模式下测定樱桃汁的亮度(L*)、红度(a*)、蓝度(b*)值。总色差的计算公式如下:
式(2)

1.2.4.6 总酚含量的测定 采用Folin-Ciocalteu’s法测定总酚含量[9]。取5 g樱桃汁,加30 mL甲醇,30 ℃/500 W超声30 min,于4 ℃、10000 r/min下离心10 min,取上清液定容至50 mL备用。取0.1 mL樱桃汁上清液(以无水甲醇做空白对照),用无水甲醇稀释4倍,与2 mL稀释10倍的Folin-phenol试剂混合后,于室温下避光反应1 h,再加入1.8 mL 7.5%的碳酸钠溶液,室温下避光反应15 min,用紫外分光光度计测定765 nm处吸光值,总酚含量以每mL样品含有焦性没食子酸当量(mg)表示。配制不同浓度没食子酸标准溶液绘制标准曲线,标准曲线方程为:y=0.0108x+0.0142(R2=0.999)。
1.2.4.7 铁离子还原能力的测定 参照Suarez等[10]的方法。样品前处理与总酚相同。取100 μL样品加入到4 mL TPTZ工作液(工作液由0.2 mol/L醋酸盐缓冲液(pH3.6):10 mmol/L的TPTZ溶液:20 mmol/L的FeCl3溶液按体积比10∶1∶1配制而成)于37 ℃反应10 min后,测定其在593 nm处吸光值,以蒸馏水为对照。配制不同浓度的Trolox标准溶液绘制标准曲线,标准曲线方程为:y=1.1015x+0.0096(R2=0.993)。
1.2.4.8 清除DPPH自由基能力的测定 参照Suarez等[10]的方法。样品前处理与总酚相同。取25 μL样品加入到4 mL DPPH自由基(0.14 mmol/L)溶液中,常温避光放置70 min后,测定其在517 nm处吸光值,以甲醇溶液为对照。计算公式为:
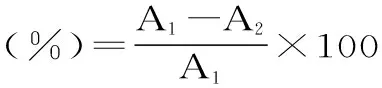
式(3)
其中,A1为不加样品的DPPH自由基溶液的吸光度;A2为加样品的DPPH自由基溶液的吸光度。配制不同浓度的Trolox标准溶液绘制标准曲线,标准曲线方程为:y=5.9987x-3.3866(R2=0.994)。
1.2.4.9 维生素C含量的测定 参考Tiwari等[11]的方法。取5 g样品与25 mL 2.5%的偏磷酸混合,4 ℃下提取2 h。然后4 ℃、12000 r/min离心10 min,过滤取上清液即为维生素C粗提液。采用高效液相色谱仪测定,粗提液过0.45 μm膜待上样,Agela C18柱(4.6 mm×250 mm i.d,5 μm),流动相A为95% 50 mmol/L的磷酸二氢钾(pH=3),流动相B为5%乙腈。二元高压梯度等速洗脱,流速为1 mL/min,进样量20 μL,检测波长245 nm,柱温30 ℃。配制不同浓度维生素C标准溶液绘制标准曲线,拟合方程为:y=154356707x+23678217(R2=0.996)。
1.2.4.10 酚类物质含量的测定 按照Escarpa等[12]方法,取5 g樱桃汁与30 mL甲醇混合,超声30 min,于4 ℃、10000 r/min下离心10 min,过滤取上清液待用。采用高效液相色谱仪测定,提取液过0.45 μm膜待上样,Agela C18柱(4.6 mm×250 mm i.d,5 μm),流动相A为0.1 mol/L磷酸,B为100%甲醇。开始浓度B为5%,10 min升至50%,15 min升至70%,20 min升至80%,25 min达到100%。二元高压梯度等速洗脱,流速为1 mL/min,进样量20 μL,检测波长280 nm,柱温30 ℃。根据Usenik等[13]研究结果,选取具有代表性的绿原酸、儿茶酚进行测定。绘制标准曲线为:儿茶酚:y=23823020x(R2=0.9939);绿原酸:y=35718880x+325366(R2=0.996)。
1.2.4.11 花色苷含量的测定 参照Garcia等[14]的方法。取10 g样品,加入20 mL 0.1% HCl的无水甲醇,4 ℃下静置提取2 h。于12000 r/min、4 ℃下离心10 min,过滤取上清液待用。采用高效液相色谱仪测定,提取液过0.45 μm膜待上样,Agela C18柱(4.6 mm×250 mm i.d,5 μm),流动相A为5%甲酸-水,B为100%甲醇。B的浓度在0~15 min为15%,15~20 min为30%,30 min达到50%,33 min达到80%。配制不同浓度的标准溶液绘制标准曲线为:矢车菊素-3-芸香糖苷:y=493217x(R2=0.999);天竺葵素-3,5-二葡萄糖苷:y=16141x-169554(R2=0.990)。
1.2.4.12 多酚氧化酶(PPO)活性的测定 参照Ndiaye等[15]的方法。将10 g样品与80 mL 提取液混合均匀,8000 r/min,4 ℃离心10 min,过滤取上清液为酶粗提液。其中,PPO的提取液为磷酸缓冲液(0.2 mol/L,pH=6.5)。采用分光光度法,反应底物为0.5 mL 0.07 mol/L的邻苯二酚溶液(用0.2 mol/L,pH=6.5的磷酸缓冲液配制),将反应底物加入到2.0 mL磷酸缓冲液中,再加入0.5 mL PPO粗酶液,混合均匀后在420 nm处测定吸光值随时间的变化曲线,时间间隔为15 s,PPO酶活性计算方法如下:以每min吸光度A变化0.01为一个多酚氧化酶活性单位(U)。
式(4)
其中,A为反应时间内吸光度的变化;W为样品鲜重(g);t为反应时间(min);VT为提取酶液总体积(mL);VS为测定时取用酶液体积(mL)。
1.2.4.13 果胶含量的测定 将10 g样品与60 mL 95%乙醇混合均匀,将混合物放入100 ℃水浴中煮20 min,冷却至室温后用漏斗过滤,不溶物用煮沸的乙醇冲洗,最后得到均一、白色粉末状固体,于35 ℃烘至恒重。称取40 mg不溶性物质,经30 mL含0.5%硫酸溶液提取得到水溶性果胶,提取液于10000 r/min离心15 min,收集上清液定容至100 mL。取1 mL样品加入至6 mL浓硫酸-四硼酸钠溶液(0.0125 mol/L)后立即放入冰水浴中,直到达到室温,加入0.1 mL 0.15%间苯基苯酚溶液,混合后于520 nm测定吸光值。配制不同浓度半乳糖醛酸的标准溶液按上述比色法绘制标准曲线为:y=0.009x+0.038(R2=0.999)。
1.2.4.14 感官评价 樱桃汁经HPP和HTST处理后立即进行感官评价,按照感官评分标准(如表1所示)采用9分制打分法对样品的香气、滋味、颜色、组织状态以及综合情况进行评分,分数越高代表对该属性的嗜好程度越强。不同处理的樱桃汁分装到品尝杯中并随机编号放在托盘中提供给20名感官评价员,男女各半,年龄(20±1)岁。

表1 樱桃汁感官评分标准Table 1 Score standard for sensory evaluation of the cherry juice
1.3 数据统计与分析
所有实验进行3次重复。采用Origin 8.0软件进行数据处理与绘图。采用SPSS 22.0软件检验不同处理间差异显著性,p>0.05表示差异不显著,p<0.05表示差异显著。结果中以相同字母表示无显著性差异,不同字母则表示存在显著差异。
2 结果与分析
2.1 微生物变化
由表2可知,樱桃汁初始细菌总数以及霉菌与酵母菌总数分别为1.27×103和4.90×104CFU/mL,经过HPP和HTST杀菌后樱桃汁菌落总数小于100 CFU/mL,而霉菌和酵母菌未检出,均符合国家标准。贮藏期间HPP和HTST樱桃汁菌落总数均先下降后缓缓上升,可能是HPP和HTST造成了部分细菌的亚致死损伤[16-17],贮藏期出现修复,第15 d和20 d后细菌总数超过国标100 CFU/mL,但贮藏期间霉菌和酵母菌没有被检出。
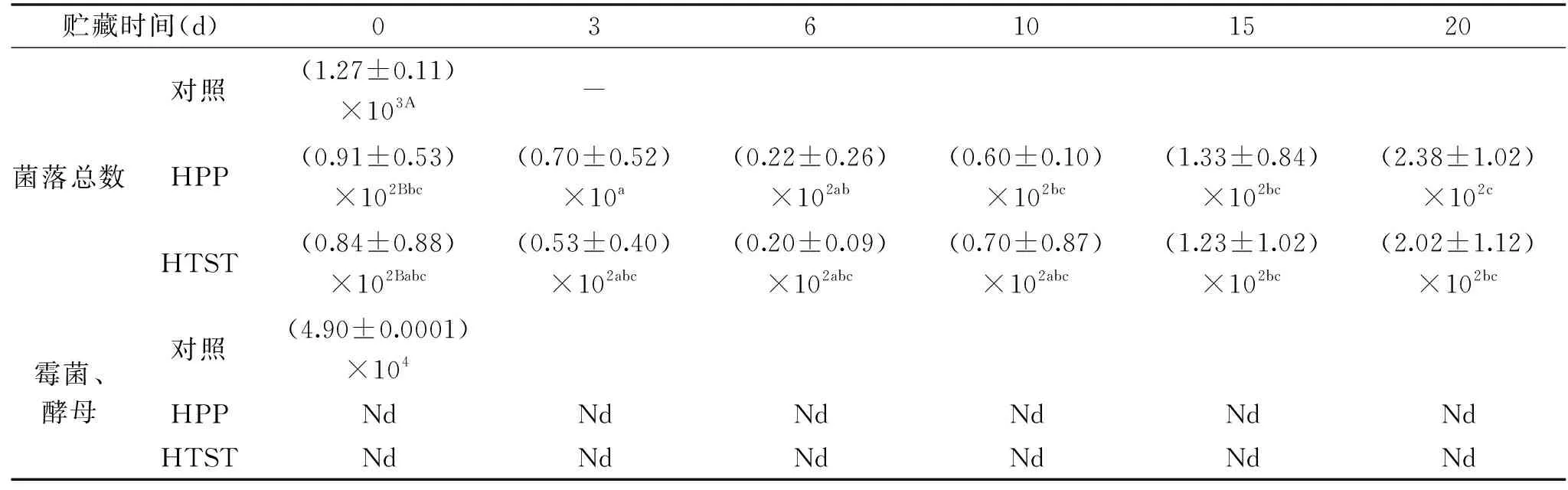
表2 HPP和HTST处理后樱桃汁微生物的变化Table 2 Change of microbes of HPP-and HTST-processed cherry juice
2.2 pH、TA、SS和果胶含量的变化
由表3可知,HTST对樱桃汁pH和TA无影响,显著降低了樱桃汁SS含量(p<0.05),可能由于樱桃汁SS含量较高,高温下发生美拉德反应;美拉德反应是热加工果汁品质的影响极其重要,果汁中羰基化合物和游离氨基酸、蛋白质、肽链及胺类等氨基化合物上的氨基之间反应生成糖胺,再经过一系列复杂过程生成褐色素[18-19]。樱桃碳水化合物和蛋白质的含量较高[20],因此在热加工过程中可能较易发生美拉德反应从而使SS含量下降。陈子叶等[21]研究的甘蔗汁在相同条件HTST处理前后SS无显著差异,可能由于甘蔗中的蛋白质含量(0.4 g/100 g)较樱桃少,而且在酸性条件下,美拉德反应发生1,2-烯醇化反应,樱桃汁的pH较低,故更容易发生美拉德反应。

表3 HPP和HTST处理后樱桃汁pH、SS、TA含量的变化Table 3 Changes of pH,SS and TA of HPP-and HTST-processed cherry juice
HPP显著降低樱桃汁pH(p<0.05),对樱桃汁SS和TA均无影响(p>0.05)。贮藏期间两种处理樱桃汁的pH和SS含量无显著变化(p>0.05),TA含量增加,可能与微生物增加产酸或果胶降解有关。
由表3可知,HPP对樱桃汁果胶含量无影响,而HTST显著降低樱桃汁果胶含量(p<0.05),可能因为果胶在高温、低pH条件下发生降解。贮藏期间两种处理的樱桃汁果胶含量均呈现先增加后下降的趋势,主要原因是原果胶逐渐转化为果胶,而后果胶被果胶甲酯酶和多聚半乳糖醛酸酶水解成半乳糖醛酸。
2.3 颜色和多酚氧化酶含量的变化
樱桃汁颜色的变化情况如表4所示。两种樱桃汁的亮度L*、红度a*、黄度b*均有所下降,HPP处理樱桃汁总色差ΔE>2,说明HPP引起了樱桃汁肉眼可见的颜色变化(通常认为当ΔE≥2时,色泽变化明显可见;而ΔE<2时,色泽变化肉眼不可见。贮藏期间两种处理樱桃汁L*、a*、b*、ΔE值呈波动趋势。
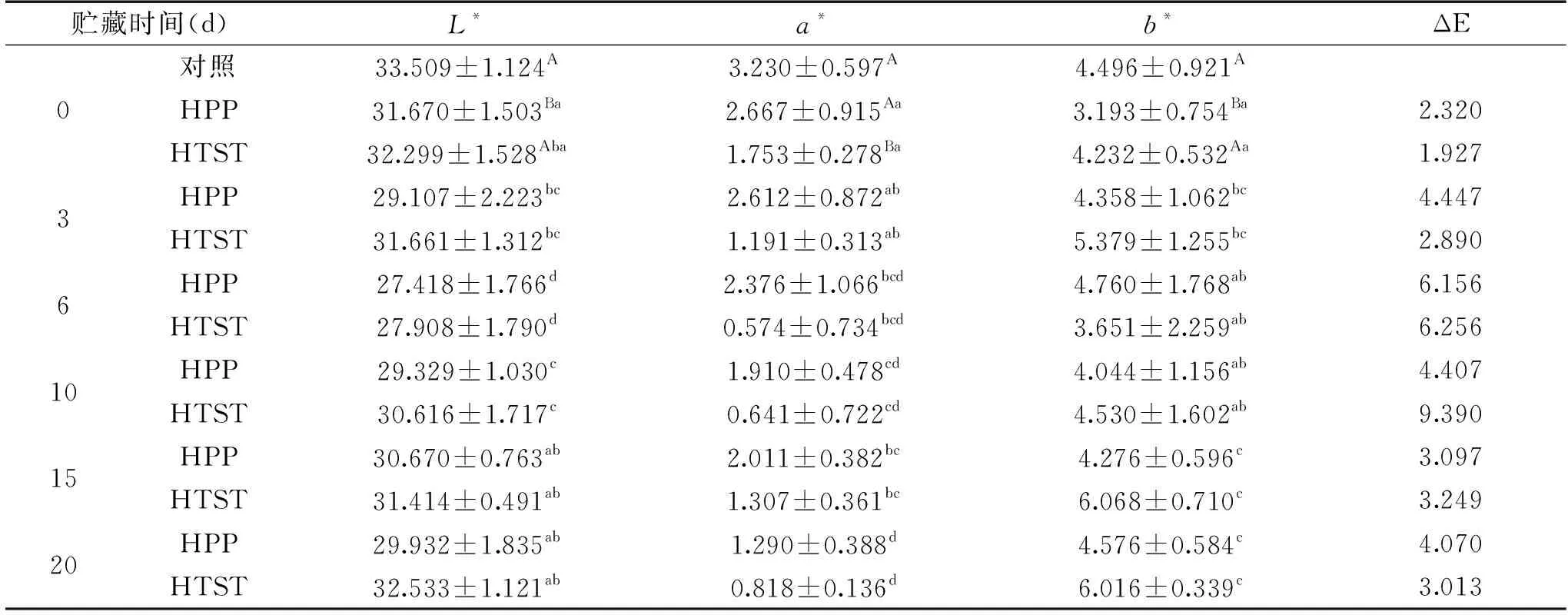
表4 HPP和HTST处理樱桃汁颜色的变化Table 4 Changes of color of HPP-and HTST-processed cherry juice
HTST处理使樱桃PPO酶失活(表5),贮藏过程中不存在酶促褐变,樱桃汁颜色变化可能与维生素C、多酚等物质氧化褐变有关;而HPP处理的樱桃汁中PPO酶仍保持82%的残留活性,贮藏过程存在酶促褐变反应,导致樱桃汁颜色变化明显。PPO是一种耐压能力很强的酶[22],曾庆梅等[23]研究表明,500 MPa/50 ℃/10 min处理后梨汁PPO残留活性为75.3%。

表5 HPP和HTST处理后樱桃汁中PPO酶活性变化Table 5 Changes of PPO of HPP-and HTST-processed cherry juice
2.4 抗氧化物质含量及抗氧化能力的变化
由表6可知,HPP对樱桃汁总酚含量无影响(p>0.05),而HTST樱桃汁总酚保留率仅为83.9%(p<0.05);HPP将樱桃汁儿茶酚含量提高了4.6%,而HTST将儿茶酚含量降低了6.8%;两种处理均显著降低绿原酸含量(p<0.05),保留率分别为95.4%、90.3%。酚类物质在热处理作用下极易氧化[24],而HPP处理能够得到更好的保留[25]。

表6 HPP和HTST处理后樱桃汁抗氧化物质含量及抗氧化能力的变化Table 6 Changes of antioxidants and antioxidative capacity of HPP-and HTST-processed cherry juice
儿茶酚含量的增加可能是由于超高压增加了其提取率。Queiroz,Gao等[26-27]研究HPP处理苹果汁、西柚汁得到相同结果,400 MPa/7 min处理的苹果汁和550 MPa/10 min处理前后的西柚汁总酚含量不变。而Wang,Zhao等[28-29]研究发现,在HPP条件为400~600 MPa/2.5~10 min,500 MPa/10 min时,紫甘薯汁和库尔勒香梨汁的总酚含量下降但无显著性差异。这种差异的可能是由于不同食品体系的PPO酶活性或压力、保压时间等加工条件不同造成。贮藏后期,两种樱桃汁总酚含量均显著下降(p<0.05),酚类物质含量下降原因主要有酚类物质的氧化降解、酚类物质与蛋白质或花色苷聚合反应以及PPO酶促反应[30]。HPP樱桃汁贮藏6 d后总酚显著下降(p<0.05),这与HPP处理后樱桃汁PPO保持较高的活性有关;而HTST樱桃汁贮藏10d后总酚显著下降(p<0.05),这可能与氧化降解以及聚合反应有关。贮藏期间,HPP与HTST樱桃汁绿原酸和儿茶酚含量有所波动,但呈下降趋势,最终保留率均在80%以上。
HPP处理后樱桃汁维生素C保留率达95.9%,而HTST樱桃汁维生素C仅保留45.3%(p<0.05)。林怡发现,HPP处理杨梅汁维生素C保留97.7%~98.8%,而热处理杨梅汁保留59.0%~61.8%[31]。超高压处理过程会将氧气压入食品体系,促进其与维生素C接触,从而导致少量维生素C氧化降解[32-33],而维生素C对温度敏感,在热处理作用下大量氧化降解[34]。贮藏期间HPP樱桃汁维生素C变化不大,而HTST樱桃汁维生素C显著下降(p<0.05),20 d后保留率仅为42.6%。
HPP和HTST处理后樱桃汁矢车菊素-3-芸香糖苷含量均显著降低(p<0.05),保留率分别为77.7%和69.1%。HPP樱桃汁天竺葵素-3,5-二葡萄糖苷含量与对照无显著差异(p>0.05),而HTST樱桃汁显著降低(p<0.05),仅保留88.3%。林怡研究表明,经过超高压(500 MPa/10 min)处理的杨梅汁与对照相比花青素含量未发生显著变化[31]。贮藏期间,两种花色苷含量均呈现波动状态,HPP樱桃汁矢车菊素-3-芸香糖苷含量始终高于HTST组,天竺葵素-3,5-二葡萄糖苷含量贮藏前期高于HTST组而贮藏结束时低于HTST组。花色苷的稳定性受到温度、氧气、维生素C、PPO、过氧化物酶以及β-葡萄糖苷酶等因素的影响[35-36]。超高压处理未完全钝化PPO及樱桃汁中的维生素C含量高,都可能造成花色苷降解。
与对照组相比,两种樱桃汁抗氧化能力均有升高。贮藏期间,两种樱桃汁抗氧化能力呈现下降趋势。HPP樱桃汁抗氧化能力高于HTST的原因是HPP能够更好的保存维生素C、绿原酸、儿茶酚、花色苷等物质。
2.5 感官评价
图1为HPP和HTST樱桃汁在处理后和贮藏20 d后的感官评价结果。HPP组处理后样品在综合、香气、滋味、颜色四个方面得分均高于HTST组,但无显著性差异(p>0.05)。两组樱桃汁在组织状态方面差异显著(p<0.05),HPP组较差,主要因为超高压樱桃汁中果胶含量较高使得组织状态粘稠,流动性较差。4 ℃贮藏20 d后,两种果汁在香气、滋味方面无显著变化(p>0.05),但颜色均明显变差。HPP樱桃汁的组织状态仍不及HTST樱桃汁,但与HPP刚处理的樱桃汁相比,其组织状态的评分有改善,主要由于果胶在贮藏期间发生降解,使得果汁的流动性变好,更符合消费者的感官喜好。

图1 HPP和HTST处理对樱桃汁感官评价的影响Fig.1 Changes of sensory evaluation of HPP-and HTST-processed cherry juice
3 结论
HPP和HTST对樱桃汁中微生物均具有较好的杀灭效果;HPP能够更好地保留樱桃汁的酚类物质、维生素C、花色苷等物质,并具有较好的感官品质,但不能充分钝化樱桃汁的多酚氧化酶。4 ℃贮藏期间,两种樱桃汁菌落总数均缓慢升高,但霉菌和酵母菌均未检出。两种樱桃汁中酚类化合物、维生素C、花色苷以及抗氧化能力在贮藏期间均呈现下降趋势,但贮藏结束时HPP樱桃汁仍能更好的保留营养物质。综上所述,HPP更适合樱桃汁杀菌。
