内耳毛细胞再生及其信号通路的研究进展*
2018-09-22谢利红王梦琳唐安洲
谢利红 王梦琳 唐安洲
1 广西医科大学第一附属医院耳鼻咽喉头颈外科(南宁 530021)
噪声暴露、环境因素、药物毒性或年龄老化等均可导致耳蜗毛细胞损伤,并继发螺旋神经节细胞损伤,成年哺乳动物毛细胞损伤后无自发再生能力可导致永久性的感音神经性聋[1~3]。近年来国内外学者对于激活内耳相关通路、诱导内耳感觉前体细胞(部分具有增殖能力的支持细胞亦称感觉前体细胞)或干细胞重新进入细胞周期,增殖、分化为毛细胞,使听力或前庭功能恢复的研究成为热点[4],毛细胞再生有望成为听力恢复的理想治疗方法。本文就内耳毛细再生及其信号通路等研究进行综述。
1 哺乳动物内耳毛细胞再生的现状
在胚胎发育的早期,外胚层增厚形成耳板,耳板内陷后逐渐形成听觉和前庭系统[5, 6]。在内耳的发育形成过程中毛细胞与支持细胞拥有共同的祖细胞。在非哺乳脊椎动物中(如鸟类和禽类)毛细胞损伤后可由其邻近的支持细胞通过有丝分裂增殖、分化为新的毛细胞而恢复听力[7]。与非哺乳脊椎动物不同,成年哺乳动物的毛细胞损伤缺失后不能自发产生新的毛细胞,从而导致永久性听力障碍。通过体外诱导新生哺乳动物的内耳感觉前体细胞、干细胞,可以将其分化为毛细胞样细胞;研究人员分别从耳蜗Corti器、大上皮脊(GER)、小上皮脊(LER) 前庭球囊和椭圆囊感觉上皮[8~10]、三个半规管的壶腹脊等不同组织中均分离得到了内耳干细胞[11]。
Li等[10]将内耳干细胞接种在多聚赖氨酸预先处理好的培养皿中,贴壁无血清培养,14天之后基因检测表明分化之后的细胞表达毛细胞标志物MyosinⅦ和Bm3c。Oshiima等[11]对分化后的毛细胞进行电生理检测,显示该细胞可产生电压依赖性电流。Li等[10]研究还发现内耳干细胞在体外具有分化为毛细胞之外的多分化潜能。
在新生哺乳动物耳蜗Corti器中分离出感觉前体细胞,如:少量Lgr5+Axin2+前体细胞具有有限的毛细胞再生能力[12, 13]。Oshima等[11]通过培养新生小鼠 Corti器中的干细胞发现其可分化成为具有多种毛细胞标记物的细胞,但是在小鼠出生2~3周后耳蜗中的干细胞数量明显减少。氨基糖苷类药物损伤体外培养新生鼠的毛细胞后,通过诱导部分干细胞可分化成为未成熟毛细胞[14]。新生毛细胞主要位于内生毛细胞周围,基底膜外侧出现Tuj1(+) 标记神经再支配[15]。成年哺乳动物毛细胞损伤后不能自发产生新的毛细胞,但近年来研究发现,内耳受损区旁的毛细胞、支持细胞、多能干细胞等在一定条件诱导下可能是毛细胞再生的来源,Walters等[16]在敲除p27Kip1基因的噪声性聋模型成年鼠中,发现异位Aloh1的表达增加,受损毛细胞周围的支持细胞可以产生新的毛细胞。White等[17]研究显示,氨基糖苷类药物损伤成熟哺乳动物毛细胞后,通过体外培养内耳感觉上皮,发现支持细胞具有转化为未成熟毛细胞的潜能。
2 内耳毛细胞再生的信号调控机制
近年来,在对鸡、斑马鱼或鼠等动物毛细胞再生的研究后认为,部分支持细胞具有感觉前体细胞作用,能被诱导增殖并分化为毛细胞,其分化再生为毛细胞主要通过两种途径:一种是感觉前体细胞经诱导激活后重新进入细胞周期,通过有丝分裂增殖、进一步分化成为毛细胞及支持细胞; 另一种则是通过直接分化的途径而再生成为毛细胞[18]。感觉前体细胞的增殖和分化过程受各种相关的信号通路调控,近年来研究比较多的通路包括Wnt信号通路、Noth信号通路、BMP/Smad、FGF、IGF和Shh信号通路等[6, 19~21]。这些信号通路在胚胎时期毛细胞发育和分化形成的多个环节中起重要调控作用,可对一些细胞周期调控因子进行调控。而在成年哺乳动物内耳中这些信号通路会出现改变,此可能是使毛细胞损伤后无再生能力的重要原因。目前研究最多的是Notch信号通路及Wnt信号通路,两者均是复杂和高度保守的信号通路,在内耳细胞的增殖、迁移、细胞极性、神经形成和干细胞的多态性中起作用。
2.1Wnt信号通路在内耳毛细胞再生中的调控作用 Wnt信号通路包括经典Wnt /β-catenin通路和非经典Wnt 信号通路,其中非经典Wnt 信号通路主要包括:Wnt/平面细胞极性通路、Wnt/PCP信号通路和Wnt/calcium信号通路[12, 22, 23]。
经典Wnt /β-catenin通路包括Wnt配体与细胞膜表面的Frizzled受体和LRP5 / 6受体的耦合,激活Dash蛋白导致Axin2/ GSK3β/ APC复合体的解体,β-catenin 蛋白的释放进入细核内,与T细胞因子(T cell factor / lymphoid enhancerfactor, TCF/LEF)相互作用(图1),调节靶基因(如Atoh1、Axin2、Lgr5等)的表达。在Wnt 信号没有激活时,β-catenin 在内耳细胞内维持很低的水平,当Wnt信号通路激活时,β-catenins水平增加。Wnt/β-catenin抑制剂可以减少胚胎耳蜗感觉前体细胞的增殖,相反使用LiCl等Wnt/β-catenin活化剂可引起Sox2阳性表达的内耳前体细胞和毛细胞数量的增加[7]。在敲除β-catenin的转基因鼠中,前体细胞则停止分化,毛细胞数量减少,其下游的靶基因Atoh1的表达也会明显减少。Wnt/PCP信号通路调节耳蜗再生毛细胞表面的纤毛束的形成和方向,与毛细胞的外形和Corti器的形状有关。
Wnt/PCP信号通路参与毛细胞再生的机制目前尚未明确,其受GTP酶RhoA和Ras的调节,RhoA和Ras可激活JNK(c-Jun氨基末端激酶,c-Jun N-terminal kinase,又称为应激活话蛋白激酶)和ROCK(Rho相关卷曲螺旋形成蛋白激酶,Rho associated coiledeoil forming protein kinase,ROCK),引起细胞骨架重排,导致细胞形态改变。在Wnt/calcium 信号通路中,Wnt 配体和Fzd受体结合可引起钙离子的释放,促使钙离子依赖性酶类的激活,该通路与胚胎发育阶段的细胞运动和体轴建立有关[24, 25]。
在Wnt信号通路中,与哺乳动物内耳发育过程有关的主要有经典Wnt/β-catenin和Wnt/PCP 信号通路,到目前为止,未发现Wnt/calcium 信号通路在内耳发育过程中有明显的作用。经典Wnt/β-catenin 信号通路主要在内耳发育早期起作用,自E12.5(胚胎12.5天)起,主要参与感觉上皮区域细胞命运的决定;Wnt/PCP 信号通路则在毛细胞静纤毛的排列和蜗管的延伸过程中起着重要作用[26]。
2.2Notch信号通路在内耳毛细胞再生中的调控作用 研究表明 Notch信号负性调节内耳感觉前体细胞的增殖,并维持耳蜗感觉上皮细胞数量和结构的稳态[20]。Notch信号转导不需蛋白激活和第二信使的参与,可通过细胞表面的受体,直接接收邻近细胞的信号并传导至细胞核,激活细胞核内相关转录因子的表达。在哺乳类动物的听觉感受上皮中Notch信号通路的受体主要是Notchl,配体主要为Deltal、Jagged1和Jagged2[6, 27],当邻近细胞表面的配体结合Notch蛋白后,Notch信号被激活,由γ-secretase酶水解、切割Notch跨膜区,释放Notch的胞内结构域(notch intracellular domain,NICD),并被转运到到细胞核中,与CSL家族(CBF1、SuH、Lagl)转录因子相结合,诱导一系列基因的转录(图2)。Notch信号中Jagged 1的缺失会导致Sox2 and P27kip1阳性的感觉前体细胞减少,从而引起毛细胞数量的减少[6]。
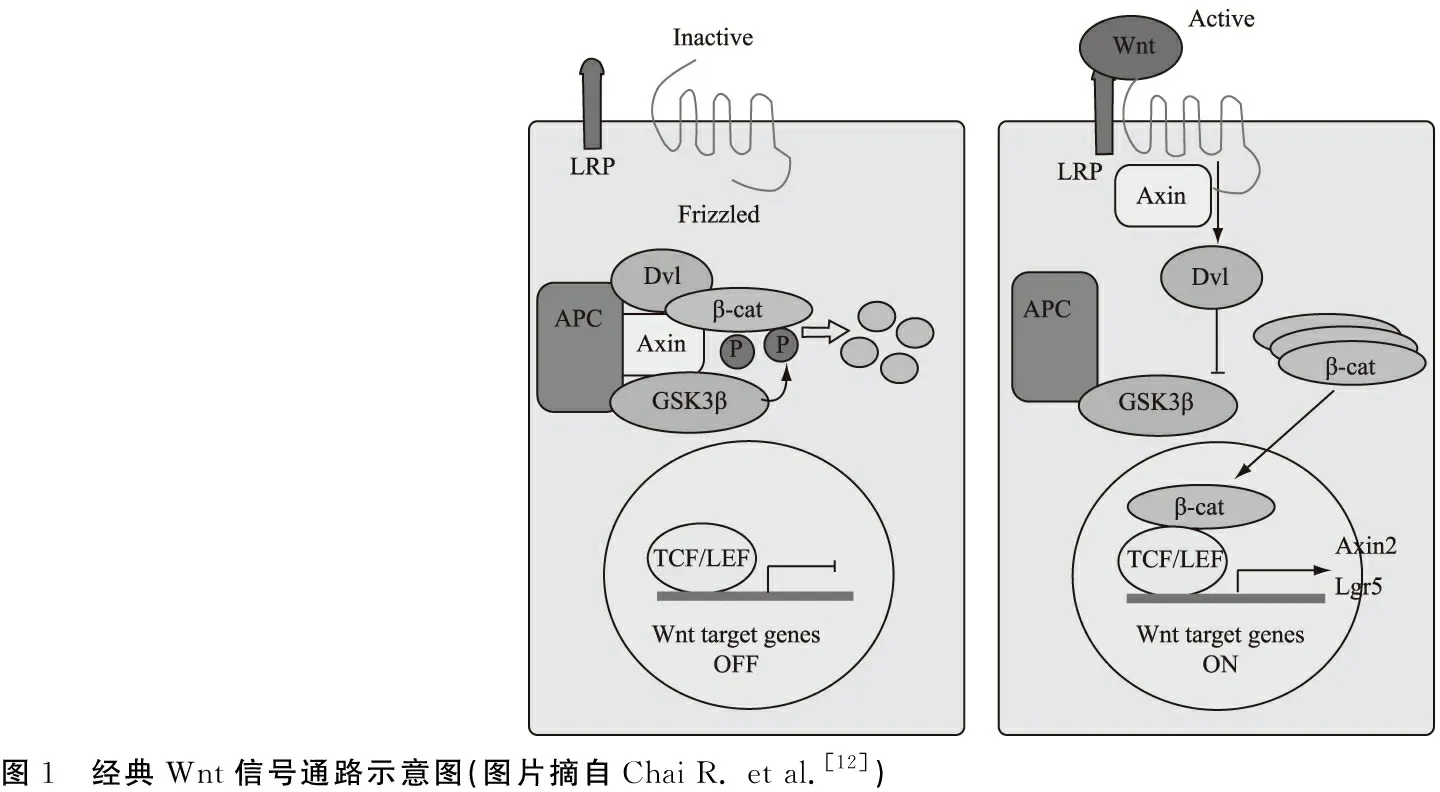
图1 经典Wnt信号通路示意图(图片摘自Chai R. et al.[12])
Notch信号通路在内耳中具有横向诱导和横向抑制的作用,横向诱导是在相邻感觉前体细胞Notch信号受体和配体形成中正反馈环路。在毛细胞和支持细胞分化的早期横向诱导起主要作用,而在毛细胞和支持细胞分化晚期则是横向抑制起主要作用[27]。成年鼠中Notch信号能抑制感觉前体细胞分化为毛细胞,但是在内耳损伤后,该信号通路可再次被激活而具有促进毛细胞再生的潜在能力;如:在噪声引起毛细胞损伤的动物模型中,γ-分泌抑制剂(3,5-二氟苯乙酰基)-L-丙氨酰基-L-2苯基甘氨酸叔丁酯(DAPT)能抑制Notch信号通路引起Atoh1的转录上调而触发毛细胞的再生;在成年鼠中,耳毒性药物耳蜗损伤后可引起Notch信号通路的活化[28~30]。
Wnt信号通路可以正向调节Notch信号通路中Jagged1、 Notch1和Hes1的表达[10, 31]。Wnt信号和Notch信号通路在耳蜗发育中相互影响激活Wnt信号通路,联合使用γ-分泌抑制剂DAPT能诱导耳蜗感觉前体细胞分化成毛细胞。Wnt和Notch信号在耳蜗发育中的相互影响的具体机制还需进一步的研究[32]。

图2 Notch信号通路在内耳毛细胞再生中的调控机制(图片摘自Waqas Muhammad, et al[6])
2.3与内耳毛细胞再生的细胞周期调控有关的细胞因子 细胞周期调控蛋白在哺乳动物内耳发育过程中发挥了重要作用,主要与内耳感觉前体细胞的产生、增殖并分化为毛细胞的调控过程有关。这些细胞周期调控因子包括正性调控因子和抑制因子,两者相互协调共同调控毛细胞的产生、分化和成熟。细胞周期正性调控因子有cyclinD1、cyclinA2、Skp2,细胞周期抑制因子包括:Rb的上游分子(如:p27Kip1、p57Kip2、p19Ink4d和p21Cip1);Rb蛋白(如:Rb、p107和p130);Rb下游分子(如:E2Fs)[33, 34];其中Rb蛋白在促进耳蜗前体细胞退出细胞周期方面起到关键作用[35]。在鼠E13.5的ZNPC区域,前体细胞可分化成毛细胞或支持细胞[36],而在Rb基因敲除的野生型胚胎鼠中,E10.5的ZNPC区域(zone of nonproliferating cells非增殖区域)仍包含BrdU(+)的细胞,前体细胞池增殖扩大,内耳前体细胞不能退出细胞周期,进一步分化成多余的毛细胞和支持细胞[33,35, 36]。另外,Rb蛋白可直接或间接参与细胞分化期间基因表达的调控,R6基因是保持毛细胞有丝分裂后状态的关键因子。目前为止,对于调控P27转录的上游分子尚不清楚,可能与Notch1、Sox2和Jag1的调控有关[37]。
3 结语
综上所述,在内耳发育的过程中,Wnt、Notch信号等通路及与细胞周期调控有关的细胞因子在调控支持细胞和毛细胞的分化和发育过程中起到非常重要的作用。虽然内耳感觉前体细胞在体外可以诱导分化为毛细胞,但是新生的毛细胞是否具有体内毛细胞的功能和特性还需要进一步的研究。Zhang[8]和Zhai等[38]分别从新生小鼠LER和GER区域分离得到内耳感觉前体细胞,并将其与椭圆囊间充质细胞共培养,发现共培养可以明显提高内耳感觉前体细胞分化为毛细胞的比例。内耳干细胞所处的微环境以及与邻近细胞的相互作用对于内耳干细胞、感觉前体细胞诱导分化为成熟的内耳毛细胞至关重要。但是到目前内为止,内耳干细胞、感觉前体细胞分化为毛细胞的效率较低。因此,未来的研究应该致力于建立高效安全的诱导体系,诱导形成成熟并具有功能的毛细胞。此外各信号通路及细胞调控因子之间是如何进行分工及精确调控的复杂网络关系还需要进一步的深入研究。
