内镜手术治疗高血压脑出血合并脑疝患者的疗效和安全性探讨
2018-09-20
(解放军第175医院暨厦门大学附属东南医院 神经外科,福建 漳州 363000)
高血压脑出血合并脑疝患者常需要清除血肿并去骨瓣减压[1],而临床工作中发现大部分单侧瞳孔散大的脑疝患者,如果能早期手术清除血肿,去骨瓣后观察骨窗张力并不高,继发大面积脑梗死亦不多见。故本研究对部分高血压脑出血合并一侧瞳孔散大的脑疝早期患者实施内镜微创清除血肿,并保留了骨瓣,避免了二期手术修补颅骨缺损的风险及费用,取得了良好效果。现报道如下:
1 资料与方法
1.1 一般资料
收集2015年1月-2017年6月我科收治的高血压脑出血患者。入选标准:①所有病例均经CT证实为幕上出血;②临床查体均伴一侧瞳孔散大;③急性发病,入院后均行急诊手术;④随访3个月以上资料齐全者。排除标准:①术前行床边CT血管造影(CT angiography,CTA)明确动静脉畸形、动脉瘤、烟雾病;②合并严重心肺疾病、糖尿病、肾功能不全及凝血功能异常等;③随访资料不齐全者。共收集到病例54例。其中,内镜手术组23例,男16例,女7例,年龄42~82岁,平均62.1岁,术前格拉斯哥昏迷评分法(Glasgow coma scale,GCS)评分4分6例,5分14例,6分2例,7分1例。基底节区血肿19例,颞叶血肿2例,额顶血肿1例,顶枕血肿1例。血肿量(多田公式计算)(82.3±26.6)ml,发病至手术时间4~8 h,平均5.9 h。术后再出血2例,1例保守治疗,1例予锥颅穿刺引流血肿。大面积脑梗死1例,予去骨瓣减压。术后3个月格拉斯哥预后评分(Glasgow outcome scale,GOS)恢复良好2例,轻度残疾10例,重度残疾7例,植物生存3例,死亡1例。开颅手术组31例,男21例,女10例,年龄35~79岁,平均58.6岁,术前GCS评分4分8例,5分15例,6分5例,7分3例,基底节区血肿24例,颞叶血肿5例,额顶血肿2例,血肿量(多田公式计算)(81.5±29.2)ml,发病至手术时间4~9 h,平均5.7 h,术后再出血4例,2例再次开颅清除血肿,1例予锥颅穿刺引流血肿,1例放弃治疗自动出院。大面积脑梗死3例,1例保守治疗,1例行内减压,1例放弃治疗自动出院。术后3个月GOS评分,恢复良好3例,轻度残疾7例,重度残疾13例,植物生存6例,死亡2例。两组年龄、性别、出血量、术前GCS评分、接受手术时间差异均无统计学意义(P>0.05),具有可行性。见表 1。
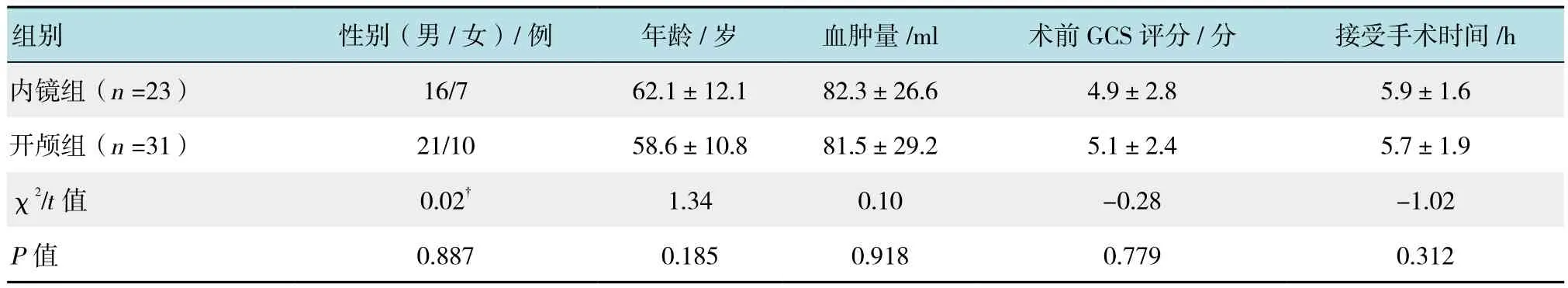
表1 两组患者一般特征比较Table 1 Comparison of basic characteristics between the two groups
1.2 手术方法
所有病例均急诊手术,全麻下进行。术后均3 h内常规复查床边头颅CT。术后均予常规治疗并早期康复治疗。
1.2.1 神经内镜微创手术 设备采用Storz公司或国产的30°硬镜及配套录像设备。术前常规床边CT定位血肿最厚层面及距离体表最近穿刺点,尽量避开功能区。以穿刺点为中心做一直切口长约3.5~4.5 cm。根据血肿量大小,钻孔或铣出直径2.0~2.5 cm圆形骨窗。悬吊后敞开硬膜,电凝皮层,以自制透明内镜通道在内镜监视下穿刺皮层,到达血肿腔后在内镜直视下清除血肿。如有明显的出血点以单极电凝配合吸引器止血。血肿腔壁少许渗血可使用止血纱、明胶海绵或流体明胶止血。如血肿破入脑室术后血肿腔留置引流管(术后复查头颅CT无出血,3 d内拔除),否则无需留置引流管。退出通道并复位骨瓣或用盖孔板修补骨缺损。严密关颅。手术具体过程见图1,典型病例术前CT影像见图2。
1.2.2 开颅血肿清除术 采用显微镜骨瓣开颅。常规行马蹄形切口,铣刀形成骨瓣。敞开硬膜后沿脑沟回方向电凝皮层,脑压板分开皮层至血肿腔,显微镜下清除血肿并彻底止血。如血肿破入脑室,术后血肿腔留置引流管(术后复查头颅CT无出血,3 d内拔除),去除骨瓣,皮下留置引流管,常规关颅。
1.3 安全性指标
记录手术时间、术中出血量、血肿残留率(术后残留血肿/术前血肿)、术后再出血和继发大面积脑梗死等情况。预后指标为术后3个月GOS评分:恢复良好5分,轻度残疾4分,重度残疾3分,植物生存2分,死亡1分。
1.4 统计学方法
采用SPSS 20.0统计软件进行分析,计量资料以均数±标准差(±s)表示,行t检验,计数资料用χ2检验,以P<0.05为差异有统计学意义。

图1 小骨窗通道辅助下内镜清除高血压脑出血的手术过程Fig.1 Surgical procedures in neuroendoscopy-assisted hematoma-evacuation surgery through a small cranial defect and a transparent channel in patient with hypertensive cerebral hemorrhage
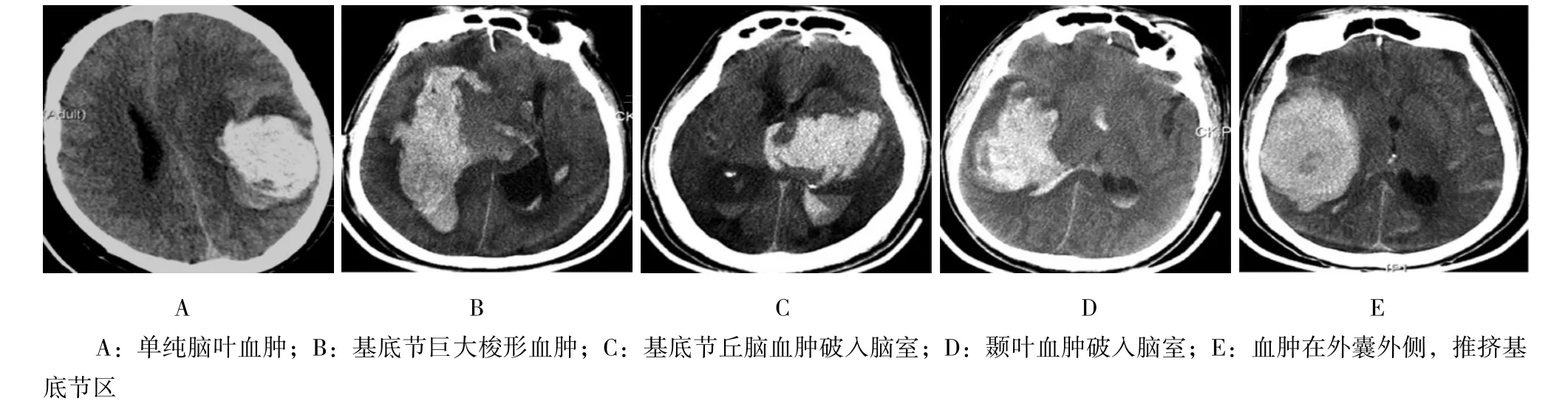
图2 内镜清除高血压脑出血典型病例术前CT影像Fig.2 The preoperative CT images of representative patients who underwent neuroendoscopy-assisted hematoma-evacuation surgery because of hypertensive cerebral hemorrhage
2 结果
2.1 两组手术相关指标比较
手术时间内镜组短于开颅组、术中出血量内镜组少于开颅组,差异有统计学意义(P=0.000)。血肿残留率内镜组低于开颅组,但差异无统计学意义(P=0.655),术后再出血、大面积脑梗死发生率两组比较差异无统计学意义。术后继发大面积脑梗死的发生率均不高(开颅组3例9.7%,内镜组1例4.3%),见表2。内镜清除高血压脑出血典型病例术后CT影像见图3。
2.2 两组术后3个月的GOS评分比较
两组患者术后3个月GOS预后评分差异无统计学意义(P>0.05)。内镜组植物生存率(13.04%)和重残率(30.43%)较开颅组植物生存率(19.35%)和重残率(41.94%)有所降低,但差异无统计学意义(P>0.05)。内镜组轻度残疾率(43.48%)较开颅组(22.58%)有增加,但差异无统计学意义(P>0.05)。内镜组随访死亡1例为出院后肺部感染死亡。开颅组死亡2例,1例再出血,1例继发大面积脑梗死,均为放弃治疗出院后死亡。见表3。

表2 两组手术相关指标比较Table 2 Comparisons of the related operation index between the two groups
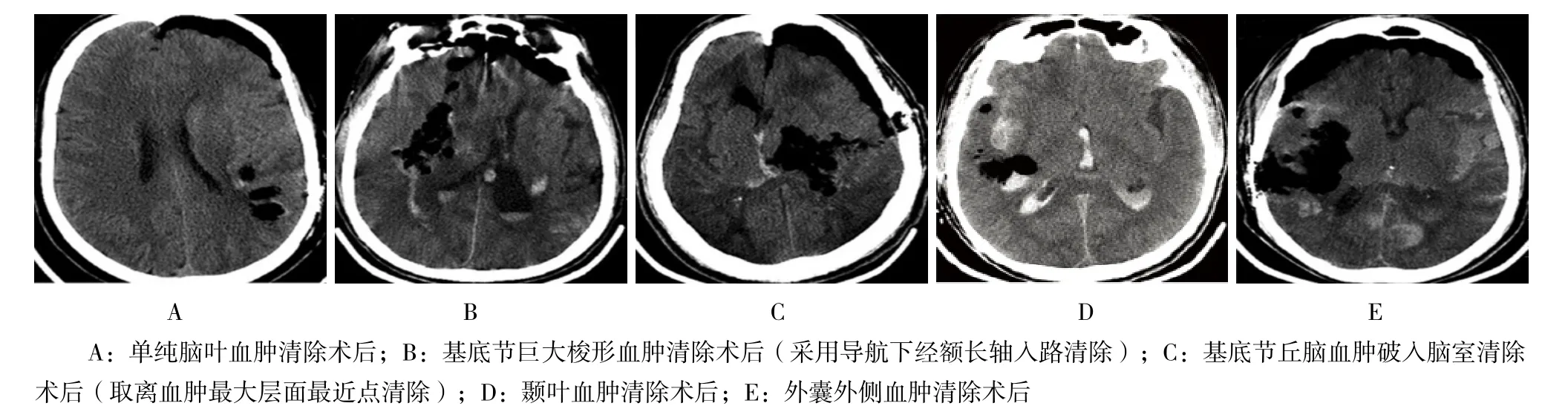
图3 内镜清除高血压脑出血典型病例术后CT影像Fig.3 The postoperative CT images of representative patients who underwent neuroendoscopy-assisted hematomaevacuation surgery because of hypertensive cerebral hemorrhage
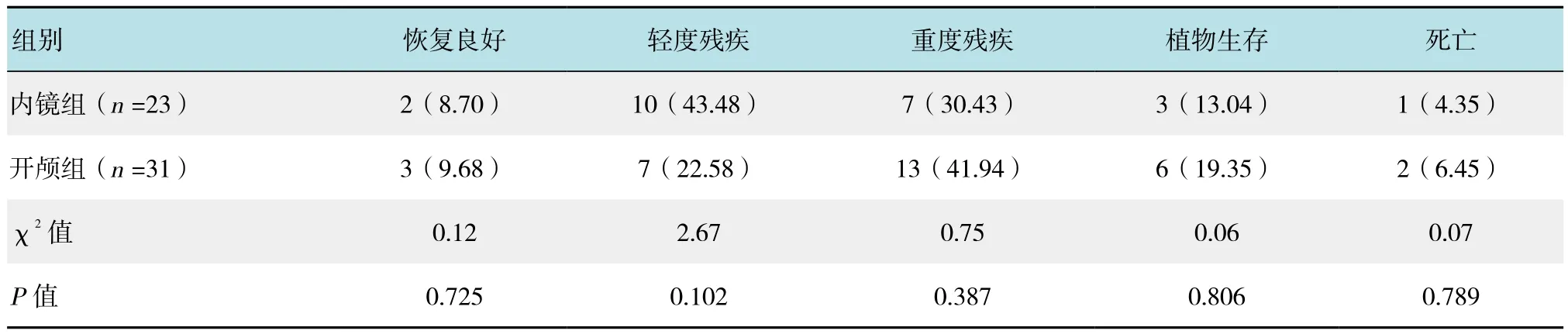
表3 两组术后3个月的GOS评分比较 例(%)Table 3 Comparison of the GOS score 3 months after operation between the two groups n(%)
3 讨论
引起脑出血的病因很多,但大多数是高血压病伴发的脑小动脉病变在血压骤升时破裂所致,故称高血压脑出血[2]。目前国内外对高血压脑出血的治疗仍有很多争议,特别是对大多数幕上的脑出血,手术有效性尚不明确。目前对血肿量少的,多采取保守治疗,也有提倡立体定向下置管引流,注射尿激酶溶解血肿等[3-4]。但对血肿量多,病情进行性恶化,特别是已形成脑疝的患者,为挽救生命,仍需考虑手术治疗。对脑疝患者常规的手术措施为骨瓣开颅,显微镜下清除血肿。因手术创伤相对较大,对脑组织的牵拉造成术后术区严重的水肿,加之可能继发的脑梗死,常需要去骨瓣减压[5]。去骨瓣减压后因骨窗处缺少颅骨的保护,脑组织牵拉摆动,加重软化灶形成,更容易诱发癫痫[6]。而后期需再次修补缺损处,造成二次损伤,也增加了患者经济负担。如能找到一种能够快速清除血肿、达到减压目的,同时损伤又小、术后水肿轻且无需去骨瓣的方法,将大大改善患者预后,减轻负担。
神经内镜技术具有创伤小、安全度高、恢复快及花费少等优点,集中体现了微创神经外科的优势[7]。利用神经内镜清除颅内血肿已广泛开展,但大多用于治疗血肿量相对较少、且未形成脑疝的患者。我中心在临床中发现,对单侧瞳孔散大,或双侧瞳孔散大术前锥颅后一侧瞳孔回缩正常的患者,使用显微镜或内镜手术,术后继发大面积脑梗死的发生率均不高(开颅组3例9.7%,内镜组1例4.3%)。内镜组大面积脑梗死仅1例,予二次手术去骨瓣减压,没有病例因为术后脑水肿严重再次手术去骨瓣。从预后看,可以看出植物生存率、重残率略有减少,而轻残率增加了。本研究尚有不足,因为样本量的问题,对出血部位未进一步细分。因为出血部位的不同对预后的影响也很大,特别是基底节区血肿是否累及丘脑、是否破入脑室等影响很大。在以后更大样本的研究中,内镜手术患者的预后是否获益将得到进一步明确。目前虽受限于样本量小,但至少可以看出,采用内镜微创手术保留骨瓣是安全的。笔者认为这种安全性与以下两个方面有关:①减少了脑疝时间:脑疝的救治关键在于尽快清除血肿,解除脑疝,内镜手术从切皮(4.0 cm直切口),开骨瓣(2.0 cm骨瓣),通道造瘘后内镜下吸除血肿,所用时间极短。较常规骨瓣开颅(12.0~16.0 cm切口,4.0 cm×6.0 cm或更大骨瓣),明显缩短了解除脑疝的时间,脑疝时间越短,造成的继发损伤势必更小[8];②手术创伤小:首先出血少,高血压脑出血手术的出血大部分来源于开关颅皮瓣的渗血,骨窗缘渗血,清除血肿本身出血甚少,小骨窗、小切口使出血面减少,手术时间的缩短也减少了出血时间,其次脑组织牵拉损伤小,内镜下清除血肿,利用内镜的优势,可仅仅使用直径1.0 cm的通道造瘘皮层,对皮层的损伤更小,这在显微镜下是难以达到的。而造瘘后,内镜可以直达血肿深部,采用角度镜能更好地观察到四周的血肿,无需太大的摆动通道和牵拉脑组织,血肿清除彻底的同时损伤较小。而显微镜为柱状视野,要暴露深部血肿和四周血肿,因照明需要,势必要更大的牵开皮层,造成的继发损伤也就更重。
内镜下清除血肿也有其难点,特别是止血难度大。笔者临床中发现,高血压脑出血合并脑疝的急诊手术,内镜下吸除血肿后大都能发现责任血管及其他多根断裂的小血管。笔者推测是否与血肿过大、膨胀过程中导致新的血管断裂有关。部分血管断端可有血凝块包括,但大部分在吸除血肿后仍有出血。因内镜通道较小,难以置入双极电凝,故笔者通常采用单极电凝配合吸引器止血,对创面少量的渗血使用流体明胶或明胶海绵止血即可。所有病例止血总体尚可,早期经验不足时有2例再出血病例,其中1例稍多,予再次置管引流后治愈。
笔者自开展高血压脑出血合并脑疝的内镜手术后,仅1例因大面积脑梗死行去骨瓣减压。但仍特别强调,对此类患者,术后需密切监测生命体征,应用颅内压监测、动态复查头颅CT等。如术后继发大面积脑梗死或者严重的脑水肿,有手术指征时需要二次去骨瓣减压。
随着内镜设备及内镜技术的发展、人们对脑出血疾病的认识,以及自身经验的积累,笔者认为使用神经内镜治疗脑出血合并脑疝将为患者带来更好的预后,减轻经济负担。
