内镜隧道剥离术在结直肠病变中的临床应用
2018-09-20
(武汉大学人民医院 消化内科,湖北 武汉 430060)
内镜黏膜下剥离术(endoscopic submucosal dissection,ESD)已成为治疗直径大于2.0 cm、没有淋巴结转移的结直肠局部病变的主要方法,它具有能一次性完整切除病灶,且复发率较低的特点[1]。但ESD对操作医师的技术要求非常高,特别是在结直肠行ESD治疗,术中出血、穿孔等并发症的发生率较高。近年来,随着内镜技术的飞速发展和不断创新,隧道内镜技术经过10年的发展创新,其适应证在不断扩大,除胃肠道黏膜下肿瘤外,黏膜层病变也纳入隧道内镜适应证范畴[2]。本研究通过分析17例经ESD或内镜隧道剥离术治疗的结直肠病变且直径大于2.0 cm的患者资料,探究内镜隧道剥离术治疗结直肠病变的有效性及安全性。
1 资料与方法
1.1 一般资料
回顾性分析2017年4月-2017年6月在本院消化内镜中心行ESD或内镜隧道剥离术治疗的结直肠病变患者17例。隧道组8例,其中男3例,女5例,年龄42~78岁,平均54.2岁。病灶最长径2.5~6.5 cm,平均(3.8±0.9)cm。ESD组9例,其中男5例,女4例,年龄44~73岁,平均55.7岁。病灶最长径2.4~6.0 cm,平均(3.5±0.7)cm。
两组患者性别、年龄、病变直径差异均无统计学意义(P>0.05),具有可比性。隧道组与ESD组病灶大小分别为(3.8±0.9)和(3.5±0.7)cm2,其中隧道组最大病灶6.5 cm×4.0 cm,ESD组最大病灶6.0 cm×3.8 cm。隧道组中,直肠5例,所占比例最高(5/8,62.5%),其次依次为乙状结肠1例,横结肠脾曲和盲肠各1例。ESD组中,直肠5例(5/9,55.6%),乙状结肠1例,降结肠1例,横结肠2例。两组病灶分布部位、病灶个数(均为单发)、大小及位置比较,组间差异均无统计学意义(P>0.05)。
所有患者术前均告知手术和麻醉的风险及可能获益,并签署相关知情同意书。术前肠道准备采用和爽(聚乙二醇电解质)3包溶于3 000 ml温水口服,至排清水样便。
1.2 纳入及排除标准
1.2.1 纳入标准 直径>2.0 cm的非颗粒型侧向发育型肿瘤(terally spreading tumor,LST),直径>3.0 cm的颗粒型侧向发育型肿瘤,直径>2.0 cm的0~Ⅱc病变,非抬举征阳性的黏膜内肿瘤,常规内镜下黏膜切除术(endoscopic mucosal resection,EMR)难以完整切除的无蒂病变[3]。
1.2.2 排除标准 术前检查发现已经侵及黏膜下层深部的肿瘤、炎症性肠病和家族性腺瘤性息肉,存在凝血功能障碍者,合并严重系统疾病不能耐受ESD术者,内镜超声或CT提示存在淋巴结转移病灶患者[3]。
1.3 器械
Fujinon EPX 4400主机和Fujinon E-590 ZW/M型放大变焦公司肠镜(日本富士能公司),ERBE ICC-200高频电切装置(德国爱尔博电子医疗仪器公司),FDIU-1热活检钳(日本奥林巴斯公司),NM-4L-1注射针(日本奥林巴斯公司),D-201-11804透明帽(日本奥林巴斯公司),Dual刀(日本富士能公司),止血钳,钛夹,CO2气泵,注水泵,0.2%靛胭脂染色剂、一次性圈套器及和谐夹(南京微创医学科技有限公司)。
1.4 手术方法
肠镜发现病灶后,用灭菌水及西甲硅油冲洗病灶表面黏液及消除气泡,用染色放大肠镜再次观察病灶,确定病灶范围和深度:应用氩离子束凝固术(argon plasma coagulation,APC)于病灶边缘0.5~1.0 cm进行电凝标记,沿标记点外缘在病变黏膜下注射1∶100 000生理盐水+肾上腺素靛胭脂+甘油果糖,每点约2 ml,可以重复注射直至病灶明显抬起。ESD组使用传统ESD法切除病灶,具体方法如下:用Dual刀沿病灶边缘标记点切开病灶外侧缘黏膜,再用Dual刀将病灶从黏膜下层进行剥离,完全切除病变后,采用热活检钳、APC和金属夹等手段处理裸露的血管和溃疡创面。术中穿孔以钛夹成功夹闭,腹腔内气体自行吸收。隧道组采用内镜隧道剥离术切除病灶(图1),具体方法:黏膜下注射后不先行环病灶外侧缘黏膜切开,而是用Dual刀分别在病变口侧和肛侧行弧形切开,再从肛侧切口剥离黏膜下层,建立黏膜下隧道,逐步剥离黏膜下层直至与口侧切口会师,最后用Dual刀切开病灶左右两侧的黏膜完整切除病变。

图1 内镜隧道剥离术治疗直肠隆起病变Fig 1. Submucosal tunneling endoscopic resection for rectal apophysis lesions
1.5 病理组织学检查
术后将标本平铺于泡沫板上,自然伸展以大头针固定,测量病灶大小,置入福尔马林中送检,病理医师以2 mm间隔连续平行切片,经HE染色,观察病灶切缘及基底是否有肿瘤累及,观察血管及脉管是否有浸润。①整块切除:定义为病灶被一次性单块完整切除;②治愈性切除:切除的标本侧切缘和垂直切缘阴性;未发现淋巴结及血管侵犯或低分化成分。
1.6 术后处理
患者术后取45°半卧位,禁食1或2 d,常规给予止血、补液等治疗,术中穿孔患者预防应用抗生素。之后开始进食流质饮食,如无并发症,可逐渐恢复正常饮食。同时注意观察患者排便情况及腹部体征,注意询问患者有无腹痛、腹胀等不适,必要时可复查胸片及腹部平片,观察有无纵隔气肿、后腹膜气肿和膈下游离气体等。对于心肺功能不好的患者,给予吸氧及心电监护。
1.7 统计学方法
采用SPSS 16.0软件分析,计量资料用均数±标准差(±s)表示,采用t检验,计数资料用样本数、构成比和百分率表示,比较采用χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗情况比较
本研究中所有病灶均为整块切除。隧道组与ESD组比较,迟发性出血发生率分别是0.0%和11.1%(1/9),术后感染率分别为12.5%(1/8)和11.1%(1/9);术中穿孔发生率分别为0.0%和22.2%(2/9);中位住院时间分别为10 d和12 d;以上组间差异均无统计学意义(P>0.05)。隧道组手术时间为24~60 min,平均(45.0±15.0)min,ESD组为34~90 min,平均(67.0±17.0)min(P=0.015);术中出血发生率分别为12.5%(1/8)和66.7%(6/9)(P=0.024);以上两组间差异有统计学意义(P<0.05),见附表。两组术后均无迟发性穿孔。两组术中出血患者均经内镜成功止血,ESD组1例术后迟发性出血患者经内镜下止血钳热凝成功止血,予钛夹钳夹预防再出血。ESD组2例术中穿孔经内镜下钛夹成功夹闭,气体自行吸收。术后感染的病例经积极抗感染治疗后控制感染。
2.2 术后病理学检查
所有病变均为治愈性切除。隧道组与ESD组比较,绒毛状腺瘤分别为4和5个;管状腺瘤分别为4和6个;增生性息肉分别为1和1个;伴高级别上皮内瘤变分别为3和4个;伴低级别上皮内瘤变分别为3和5个;合并2种以上者分别为6和6个;组间差异均无统计学意义(P>0.05)。1例内镜隧道剥离术治疗直肠隆起病变术后病理为管状腺瘤伴低级别上皮内瘤变,部分区域呈高级别上皮内瘤变。见图2。
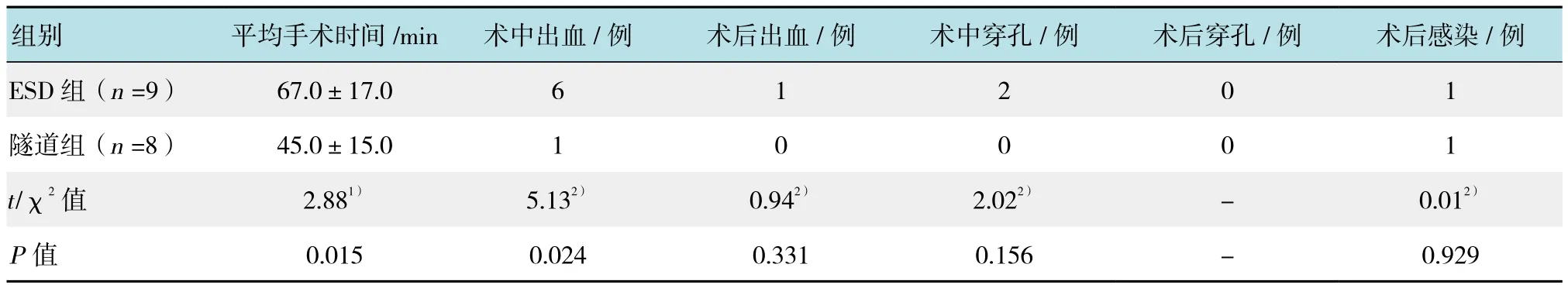
附表 两组患者术中术后情况比较Attached table Comparison of intraoperative and postoperative conditions between the two groups
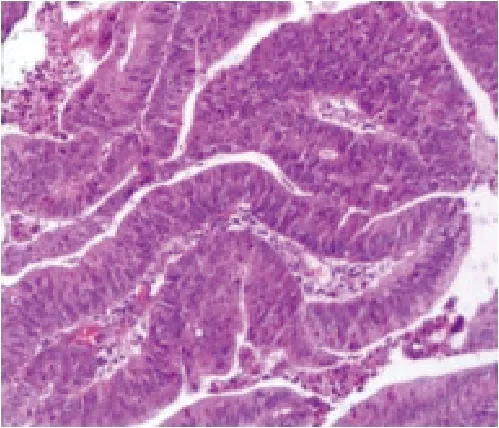
图2 病理学检查 (HE ×40)Fig.2 Pathological examination (HE ×40)
2.3 随访结果
所有病例纳入随访,目前无病例失访。术后1个月结肠镜复查均未发现病灶残留或复发,组间差异无统计学意义(P>0.05)。术后6个月再次随访,内镜复查术后愈合佳,无残留及复发。
3 讨论
随着内镜操作技术和器械的不断发展,ESD已成为治疗没有淋巴结转移的结直肠病变的一种安全、有效的内镜微创手段。ESD治疗具有如下特点[4]:①可以切除较大病变,病变直径一般大于2.0 cm,大于4.0 cm巨大病变也能切除;②能一次性切除病变,避免分次EMR带来的病变复发;③对切除的完整病变标本进行科学的病理学检查,指导下步诊疗方案制定;④治疗消化道早癌和黏膜下肿瘤,既能保证病变彻底切除,又能最大限度地保证正常结直肠组织及其功能,患者易于接受;⑤创伤小,恢复快,充分体现微创治疗的优越性。
ESD技术难度较大,尤其是结直肠ESD,一方面是由于大肠的解剖学特征决定,例如肠壁薄、蠕动多、皱襞成角以及肠腔操作空间较小等[5];另一方面随着剥离的进行,病灶逐步回缩,已剥离的病灶边缘容易内翻,造成手术视野不清,增加操作难度[6]。特别是对于ESD操作经验尚不丰富的初学者在操作过程中往往不得不放弃而改行EMR分次切除。如何在术中取得良好手术视野,实现安全、精确切割和剥离操作的方法,是解决上述难题的关键。这一方面需要掌握不同结直肠部位的ESD操作技巧,另一方面可以运用一些辅助技术,如内镜辅助牵引技术;或在原有ESD技术基础上发展创新,如隧道内镜技术[2]。
隧道内镜技术是近10年来在原有经自然腔道内镜手术(natural orifice transluminal endoscopic surgery,NOTES)和ESD基础上发展创新的新兴内镜治疗技术之一。该技术的创意来源于腹水时腹腔穿刺的“Z”字进针法,即巧妙利用消化道管壁天然层次将隧道进出切口错开,充分保证整个消化道管壁的完整性。不仅缩小了创面,降低了内镜下缝合的技术要求,同时也减少了胃肠道穿孔的发生概率[7]。2008年最初应用于经口内镜下肌切开术治疗食管贲门失弛缓症,随着研究的开展和深入,适应证逐渐扩大至治疗黏膜下肿物,乃至消化道黏膜层病变的切除,如食管、胃体小弯和直肠等[2]。
本研究中所采用的内镜隧道剥离术,又被称为“黏膜桥”技术[8],是在隧道技术基础上演变而来,与经黏膜下隧道内镜切除术最大的不同是先在病变的口侧端行弧形切开黏膜,然后从病变的肛侧端开始建立隧道剥离病灶直至与口侧切口相通,最后切开病灶左右两侧的黏膜完整切除病变。笔者发现此隧道内镜技术治疗结直肠病变有如下优点:①在隧道内,可以清晰地观察黏膜下层结构,手术视野好,除了可以避免隧道剥离过程中盲目前进导致的过度剥离,还便于观察黏膜下血管,减少术中出血。因为手术视野清晰,在剥离过程中发现的较小黏膜下层血管,可以应用Dual刀头端直接电凝;而对于较粗的黏膜下层血管,用热活检钳钳夹血管后提起热活检钳,使活检钳远离肠壁再电凝血管。本研究中,两组患者术中出血率比较,隧道组12.5%(1/8)明显低于ESD组66.7%(6/9);②在隧道内进行剥离时,由于透明帽支撑分离作用,Dual刀的剥离始终朝着一个与固有肌层平行方向前进,减少肌层受损伤的风险,而传统ESD法是从病变边缘开始向中央进行逐步剥离,刀头的方向需要不断变化调整,难度较高,一刀不慎容易误伤肌层,因为肠壁菲薄,穿孔的概率较高。本研究中,ESD治疗组的术中穿孔率22.2%(2/9),而隧道组的术中穿孔率为0.0%,虽然两组样本量少,但此差异有一定的指导意义;③病灶大小≥5.0 cm,病变超过2个肠袢皱襞和结肠弯曲部是影响ESD手术成功率的另外两个重要因素[9]。传统ESD治疗时,随着手术的进行,病灶逐步回缩,且病灶边缘容易内翻,造成手术视野不清,需反复行黏膜下注射后剥离,且病变越大、病变位于结肠弯曲部,手术难度越大,耗时越长。而行隧道剥离时,由于病变四周并未切开,病变本身的张力存在,不仅不会出现病变回缩,而且剥离的空间增大,受病变大小和病变位置的影响不大,手术难度和时间并没有成倍的增加。本研究中隧道组和ESD组各有2例≥5.0 cm,平均手术时间分别是62和83 min,隧道组短于ESD组。而总的平均手术时间,隧道组为(45.0±15.0)min,明显短于ESD组的(67.0±17.0)min。
内镜隧道剥离术治疗结直肠病变的术后并发症同传统ESD治疗,主要是疼痛、出血和穿孔[10]。术后疼痛程度较轻,一般无需特别处理。出血、穿孔是最常见的并发症。出血多发生在术中或术后24 h内[4]。本组资料中,隧道组没有术后出血,而ESD组有1例,经内镜下电凝治疗联合金属夹进行夹闭处理,成功止血。穿孔一般在术中均可发现,极少数术后发生,使用金属夹及时闭合,术后禁食禁水,肠外营养治疗后多数可愈合,个别需外科手术治疗。本研究中,两组患者均未出现迟发性穿孔,这些证据有利于内镜隧道剥离术的开展应用。经过本研究,笔者总结初步经验如下:①虽然剥离时手术视野清晰,但在剥离过程中,动作要轻柔,不可用透明帽盲目或暴力推镜,避免黏膜撕裂,造成不必要的穿孔;②隧道内空间相对狭小,应减少电凝时间,避免损伤肌层。若发生术中穿孔,用钛夹封闭,继续剥离时要小心绕开钛夹,避免再次损伤;③做好术中出血的预判,因手术视野清晰,应谋定而后动,术中及时电凝裸露血管,及时进行创面的冲洗。若术中出血,因空间固定,可先行透明帽压迫止血,充分冲洗创面,清楚出血部位后再行电凝止血;④在完成隧道内剥离后,最后切开两侧病变黏膜时,应利用病灶本身重力,先选择切开重力低位的黏膜侧,且避免一次完全切开,而是两边对称进行,利用其牵拉作用避免病灶回缩,最后一起切断重力高位的保留黏膜;⑤对于部分病灶,不必完全完成隧道内剥离后方才行两侧病变黏膜切除,以节省时间;⑥重视术后创面处理,减少术后出血风险。
随着医学的发展,疾病微创治疗成为趋势,ESD已成为治疗结直肠病变的重要微创手段。但ESD手术难度大,风险相对较高,积极寻找更加安全有效的ESD手术方法是临床内镜医师孜孜以求的奋斗目标。本研究提示内镜隧道剥离术治疗结直肠病变与传统ESD相比,能缩短手术时间,降低术中出血及穿孔等并发症,是一项安全有效的治疗手段。但由于此次研究的样本量相对较少,有些可能影响内镜隧道剥离术治疗的因素如黏膜下纤维化程度和结肠反常运动等未纳入,而且是回顾性、单中心的研究,随访时间较短。因此,普遍性受到制约。需纳入更多的人群,由更多的内镜医师完成多中心研究,以充分评估隧道内镜技术治疗结直肠病变的应用价值。
