枯草芽孢杆菌对草鱼生长性能、肠道消化酶及 抗氧化酶活性的影响
2018-09-18鞠守勇李金山
鞠守勇,李金山
(1.武汉职业技术学院生物工程学院,武汉 430074; 2.华中农业大学农业微生物学国家重点实验室,武汉 430070)
近年来,我国渔业养殖规模不断扩大,产量不断增加,原有的粗放型养殖模式逐渐被集约化的养殖模式代替,单位面积产量增加迅速[1]。养殖过程中残饵量、动物残骸和和鱼体排泄物逐渐增加,水体中大量滋生有害细菌、病毒等致病微生物,大大增加养殖鱼类患病机率,甚至导致鱼类死亡。为了预防鱼病的发生,在大规模高密度养殖的过程中,往往在饲料中添加抗生素或者在养殖过程中使用一些化学渔药以预防鱼病的爆发。但饲料中长期添加抗生素或长时间滥用化学药物容易引发病原菌耐药性,同时也使抗生素或化学药物残留在鱼体内,造成鱼产品质量不合格,引发食品安全问题[2-3]。
草鱼(Ctenopharyngodonidellus)属鲤形目鲤科雅罗鱼亚科草鱼属[4],其肉质鲜美,生长迅速,饲料来源广,是我国淡水养殖的四大家鱼之一,在我国水产养殖业中占有举足轻重的地位[1]。近几年,随着草鱼大规模高密度养殖技术的推广,草鱼病害问题已严重阻碍了草鱼产业的可持续发展[2-3]。枯草芽孢杆菌(Bacillussubtilis)是当前研究比较清楚的一种益生菌,也是被我国农业部认可的安全的饲料添加剂,在畜禽和水产养殖等领域应用广泛,研究表明饲料中添加一定比例的枯草芽孢芽菌能有效促进各种鱼类生长、提高其免疫及抗病能力[2-3]。本研究分离到一株枯草芽孢杆菌,并探讨饲料中添加该菌株后对草鱼肠道消化酶的影响,以及对草鱼增重率及相对生长速度的影响,为将该菌株开发成为渔用微生态制剂产品奠定基础。
1 材料与方法
1.1 试验材料及试验设计
WTC019菌株分离于湖北省武汉市秸秆堆土壤中,发酵培养至芽孢期用于本研究。LB培养基组成为:蛋白胨10 g/L,酵母浸出液5 g/L,NaCl 10 g/L, pH 7.0~7.2,121 ℃灭菌处理30 min。固态培养基:液态培养基中添加2%琼脂,121 ℃灭菌处理30 min。
试验用草鱼购买自华中农业大学水产养殖基地,挑选规格整齐、体质健壮的草鱼约480尾,随机分成4组,其中A组为基础饲料对照组,B、C、D组为试验组,在饲料加工过程中,分别添加WTC019至芽孢数目为1×106CFU/g(B组)、1×107CFU/g(C组)、1×108CFU/g(D组),每组3个重复,每个重复40尾草鱼。每组设3个平行,共12个水族箱(高60 cm,直径80 cm),每个水族箱放养40 尾草鱼,个体初始重量(146.23±14.56)g。
1.2 菌株分离方法
称取少量的秸秆堆下方土壤放入含有醋酸钾终浓度为0.3 mol/L的50 mL LB液体培养基,震荡充分混匀,75 ℃处理10 min,离心取上清液,稀释到10-6涂布于LB固体培养基上,37 ℃培养,24 h复红染色观察营养体,培养60 h染色用油镜观察芽孢情况。
1.3 菌株鉴定
按照文献[5]方法,用枯草芽孢芽孢杆菌标准菌株Bacillussubtilis(Ehrenberg)Cohn (ATCC®23857TM,168)做对照对WTC019菌株进行生理生化鉴定;用WTC019菌株的基因组DNA为模板,引物为27F(AGAGTTTGATCCTGGCTCAG)和1492R(TACGYTACCTTGTTACGACT)扩增16S rRNA基因并测序,用 MEGA软件构建该菌株的系统进化树[6]。
1.4 试验饲料
基础饲料的组成和主要营养水平见表 1。 基础饲料原料经过粉碎机粉碎后过60 目筛,根据草鱼配合饲料营养标准(SC/T1024-1997)配制基础饲料,原料按照由少到多的比例分步用混合机充分混合均匀后,然后添加蒸馏水300 g/kg,混合均匀后加工成直径2.0 mm左右的颗粒饲料,无菌室晾干,-20 ℃保存备用[4]。
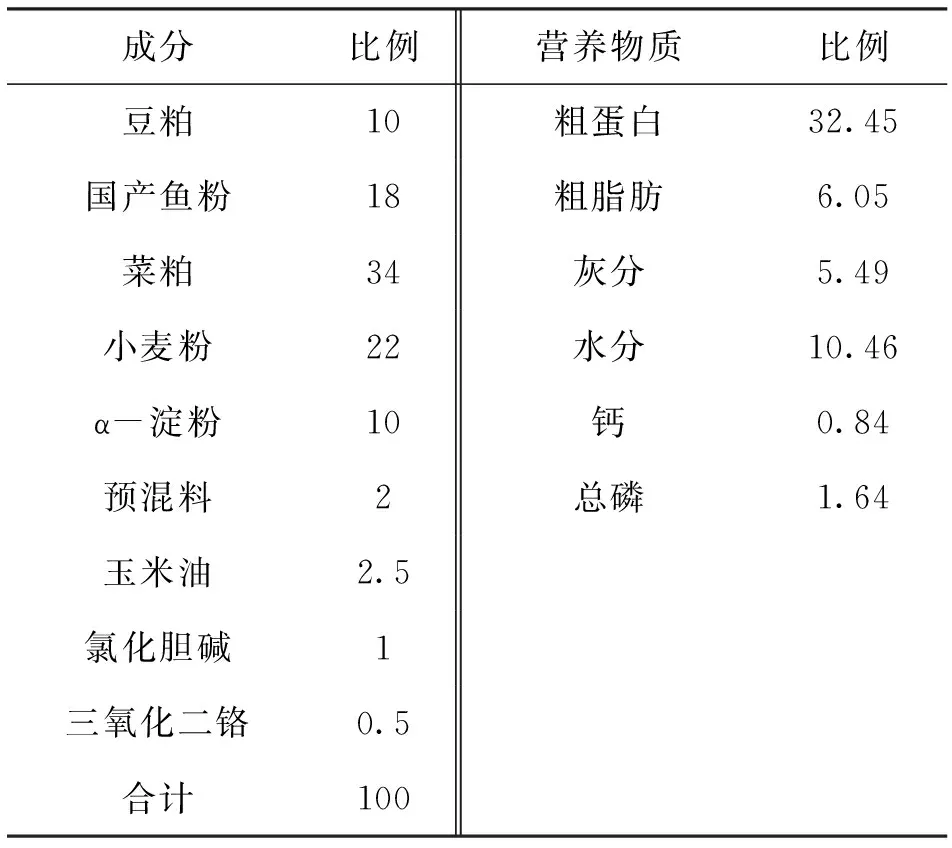
表1 基础饲料组成和营养成分( 风干基础)Tab.1 Composition and nutrient levels of the basal diet ( air-dry basis) %
注:预混料为每千克饲料提供:维生素A 150 000 IU,维生素D 330 000 IU,维生素E 750 mg,维生素B 2 000 mg,维生素K 3 150 mg,铁 2.5 g,铜 0.075 g,锌 0.75 g,锰 0.5 g,镁 5 g,碘22.5 mg,硒 3.5 mg,钴7.5 mg。
1.5 饲养管理
试验鱼饲养于室内配备有微流水和充氧设备的养殖系统(高60 cm,直径80 cm)中,用基础饲料驯食1周,每日按照鱼体重的3%~5%,在8:30 和 16:30 各投喂一次,1 h 后捞取残饵,定期换水30%并去除粪便,水温(25±3)℃,保持溶氧6~8 mg/L,试验周期60 d。
1.6 测定指标与方法
1.6.1 生长性能的测定
养殖试验开始和结束时分别对各池的草鱼进行记数、称重,并计算增重率、特定生长率和存活率。
增重率(WGR)= (mt-m0)/m0×100%;
特定生长率(SGR)= (lnmt-lnm0)/d×100%;
存活率(SR)=nt/n0×100%。
公式中mt为终体重(g),m0为初体重(g),d为养殖天数(d),nt为终末尾数,n0为初始尾数。
1.6.2 消化酶及抗氧化指标的测定
养殖试验结束后,所有试验草鱼饥饿24 h,每组随机捞取10尾麻醉,用无菌注射器尾静脉采血,随后放入4 ℃冰箱,静置12 h,4 ℃条件下4 000 r/min 离心15 min,取上层血清分装,置于-80 ℃超低温冰箱保存,备测过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶、谷胱甘肽。采血完毕的草鱼,在冰块上解剖,剪开前肠段,清洗消化道,用无菌水充分冲洗外表,无菌解剖刀刮取肠内容物,取肠道中间层内容物,放入无菌离心管中,保存于-80 ℃冰箱,备测消化酶活性。过氧化氢酶、超氧化物歧化酶、谷胱甘肽过氧化物酶、谷胱甘肽均使用试剂盒测定,按照试剂盒中的说明书操作。
1.7 数据统计试验数据
用 SPSS19.0软件进行单因素One-way ANOVA方差分析,试验结果以平均值±标准差( Mean±SD)表示,显著水准P=0.05。
2 结果
2.1 菌株形态特征
采用1.2方法,从湖北省武汉市秸秆堆土壤中得到一株细菌WTC019,37 ℃培养3 d后,其菌落不透明,白色近圆形,微隆起,边缘叶状齿状;挑取少量培养12 h的菌体复红染色,菌体呈杆状,长约2.0~4.0 μL,宽约0.7~1.0 μL(图 1 A);培养72 h后复红染色观察到芽孢(图 1 B),初步判定该菌为芽孢杆菌。

图1 100倍显微镜观察WTC019的菌体(A)与芽孢(B)Fig.1 The bacteria and spore in the 100 × microscope
2.2 菌株鉴定
由于该菌来自于秸秆堆土壤中,又具有明显的芽孢形态,推测该菌可能为枯草芽孢杆菌(Bacillussubtilis)。根据经典的生理生化方法[5]对WTC019菌株进行鉴定,用枯草芽孢杆菌标准菌株Bacillussubtilis(Ehrenberg)Cohn (ATCC®23857TM)(又称:Bacillussubtilis168)做对照,表1结果表明WTC019与枯草芽孢杆菌标准菌株Bacillussubtilis(Ehrenberg)Cohn (ATCC®23857TM)的生理生化结果一致;PCR扩增得到菌株WTC019的16S rRNA基因并测序(图2),发现该菌16S rRNA基因与枯草芽孢杆菌100%序列一致,MEGA软件构建该菌株的系统进化树(图3),表明该菌与枯草芽孢芽孢杆菌最接近;16S rRNA基因分析并结合生理生化鉴定证实WTC019为枯草芽孢杆菌。
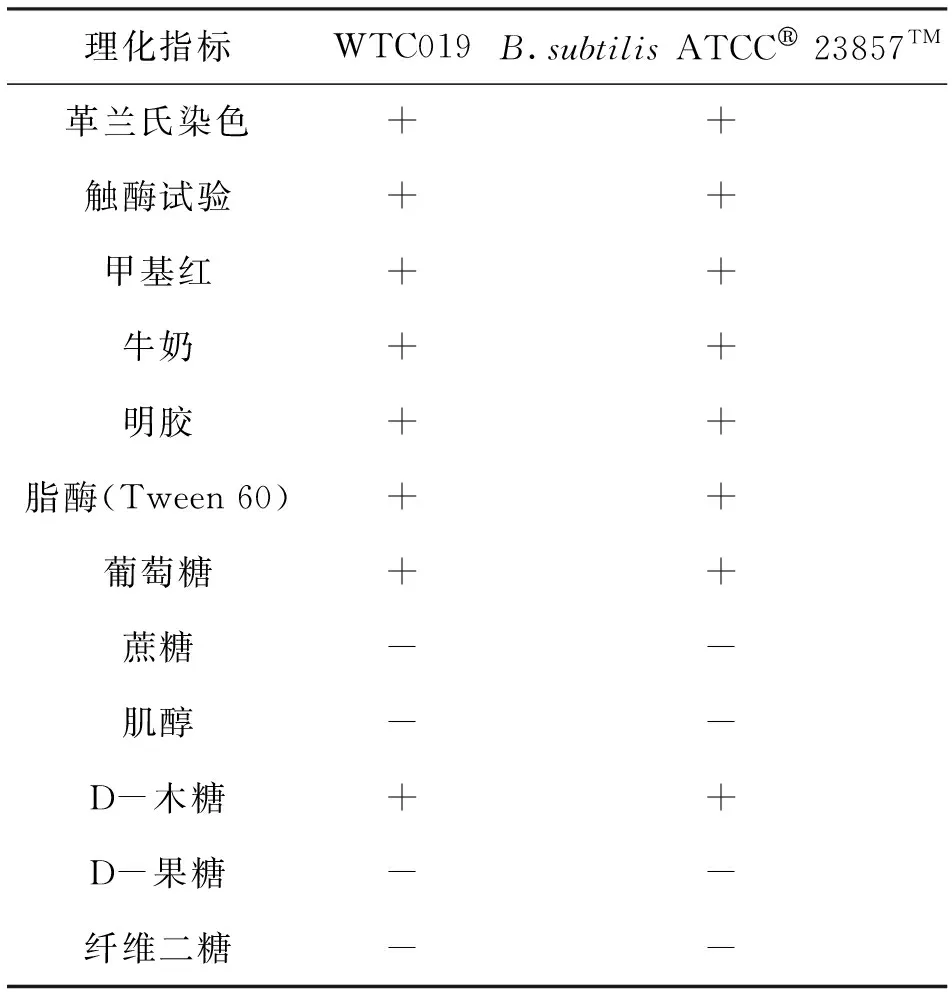
表2 WTC019生理生化鉴定Tab.2 Physiological and biochemical identification of WTC019

续表2
注: “+”表示阳性,“-”表示阴性

图2 琼脂糖电泳检测16S rRNA基因的PCR产物Fig.2 PCR products electrophoresis of 16S rRNA gene (CK:negative control)
2.3 WTC019对草鱼生长的影响
表 2结果表明A组(对照组)增重率为(263.94±12.75)g,试验组B组、C组、D组的增重率分别为(301.37±18.02)%,(286.47±24.08)%,(294.57±20.87)%,与对照组相比分别增加了(37.43±5.27)%,(22.53±11.33)%,(30.63±8.12)% (图4);A组(对照组)特定生长率为(2.14±0.03)%/d,试验组B组、C组、D组的增重率分别为(2.31±0.03)%/d,(2.24±0.06)%/d,(2.27±0.02)%/d,与对照组相比分别增加了(0.17±0.03)%/d,(0.10±0.03)%/d,(0.13±0.02)%/d(图5);对照组与试验组在存活率上无差异。由此可知,试验组草鱼的增重率和特定生长率均显著高于对照组,其中B组的草鱼增重率和特定生长率最高,分别达到(301.37±18.02)%和(2.31±0.03)% /d。

图3 16sRNA进化树分析Fig.3 The phylogenetic tree based on 16S rDNA

表3 枯草芽孢杆菌WTC019对草鱼生长的影响Tab.3 Effects of B.subtilis WTC019 on growth of C.idellus
注:同行数据肩标字母不同表示差异显著(P<0.05)。
2.4 WTC019对草鱼肠道消化酶的影响
由表4可知,A组(对照组)肠道中淀粉酶、脂肪酶、胰蛋白酶的活力分别为(197.42±10.47)、(3.12±00.8)、(1302.75±54.81)U/mg;试验组B组(106CFU/g)肠道中淀粉酶、脂肪酶、胰蛋白酶的活力分别为(340.49±20.12)、(4.55 ±0.11)、(2085 ±70.54)U/mg,与对照组相比分别增加了(72.4±10.19)%、(45.83±3.53)%、(60.04±5.41)%;C组(107CFU/g)肠道中淀粉酶、脂肪酶、胰蛋白酶的活力分别为(428.76±27.48)U/g、(5.10 ±0.07)U/g、(2589 ±49.28)U/mg,与对照组相比分别增加了(117.15±13.92)%、(63.46±2.24)%、(98.73±3.78)%;D组(108CFU/g)肠道中淀粉酶、脂肪酶、胰蛋白酶的活力分别为(447.45±19.79)U/g、(5.16±0.14)U/g、(2532.79±32.65)U/mg,与对照组相比分别增加了(126.65±10.02)%、(65.38±4.49)%、(94.41±2.51)%;由此可知,试验组草鱼肠道中淀粉酶、脂肪酶、胰蛋白酶活力淀粉酶的增重率和特定生长率均显著高于对照组,其中D组(108CFU/g)淀粉酶、脂肪酶活力增加最大,提高了(126.65±10.02)%、(65.38±4.49)%,C组(107CFU/g)肠道中胰蛋白酶的活力增加最大,提高了(98.73±3.78)%。

表4 枯草芽孢杆菌WTC019对草鱼肠道消化酶的影响Tab.4 Effects of B.subtilis WTC019 on activities of digestive enzymes of C.idellus
2.5 WTC019对草鱼抗氧化功能的影响
表 4 结果显示,A组(对照组)草鱼血清中过氧化氢酶活力为(5.87±0.51)U/mL,试验组B组(106CFU/g)、C组(107CFU/g)、D组(108CFU/g)的过氧化氢酶活力分别为(8.84±1.12)、(11.46±0.64)、(11.79±0.74)U/mL,与对照组相比分别增加了(50.60±9.08)%,(95.23±10.90)%,(100.85±12.61)%;A组(对照组)草鱼血清中超氧化物歧化酶活力为(68.13±1.80)U/mL、试验组B组(106CFU/g)、C组(107CFU/g)、D组(108CFU/g)超氧化物歧化酶的活力分别为(74.84±3.41)、(84.37±3.05)、(95.96±4.47)U/mL,与对照组相比分别增加了(9.85±5.01)%,(23.84±4.48)%,(40.85±6.56)%;A组(对照组)草鱼血清中谷胱甘肽过氧化物酶活力为(107.16±2.17)U/mL、试验组B组(106CFU/g)、C组(107CFU/g)、D组(108CFU/g)超氧化物歧化酶的活力分别为(110.45±7.47)、(117.61±5.67)、(109.10±7.77)U/mL,与对照组相比差异不显著;A组(对照组)草鱼血清中谷胱甘肽为(20.15±1.08)mg/L、试验组B组(106CFU/g)、C组(107CFU/g)、D组(108CFU/g)分别为(24.79±0.72)、(27.39±1.33)、(33.25±0.88)mg/L,与对照组相比分别增加了(23.03±3.57)%,(35.93±6.60)%,(65.01±4.37)%;由此可知,试验组草鱼血清中过氧化氢酶、超氧化物歧化酶、谷胱甘肽这三个抗氧化指标均显著高于对照组,其中D组(108CFU/g)过氧化氢酶、超氧化物歧化酶、谷胱甘肽增加最大,与对照组相比分别提高了(100.85±12.61)%、(40.85±6.56)%、(65.01±4.37)%。
3 讨论
大规模高密度水产养殖的过程中,为了防控鱼病的爆发,往往在饲料中添加抗生素或者在养殖过程中使用一些抗生素和化学渔药,寻找化学药物及抗生素的替代品,建立健康友好的生态养殖模式,成为现代水产养殖业的必由之路。枯草芽孢杆菌是一种应用范围很广的益生菌。目前研究表明枯草芽孢杆菌能显著提高西伯利亚鲟[7]、牙鲆幼鱼[8]、大菱鲆[9]、对虾[10-12]、罗非鱼[13]、团头鲂[14]、军曹鱼[15]、草鱼[16-21]等多种鱼类的生长速度。饲料中添加枯草芽孢杆菌能显著提高草鱼的生长性能,改变肠道微生物菌群,提高肠道消化酶活力,增加免疫因子和抗氧化因子的活性[16-19,21-24],同时研究还发现枯草芽孢杆菌还能显著改善养殖水体的水质,减少水中病原菌的比例[24]。本研究结果表明在草鱼基础饲料中添加WTC019,草鱼的增重率及相对生长速度显著提高,肠道中消化酶的活性也显著增强,抗氧化能力增强,饲料中添加该菌107CFU/g时,能起到很好的效果,这一数据与文献[22,25]略有出入,推测可能所用菌株不同所致。
水产养殖动物的消化道中消化酶活性与饲料利用率和养殖效益密切相关,草鱼消化道相关酶活性变化可以作为营养状态指标来指导草鱼的养殖,改善饲养效果。本研究中饲料中添加枯草芽孢杆菌的试验组草鱼肠道中淀粉酶、脂肪酶、胰蛋白酶活力淀粉酶均显著高于对照组,淀粉酶与对照组相比分别增加了72.4%~126.65%;脂肪酶增加了45.83%~65.38%;胰蛋白酶的活力增加了60.04%~94.41%其中D组(108CFU/g)淀粉酶、脂肪酶活力增加最大,提高了(126.65±10.02)%、(65.38±4.49)%,C组(107CFU/g)肠道中胰蛋白酶的活力增加最大,提高了(98.73±3.78)%。芽孢杆菌在生长过程中可以向细胞外分泌多种酶类(淀粉酶、蛋白酶、脂肪酶)和营养物质(多种氨基酸和维生素),这些物质或许是芽孢杆菌提高草鱼肠道消化酶活性的原因[17-20]。
抗氧化能力是评价动物机体健康程度的重要指标。 本研究中,饲料中添加B.subtilisWTC019喂食草鱼60 d后,与对照组相比,试验组氧化氢酶、超氧化物歧化酶和谷胱甘肽含量均显著高于喂食基础饲料的对照组,但谷胱甘肽过氧化物酶的活性变化不显著,这与绝大多数文献报道的结果基本一致[17-20,22-24]。饲料中添加枯草芽孢杆菌能显著提升机体抗氧化能力的具体机制还不太清楚,可能原因有两个方面:一方面,枯草芽孢杆菌进入机体后通过调节肠道微生物菌群的变化,增加肠道微生物群抗氧化酶的分泌,阻止脂质过氧化和清除自由基从而增加鱼体抗氧化的能力,另一方面,芽孢杆菌进入机体后产生的一些免疫因子可以刺激机体产生一些免疫应答反应,进而增强机体抗氧化的能力。
4 结论
本研究分离到一株促进草鱼生长的益生菌枯草芽孢杆菌WTC019,并证实在草鱼基础饲料中添加该菌107CFU/g时,草鱼的增重率及相对生长速度显著提高,肠道中消化酶的活性也显著增强,抗氧化能力增强。
