肠内营养支持对患者肝癌切除术后应激指标及预后的影响
2018-09-17程蓉谢颖樊博陈海梅余香梅王力
程蓉,谢颖,樊博,陈海梅,余香梅,王力
(1.中国人民解放军第四五二医院重症医学科,成都 610021;2.四川南充市中心医院麻醉科)
肝癌切除术是治疗原发性肝癌最为有效的治疗手段,但术后极易出现营养不良,肝功能异常等情况,影响术后的恢复,故而术后采用营养支持治疗已成为重要的环节[1]。术后营养支持一般包括两种方式,肠外营养(PN)及肠内营养(EN),本研究主要就肠内营养支持与肠外营养支持对肝癌切除术患者的影响进行对比研究,以便为肝癌切除术患者术后营养支持提供合理方案。
1 对象与方法
1.1 研究对象 选取2014年5月至2015年4月在中国人民解放军第四五二医院治疗,符合入选标准的肝癌切除术患者78例,按照随机数字表法分为研究组和对照组,每组39例。研究组男21例,女18例;年龄范围43~78岁,年龄(59.6±5.4)岁;体质量范围52.3~78.5 kg,体质量(68.6±2.1)kg;Child-Pugh分级:A级24例、B级15例。对照组男23例,女16例;年龄范围41~76岁,年龄(58.7±5.2)岁;体质量范围50.9~79.8 kg,体质量(67.4±2.3)kg;Child-Pugh分级:A级21例、B级18例。两组一般资料比较,差异无统计学意义(P>0.05)。两组患者均签署知情同意书,研究方案经中国人民解放军第四五二医院伦理委员会批准。
1.2 纳入与排除标准 纳入标准:(1)病理检查确诊为原发性肝癌;(2)均实施单纯肝癌切除术;(3)术前肝功能Child-Pugh分级为A或B;(4)自愿加入本次研究,并签署知情同意书。
排除标准:(1)肝癌切除术合并其他手术者;(2)合并严重的心肺、肾功能不全;(3)合并糖尿病或甲亢等内分泌或代谢性疾病;(4)术后发生腹腔内出血、急性呼吸窘迫综合征或肝功能衰竭等并发症;(5)术前1周服用α受体阻断剂、利尿剂或肾上腺皮质激素者。
1.3 方法 对照组:肠外营养支持,术前实施中心静脉置管,经中心静脉输注,10%、50%葡萄糖和20%脂肪乳以11∶9的比例提供热量,总热量为120 kJ·kg-1·d-1;8.5%复方氨基酸供氮0.14 g·kg-1·d-1,加入水溶性维生素、微量元素及电解质,同时还需葡萄糖 ∶胰岛素=(4~5) g ∶1u。上述营养物质加入3 L的输液袋中进行输注,时间≥12 h。
研究组:肠内营养支持,术中在空肠上段穿刺造口,放置肠营养管,十二指肠悬韧带远端25 cm处放置头端,方向应顺肠道走行,避免打折,堵塞营养管。营养支持方案选择能全素,加入温等渗盐水500 mL稀释,由肠内营养泵经空肠造瘘管输入。术后24 h即可开始,前2天能全素为250 mL,第3天开始为500 mL,外周静脉补充氮、水及电解质,同时每天将L-谷氨酰胺0.4 g·kg-1·d-1、L-精氨酸0.25 g·kg-1·d-1,三联活菌制剂(长型双歧杆菌、嗜酸乳杆菌及粪肠球菌活菌数>1.0×107CFU/g)6 g/d经空肠营养管分3次注入。两组患者均连续干预2周。
1.4 观察指标 (1)观察两组患者的术前、后的营养状况,包括体质量、上臂围、白蛋白(ALB)等指标;(2)测定两组术前、后的转氨酶[丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)]、肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)水平;(3)记录干预后的预后情况,包括术后并发症发生率及3年无瘤生存率;(4)不良反应发生情况,主要包括胃肠道反应、代谢性不良反应及感染。
术前、干预后的清晨,抽取空腹肘静脉血2 mL,离心后取血清,冷冻保存备用。ALT、AST应用全自动生化分析仪,TNF-α、IL-6应用ELISA法测定。

2 结果
2.1 营养状况 治疗前、后,两组体质量及上臂围均差异无统计学意义(P>0.05);治疗前,两组ALB水平差异无统计学意义(P>0.05),治疗后,研究组ALB水平高于对照组(P<0.05)。组内比较及详细数据见表1。
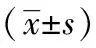
表1 两组术前、后的营养状况比较
注:a为两组干预后比较
2.2 转氨酶、TNF-α 、IL-6水平 术前,两组ALT、AST、TNF-α、IL-6水平差异无统计学意义(P>0.05);干预后,研究组上述指标水平均低于对照组(P<0.05),见表2。
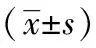
表2 两组术前后转氨酶、TNF-α 、IL-6水平变化
注:TNF-α为肿瘤坏死因子-α,AST为天冬氨酸氨基转移酶,ALB为丙氨酸氨基转移酶,IL-6为白细胞介素-6
2.3 预后 研究组术后并发症发生率低于对照组,3年无瘤生存率高于对照组(P<0.05),见表3。

表3 两组术后并发症发生率及3年无瘤生存率比较[例(%)]
2.4 不良反应 研究组出现2例腹泻,无其他并发症发生,不良反应发生率为5.1%(2/39);对照组出现4例胃肠道反应、3例感染及2例代谢性不良反应,不良反应发生率为23.1%(9/39)。研究组不良反应发生率低于对照组,差异有统计学意义(χ2=5.19,P=0.023)。
3 讨论
原发性肝癌是临床上较为常见的恶性肿瘤之一,目前最为有效的治疗方法为肝癌切除术。但在手术中需阻断肝门,可因此导致缺血-再灌注损伤,降低肝代谢与解毒功能,升高微循环阻力,引起肝功能异常,影响营养物质的吸收,尤其是脂类物质及脂溶性维生素的吸收,可影响维生素K参与的凝血功能,严重者可出现肝功能衰竭,影响术后恢复[2]。另外,手术创伤大,术后极易发生营养不良,免疫功能异常,抗感染能力下降,机体组织快速、大量消耗,蛋白合成能力下降,且组织再生及修复能力降低,均可增加术后并发症的发生,增加肿瘤复发、转移的可能[3-4]。国内外研究均显示[5-7]:肝癌切除术后应用营养支持,可明显改善患者的肝功能、营养状况,促进术后的康复。目前,营养支持的方式主要为肠内营养支持(EN)和肠外营养(PN)支持。经过很多学者[8-10]对营养方式的研究,认为肠内营养可尽早恢复胃肠功能及形态、抑制伤口导致的炎性反应,减轻肝胆负担,降低术后并发症的发生,可将其作为腹腔外科手术后的首选营养支持方案。
本研究中,肠内营养在术后24 h进行,这是由于腹部外科手术后,肠道蠕动、消化、吸收可在短时间内恢复正常,胃部、大肠功能可在24~48 h、72 h逐渐恢复正常,因此在术后24 h内进行肠内营养可提高血白蛋白水平,故而研究组ALB水平高于对照组,但两组患者的体质量、上臂围比较,差异无统计学意义,这可能是由于干预时间较短,体质量、上臂围变化范围较小,尚需进行进一步验证,这与陈燕在“早期肠内营养与肠外营养对肝癌肝切除患者肠道恢复及营养指标的影响”[11]中研究结果相一致,但陈燕的研究在实施早期肠内营养时选用的是纤维型肠内营养制剂,并不能改善肠道内紊乱的微生物环境。
本研究应用的营养制剂为能全素,不仅运用外周静脉补充氮、水及电解质,同时还每天注入L-谷氨酰胺、L-精氨酸、三联活菌制剂,通过注入三联活菌制剂,可改善肠道菌群紊乱,降低因细菌易位、内毒素及局部炎性反应对肝脏的损伤;L-谷氨酰胺可为肠黏膜上皮细胞提供能量,降低上皮细胞凋亡,维持肠黏膜通透性;L-精氨酸可促进一氧化氮合成,扩张肠道血管,改善肠道缺血状态,促进肠道功能的恢复。联合应用可发挥协调作用,降低氧化应激损伤,调控促炎、抗炎细胞因子的产生,发挥免疫调节作用,增加机体抵抗力,降低术后感染的发生。研究组患者的ALT、AST、TNF-α、IL-6水平低于对照组,术后并发症发生率低于对照组,这与丁佑铭等[12]的研究结果相一致。本研究中,研究组3年无瘤生存率高于对照组。另外,很多学者研究表明[13-15]:术后给予营养支持可减轻患者的氮平衡,可维持重要脏器功能,降低术后并发症。肠内营养的营养效果明显优于肠外营养,故而研究组并发症低于对照组。另外,本次研究结果提示,研究组不良反应发生率低于对照组,这一结果证实肠内营养的安全性更好,但本次研究的样本量较少,且对于部分作用机制尚未明确,需进行进一步的深入研究。
