浙江沿岸产卵场春、夏季鱼类资源密度和群落多样性研究
2018-09-13胡翠林张亚洲李德伟朱文斌蒋日进李鹏飞周永东张洪亮
胡翠林 张亚洲 李德伟 朱文斌 蒋日进李鹏飞 王 洋 周永东 张洪亮
(1. 浙江省海洋水产研究所, 农业部重点渔场渔业资源科学观测实验站, 浙江省海洋渔业资源可持续利用技术研究重点实验室, 舟山 316021; 2. 浙江海洋大学水产学院, 舟山 316022)
浙江沿岸产卵场由舟山渔场、鱼山渔场和温台渔场组成, 受台湾暖流、东海沿岸流及长江冲淡水的影响, 饵料生物丰富, 是多种鱼类重要的产卵场和索饵场, 在东海区乃至全国的海洋渔业中占有重要地位[1]。
然而, 由于捕捞结构不合理和酷鱼滥捕, 近二十年来浙江渔场渔业资源结构发生较大变化, 整体资源状况恶化, 表现为重要经济种类[如带鱼(Trichiurus lepturus)、银鲳(Pampus argenteus)、刺鲳(Psenopsis anomala)、小黄鱼(Larimichthys polyactis)等]的产卵亲体数量和幼鱼发生量显著下降, 渔获物规格越来越小, 幼鱼比例逐渐增高等(浙江省海洋水产研究所内部调查资料)。此外, 涉海工程建设也严重影响了沿岸产卵场和索饵场的水域生态环境, 从而间接地影响了渔业资源的恢复。 据现有的资料得知, 多年来虽有学者对浙江近岸部分水域的鱼类资源做过调查[2—4], 但对浙江沿岸产卵场渔业资源现状未开展过系统的专业研究。因此, 在渔业资源保护和群落多样性日益被世界各国重视的今天, 有必要对浙江沿岸产卵场的鱼类资源和多样性的现状进行研究。
本文根据2015年4月(春季)和7月(夏季)在浙江沿岸产卵场的底拖网调查资料, 对整个产卵场的鱼类群落结构特征进行了分析, 首次探讨了不同区域鱼类资源及多样性的差异, 并全面分析了鱼类群落多样性与诸多环境因子(生物和非生物)的关系。为“浙江渔场修复振兴”效果评价提供数据支撑, 同时也为日益增多的海洋工程建设和海洋环境污染对渔业资源的影响评估提供依据。
1 材料与方法
1.1 数据收集
本文数据来源于2015年4月(春季)和7月(夏季)在浙江沿岸产卵场保护区(27°00′—31°00′N,120°45′—123°30′E)的渔业资源底拖网调查。在该海域共设置86个调查站位(图1), 调查船只为“浙普渔70 013”号, 调查网具为单拖网, 网口周长50 m(622目×8 cm)、网身长48 m、囊网目大2.5 cm。捕获的渔获物全部低温冰鲜保存, 带回实验室进行鉴定, 每种鱼类鉴定到种[5,6], 调查和样品处理分析参考《海洋调查规范》[7]。数据分析前, 将各站位鱼类渔获量换算成拖速3.0节的单位(1h)网次渔获量。
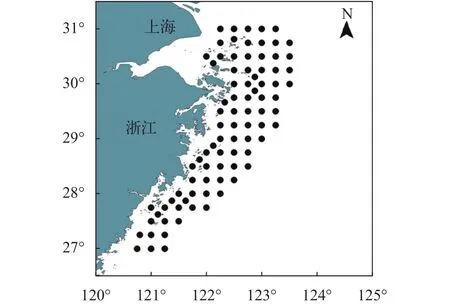
图1 调查站位图Fig. 1 Map of survey stations
同步调查的环境因子有水温、深度、盐度、pH、浊度(Turb)、电导率(Cond)、叶绿素a(Chl.a)和溶解氧(DO), 上述指标用便携式水质分析仪(YSI 6 600, USA)现场测定。在采集渔获物的同时, 浮游动物样品也同步收集, 收集和处理等全部过程均按《海洋调查规范-海洋生物调查》[7]进行。浮游动物分为端足类(Amphipods)、糖虾类(Mysids)、磷虾类(Euphausiid)、桡足类(Copepods)、十足类(Decapod)和浮游幼体(Planktonic larvae)六大类。为了比较不同区域鱼类群落多样性及资源密度的差异, 本文将舟山渔场(29°30′—31°)归为北部区域(含31°), 鱼山渔场(28°—29°30′)归为中部区域(含29°30′), 温台渔场(28°以南)归为南部区域。
1.2 数据处理
拖网资源密度的估算采用扫海面积法[8]:
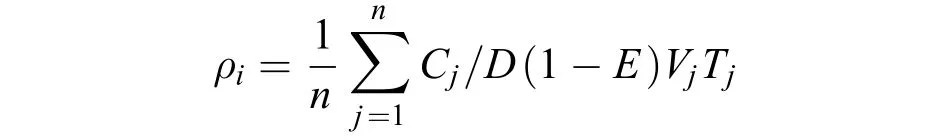
式中:ρi为i季节的平均资源密度(kg/km2或ind./km2),n为i季节的总拖网数(站位数),Cj为i季节j站位的网次渔获重量(kg)或尾数(ind.),D为网口水平扩张宽度(km)(拖速5.19 km/h时本网具D为5.20×10–3km),Vj为i季节j站位的平均拖速(km/h),Tj为i季节j站位的拖网时间(h), E为逃逸率(取0.5[4])。
由于不同种类及同种类个体间差异很大, Wilhm[9]提出用生物量表示的多样性更接近种类间能量的分布, 因此文中根据生物量计算鱼类群落多样性。本文采用比较常见的香农威尔指数(Shannon-wiener index)(H′)和Margalef丰富度指数(D)[10], 计算公式分别为其中S为种类数,N为总重量,Pi为第i种占总重量的比例。Pinkas等[11]物种优势度指数(IRI)的计算式为:IRI=(Wi+Pi)×F,其中Wi为某鱼类重量占总鱼类重量的百分比(%),Pi为某鱼类尾数占总鱼类重量的百分比(%),F为某鱼类在各航次拖网总次数中出现频率, 即出现次数与总拖网次数之百分比(%)。本文定义IRI≥1000为优势种[12]。
本文利用分类回归树(Classification and Regression Tree, CART)[13]方法来预测鱼类多样性变化的最优环境变量。CART最大的特点就是它不要求因变量和自变量之间有线性或非线性关系, 它是将自变量不停地进行拆分, 来预测因变量的可能发展趋势, 在每次的拆分过程中会自动选择最优划分变量。在初始的
回归树构建完成后, 我们还需对它进行剪枝(‘pruning’ branches), 因为若不加任何限制,最终生成的树必和原始数据完全拟合。本文利用1-SE规则来进行剪枝, 即预测误差在“最小误差±1个相应标准差”范围内, 然后在此范围内选取尽量小的复杂性参数(Complexity parameter), 以它为依据进行剪枝, 其中预测误差是通过交叉验证(Crossvalidated)获得[14], 分类回归树是在R软件中构建。
不同区域优势种大小、资源密度和多样性比较采用单因素方差(one-way ANOVA)和LSD多重比较分析, 为保证方差齐性, 所有数据在分析前进行log(x+1)转换, 数据处理在Excel 2010和SPSS 16.0中进行。
2 结 果
2.1 种类组成
春季拖网调查共采集鱼类样本92种, 隶属17目50科77属, 其中鲈形目种类数最多, 占总种数的44.57%。鲼形目、灯笼鱼目、鲤形目、鲀形目、海鲂目、鲻形目、鼬鳚目和颌针鱼目种类数最少,分别只有1种。
夏季共采集到底层鱼类样本114种, 隶属16目59科92属, 种类数较春季明显增多, 同样鲈形目鱼类占多数, 有49种, 占总种数的42.98%。鼠鲨目 、鳐目、灯笼鱼目、海鲇目、海鲂目和鼬鳚目种类数最少, 均只有1种(表1)。
2.2 优势种及其大小
春季北部的优势种为龙头鱼(Harpodon nehereus)、矛尾虾虎鱼(Chaeturichthys stigmatias)、中华栉孔虾虎鱼(Ctenotrypauchen chinensis)和凤鲚(Coilia mystus), 中部和南部的优势种都为龙头鱼(H. nehereus)和矛尾虾虎鱼(C. stigmatias), 三区域共同的优势种为龙头鱼(H. nehereus)和矛尾虾虎鱼(C. stigmatias)。夏季北部的优势种为小黄鱼(Larimichthys polyactis)、龙头鱼(H. nehereus)、矛尾虾虎鱼(C. stigmatias)和绿鳍鱼(Chelidonichthys kumu), 中部和南部优势种都为小黄鱼(L. polyactis)、龙头鱼(H. nehereus)和白姑鱼(Argyrosomus argentatus), 三区域共同的优势种为小黄鱼(L. polyactis)和龙头鱼(H. nehereus)。经单因素方差和多重比较分析得出, 春季龙头鱼大小自北向南有明显递增趋势, 但差异不显著(P>0.05), 中部矛尾虾虎鱼较其他两区域大, 但是差异也不显著(P>0.05); 夏季仅北部和南部小黄鱼差异极显著(P<0.01), 其他区域间差异不显著; 并且其他不同区域同一种类间差异都不显著(P>0.05)(表2)。

续表1

续表1
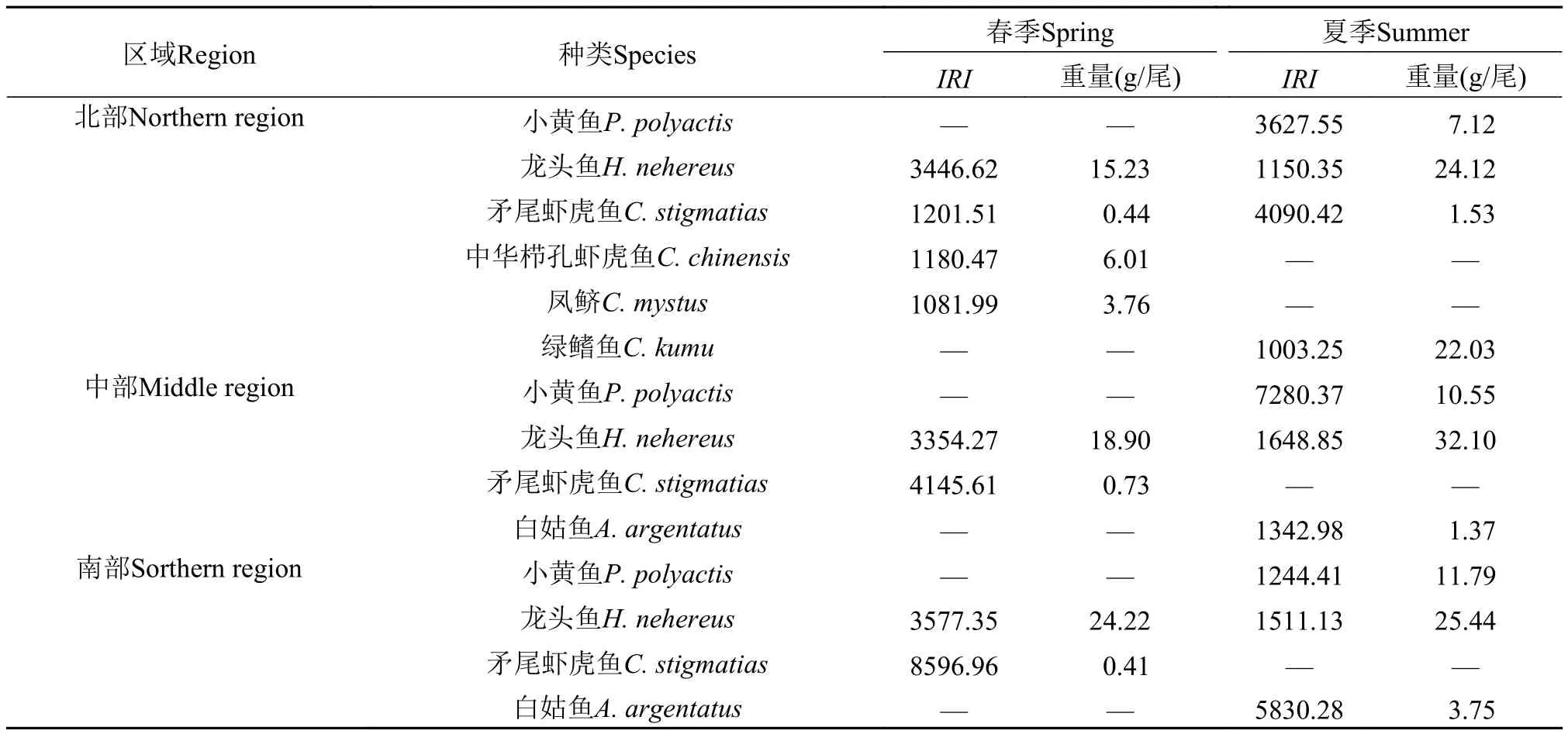
表2 不同区域优势种的IRI指数及重量Tab. 2 The index of relative importance (IRI) and weight of dominant species in different regions
2.3 资源密度变化
春季调查的资源密度数据显示, 在生物量方面,全区生物量最大值为2144.66 kg/km2, 最小值为4.40 kg/km2, 平均为434.40 kg/km2。从不同区域来看, 中部的生物量最高, 北部次之, 南部最低。单因素方差分析结果表示不同区域生物量差异显著(P=0.017<0.05), 多重比较结果显示, 仅中部和南部的生物量差异极显著(P=0.005), 其他区域间差异不显著(P>0.05)。在尾数密度方面, 全区尾数密度最大值为435.85千尾/km2, 最小值为1.24 千尾/km2, 平均为58.42千尾/km2。从不同区域看, 从北到南尾数密度呈直线上升趋势。单因素方差分析结果显示,不同区域尾数密度差异不显著(P>0.05)(图2、图3)。
夏季调查的资源密度数据显示, 在生物量方面,全区生物量最大值为13 692.92 kg/km2, 最小值为40.20 kg/km2, 平均为1 532.73 kg/km2。夏季生物量显著大于春季(P=0.000<0.01)。从不同区域来看,中部的生物量最高, 南部次之, 北部最低。单因素方差分析结果表示不同区域生物量差异极显著(P=0.001), 多重比较的结果显示, 北部与中部生物量差异极显著(P=0.000), 与南部差异显著(P=0.017), 但是中部与南部没有显著性差异(P=0.310)。尾数密度方面, 全区尾数密度最大值为1 397.33 千尾/km2, 最小值为5.31 千尾/km2, 平均为205.50千尾/km2。夏季尾数密度显著大于春季(P=0.000<0.01)。从不同区域看, 南部比中部略高, 北部最低。单因素方差分析结果显示, 北部尾数密度与南部差异显著(P=0.034), 但是其他区域间差异不显著(图2、图3)。
2.4 多样性研究
不同区域的多样性春季H′值的变化范围为0.17P<2.49, 平均值为1.52;D值变化范围为0.80—3.74, 平均值为2.18。单因素方差分析结果显示, 北部和南部D差异显著(P=0.048), 其他区域间H′和D差异均不显著(P>0.05)。
夏季H′值的变化范围为0.23—2.59, 平均值为1.34;D值变化范围为0.82—3.22, 平均值为1.81。单因素方差分析显示不同区域H′差异极显著(P=0.001),多重比较结果显示北部和中部H′差异极显著(P=0.000), 中部和南部之间差异接近极显著(P=0.01), 北部和南部区域间差异不显著(P>0.05);与H′不同, 仅北部和中部D差异显著(P=0.039), 其他区域间差异不显著(P>0.05)(图4)。
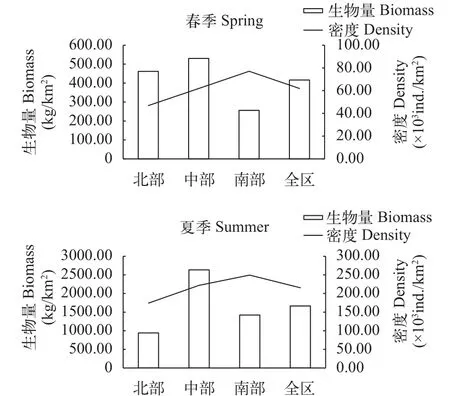
图3 不同区域鱼类资源量指数变化Fig. 3 Variations of the biomass and abundance density of fishes in different regions
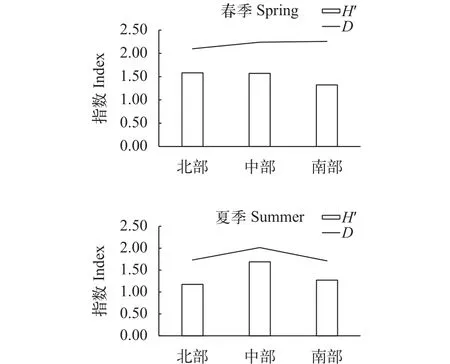
图4 不同区域多样性指数变化Fig. 4 Variations of diversity index in different regions
多样性的CART分析影响春季多样性指数主要的因素为浊度、DO、桡足类及温度, 影响丰富度主要的因素有水深、浊度、温度及DO。夏季多样性指数主要受水深、桡足类、浊度、温度和盐度的影响,丰富度主要受水深、桡足类、溶氧和浊度的影响。
3 讨论
3.1 资源密度特征
春季是很多鱼类的产卵季节, 因此幼鱼发生量较高。调查期间在浙江沿岸产卵场保护区发现有十余种鱼类的幼体, 其中小黄鱼、绿鳍鱼和矛尾虾虎鱼数量最多。春季的资源密度调查结果显示, 南部尾数密度最高, 但却表现出生物量最低, 这可能是由于南部水域幼鱼比例非常高所致(幼鱼尾数密度占该区域总密度的69.18%)(表3)。调查期间发现夏季幼鱼较少, 北部水域几乎没有出现幼鱼, 中部和南部水域仅发现一种鱼类幼体, 分别为黄姑鱼和白姑鱼。与春季相比, 夏季沿岸产卵场从北向南鱼类尾数密度的变化趋势相似, 都是逐渐增高, 但是生物量却呈现出北部相对减少, 南部相对增加的现象(图3)。这可能有两方面原因, 一方面由于南部水域大量的幼体随着水温的升高, 生长迅速, 体重增加, 最后导致整个区域的生物量明显增加; 另一方面由于优势种小黄鱼在北部水域较小, 而在南部水域个体较大的缘故(表2)。
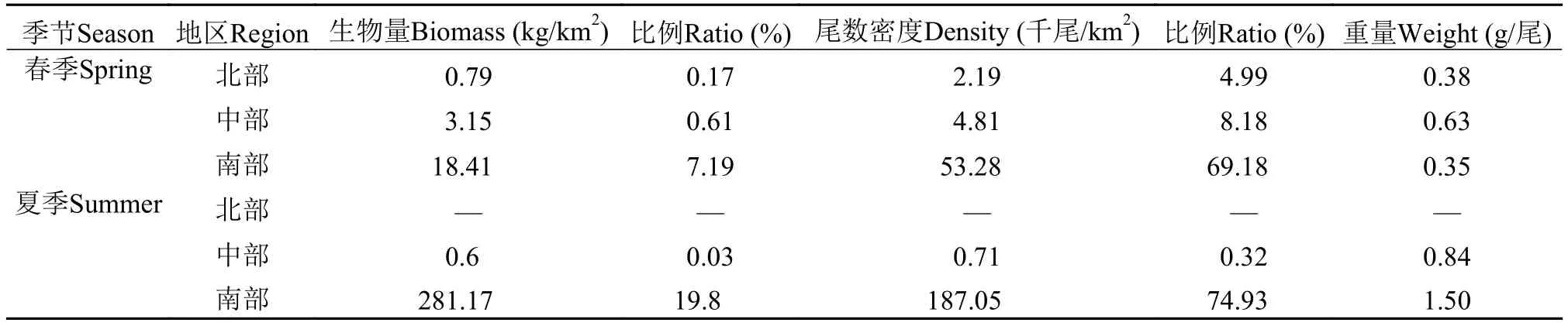
表3 春、夏季不同区域幼鱼主要参数比较Tab. 3 Comparing the main parameters of juvenile fishes belonging to different regions in spring and summer
3.2 多样性变化
不同纬度及区域间多样性的比较本文将研究结果从空间和时间跨度上分别与其他海域进行了比较(表4), 得出的结果和结论如下: 从空间跨度上, 纬度与H′没有绝对的线性关系, 如春季从西大亚湾到东海中部(2001),H′随着纬度的递增而减小, 但随着纬度的继续增高,H′反而增大(调查时间较近的青岛海域和东海中部海域相比H′明显较大),这与之前纬度越高,H′越低的研究结论不符。虽然纬度与H′的关系并非简单的线性关系, 但当纬度跨度比较大时, 低纬度水域的H′值还是明显高于高纬度水域的H′值, 如调查时间相近的西大亚湾海域H′值与辽东湾北部海域H′值相比, 春季大4.51倍, 夏季大1.59倍。从时间跨度上, 东海中部(浙江沿岸产卵场绝大部分包含在内)海域自2000年到2015年期间, 共进行了4次多样性研究, 结果表明自2000年到2008年,H′和D值逐渐下降, 2008年与2015年相比多样性水平呈上升状态。林楠等[1]指出2008年多样性下降是由于凶猛肉食性鱼类带鱼生物量明显增加和人为影响(捕捞及污染)的原因。2015年多样性水平明显升高, 我们推测是由于温度和饵料的影响。近年来, 由于全球气候变暖, 导致调查海域表层温度升高[25]。有研究表明, 2014年浙江沿岸水域表层平均温度较2009年有所上升, 伴随着温度的升高,浮游动物的密度和生物量也随之上升(密度和生物量分别增加了57.77%和47.11%)[26]。底层鱼类大部分属于杂食性鱼类, 幼体或者有些成体的食物组成中包含大量的浮游动物[27], 因此, 2008年之后鱼类多样性的上升多半是由于调查海域的水温及生物饵料变化引起的。2015年产卵场南部海域的多样性水平(H′值1.32,D值2.26)与2011年的调查结果相近, 表明产卵场(南部)近几年渔业生态环境处于相对较稳定的状态。
本研究结果显示夏季产卵场中部水域多样性水平显著高于北部水域(P<0.05)。有研究表明多样性指数与生物量呈负相关关系, 多样性越高, 生物量越低[4]。然而本文中的趋势与这一论点不符, 当夏季中部水域多样性水平明显高于北部水域时, 中部水域的生物量也显著高于北部(P=0.01), 但统计分析得知, 两区域的多样性指数与生物量并不存在线性关系(P>0.05), 因此产卵场不同区域间多样性的差异并非由生物量不同而导致。由图5可知, 夏季影响鱼类多样性水平的最主要因素为水深和桡足类, 经单因素方差分析, 夏季中部和北部水域的水深差异不显著(P>0.05), 但是桡足类的密度差异显著(P<0.05)。桡足类为底层幼鱼的重要饵料, 甚至某些成体鱼类的食物中还包含许多桡足类[28]。因此, 推测夏季不同区域多样性的差异可能是由于饵料生物密度的不同而导致。
影响鱼类群落多样性的环境因素春季影响鱼类群落多样性的主要因素为水深、浊度和溶氧。很多研究表明, 水深是影响鱼类群落多样性分布的主要环境因子之一, 但是引起群落变化的不是水深本身, 而是与水深变化有伴随关系的水动力、光照、溶解氧以及食物来源等其他因素[29]。例如在印度洋的Reunion岛, Pinault等[29]发现水深是通过食物饵料来影响鱼类的分布。本研究中浊度与Chl.a呈极显著的正相关关系, 其回归方程为y=46.18x+103.77(R2=0.7318,P=0.000<0.01), 所以浊度可能更多的是通过Chl.a来影响鱼类多样性的变化。叶绿素影响着浮游动物的数量及分布, 而浮游动物为鱼类的重要饵料, 因此叶绿素也会间接地影响鱼类的丰度及分布, 这与赵静的研究结论相符[30]。溶氧是影响鱼类分布的又一重要因素, 不同的鱼类对溶氧的耐受能力不同, 本研究的多样性及丰富度结果都显示, 浙江沿岸产卵场水底溶解氧为5.99 mg/L时是鱼类分布的临界点, 一部分鱼类喜欢聚集于大于5.99 mg/L的水体, 而另一部分鱼类倾向于溶氧小于5.99 mg/L的水体中。
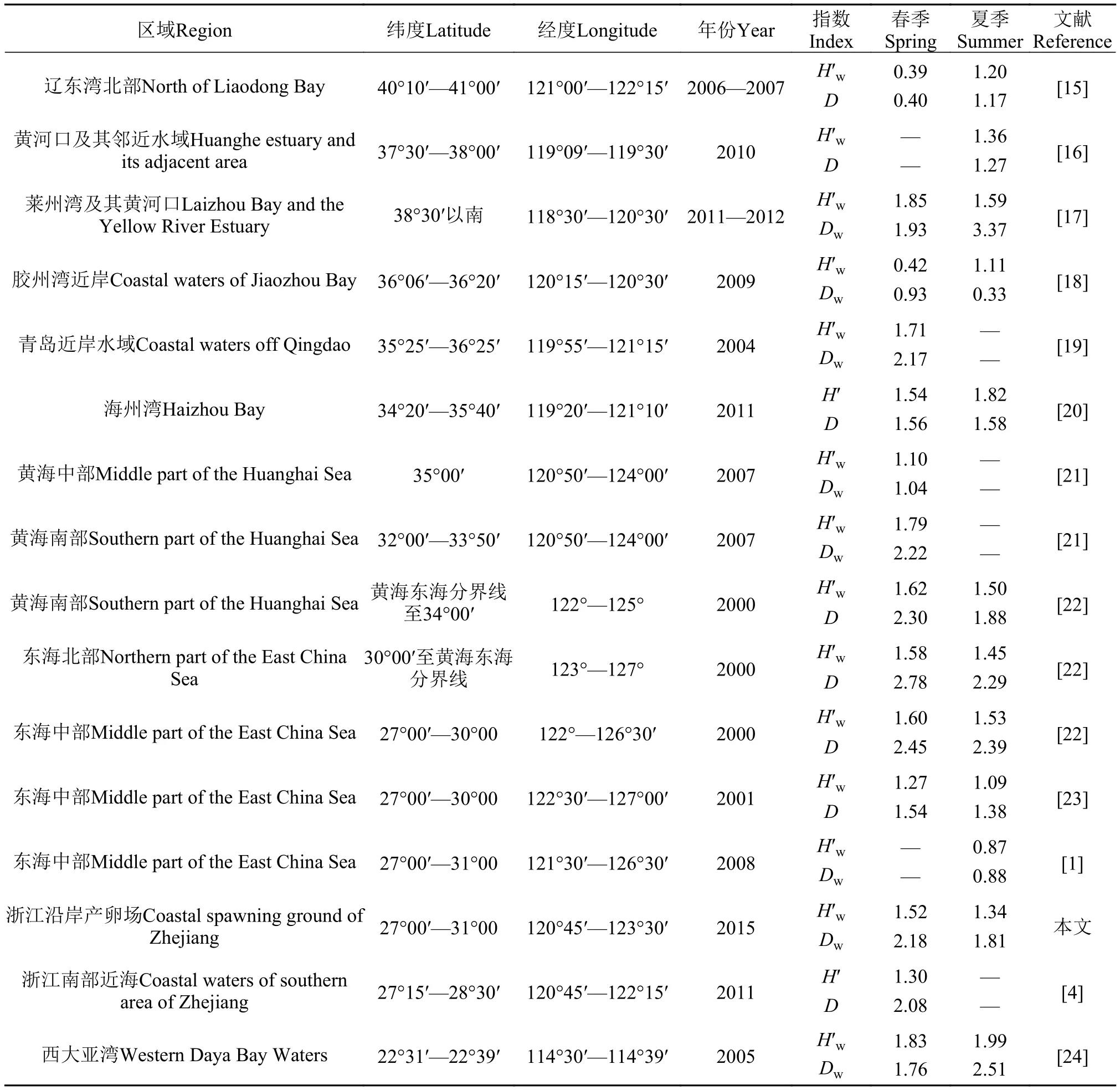
表4 与其他海域多样性比较Tab. 4 Comparing the fish diversity indices in different regions
夏季影响鱼类多样性的主要因素为水深、桡足类、温度和浊度。桡足类为浙江近岸水域浮游动物的主要类群, 其种类繁多, 其中桡足类中的中华哲水蚤是浮游动物的绝对优势种[27], 因此桡足类作为鱼类饵料[28], 其丰度的变化对鱼类多样性的影响非常明显。水温影响着鱼类个体的新城代谢能力, 主导了鱼类生长、发育和繁殖等各个生活史,同时通过参与调解初级生产力间接地影响鱼类整个食物网结构[31,32], 因此成为影响鱼类群落的重要因子之一。本研究结果表明, 19℃左右的水温是影响鱼类分布的临界点, 鱼类更喜欢聚集在水温大于19℃的水域中。同样, 夏季浊度与Chl.a呈非常显著的正相关关系, 其回归方程为y=55.12x+145.14(R2=0.466 3,P=0.000<0.01), 此时的浊度可能更多的也是通过初级生产力来影响鱼类多样性的变化。
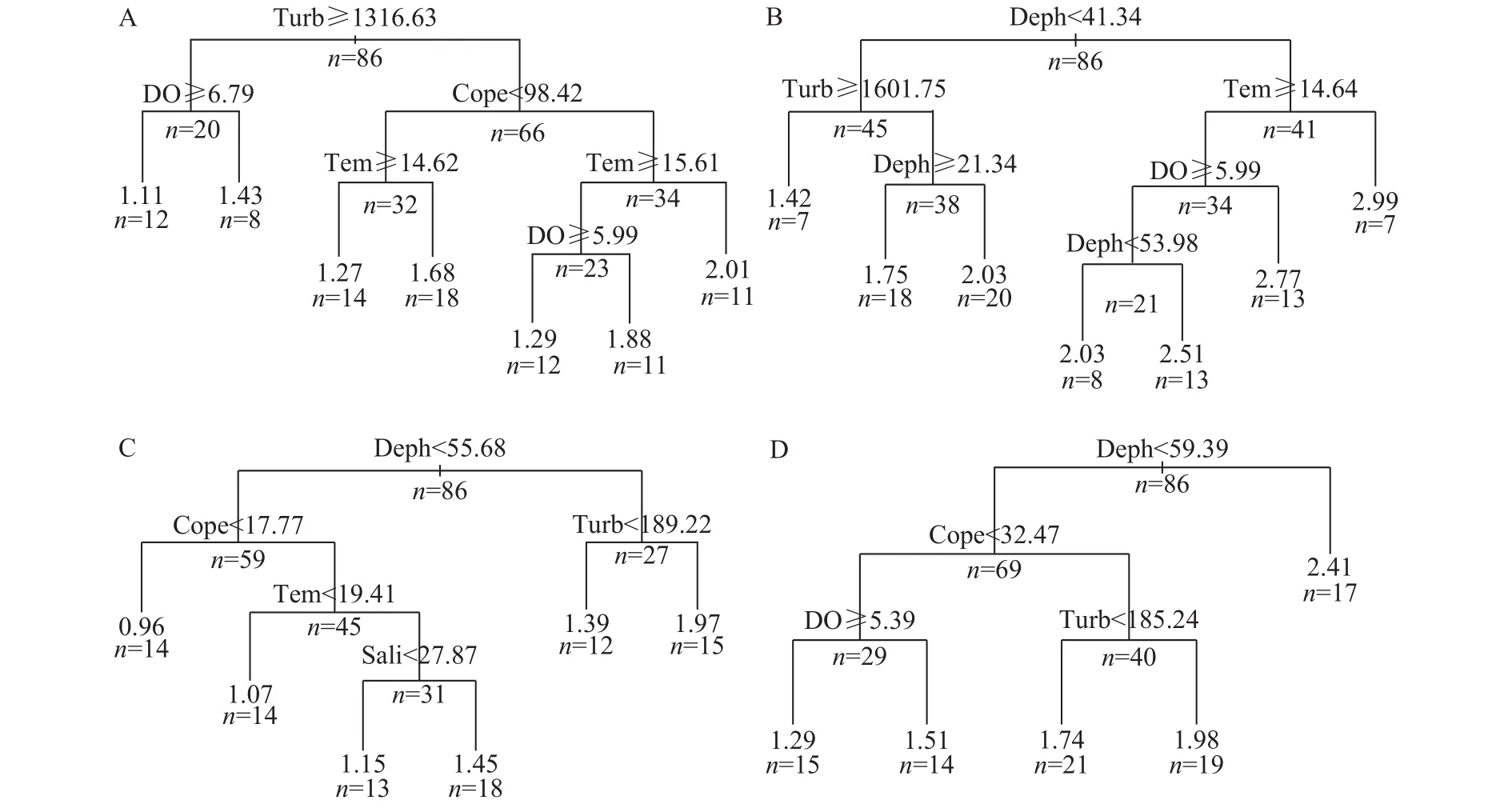
图5 春、夏季多样性指数和丰富度指数的分类回归树Fig. 5 Classification and regression tree of diversity and richness indexes in spring and summer
