华南鲤选育群体不同世代遗传多样性与遗传结构的微卫星分析
2018-09-13马冬梅苏换换朱华平黄樟翰
马冬梅 苏换换 朱华平 黄樟翰
(中国水产科学研究院珠江水产研究所,农业部热带亚热带水产资源利用与养殖重点实验室,广州 510380)
鲤(Cyprinus carpio)具有生长快、杂食性、抗病力强和味道鲜美等特点, 作为世界上重要的养殖鱼类之一, 其产量约占全球淡水养殖鱼类产量的14%, 在世界水产养殖业中占据重要地位。鲤在我国的养殖历史悠久, 目前依然是我国的主要养殖对象, 2016年鲤养殖总产量为3.5×109kg, 相比2015年增产4.17%, 位于淡水鱼类养殖产量的第3位[1]。华南鲤(Cyprinus carpio rubrofuscus)隶属于鲤形目(Cypriniformes)、鲤科(Cyprinidae)、鲤属(CyprinusLinnaeus), 为鲤的4个亚种之一, 分布于珠江流域以及海南岛等华南地区[2,3]。目前, 华南鲤作为优质的地方鲤鱼品种在华南地区特别是在粤西、北地区作为名特优水产品种“禾花鲤”进行稻田养殖, 因其肉质细嫩, 味道鲜甜, 营养价值高, 深受广大消费者的青睐, 是当地发展农村经济一条重要途径和主导产业, 也为当地水产养殖业的发展,特别是提高山区农户经济收入、脱贫致富做出了重要的贡献。
但长期以来, 华南鲤地方养殖品种都没有经过系统的选育和提纯复壮, 目前用于养殖的种苗大多来自于野生群体的繁育后代。经过连续多代的人工繁殖, 特别是大部分养殖户还依靠自养自繁的方式来获得鱼苗, 鱼种近亲繁殖严重, 质量得不到保证, 导致华南鲤种质退化严重, 生长速度慢, 抗病抗逆性能差, 成活率低, 致使养殖产量低, 无法满足当前优质高效渔业发展趋势的要求。从2010年开始,珠江水产研究所科研人员系统地评估和研究了华南鲤的种质资源现状, 并开展了华南鲤优质品种的定向选育, 已取得了明显进展, 培育的华南鲤优良品种在粤北地区进行了稻田试养, 其成活率提高20%以上, 单产提高50%以上, 养殖效益明显。为了加快华南鲤选育工作的进程, 本研究利用微卫星技术分析了4个连续选育世代遗传变异的情况, 了解人工选育对其遗传结构和遗传多样性的影响, 以期为下一步制定育种策略提供参考。
1 材料与方法
1.1 实验材料
实验所用华南鲤选育世代F1、F2、F3及F4群体均来自中国水产科学研究院珠江水产研究所养殖基地。其中, 基础群体采自于珠江水系干流之一的西江野生群体和乳源瑶族自治县当地养殖品种的混合群体, 从2010年开始挑选体型标准、健康、生长快、抗病力强的亲鱼建立基础群, 并利用微卫星技术分析了基础群体的遗传多样性[其中西江野生群体和乳源养殖群体的平均期望杂合度(He)分别为0.7834和0.6989, 平均多态信息含量(PIC)分别为0.7628和0.6458], 结果表明基础群体具有较高的遗传多态性。每一代在体长约10 cm和体重约500 g时分别进行一次选择, 每代选留2000尾(雌雄比例为1∶1)作为选育亲本繁殖下一代。4个人工选育群体(2012年、2013年、2014年和2015年分别繁育出F1、F2、F3和F4)是在上述基础群体的基础上, 以生长速度为主要选育目标性状, 同时兼顾体型性状,采用群体选育方法获得。每个世代随机选取24尾健康个体作为试验样本, 取部分鳍条用于基因组DNA提取, 置于95%的乙醇中固定, –20℃保存备用。
1.2 实验方法
基因组DNA提取基因组总DNA的提取利用TIANamp Marine Animals DNA Kit (TIANGEN)试剂盒抽提, DNA电泳检测质量合格后, 用灭菌水调整浓度为50 ng/μL, –20℃保存备用。
SSR扩增及检测微卫星引物Cca02、Cca06、Cca19、Cca67、Cca72和J58引自于Yue等[4],引物Cca30、Koi29-30、Koi57-58、Koi89-90和Koi115-116引自于David等[5], 引物MFW6、MFW7、MFW13、MFW17和MFW 26引自于Crooijmans等[6]。16对引物均由上海生工生物工程技术服务有限公司合成。PCR扩增体系总体积为20 μL, 其中灭菌水13.9 μL, 10×buffer (2 mmol/L Mg2+) 2.0 μL,25 mmol/L dNTPs 2 μL, DNA模板1.0 μL (50 ng), 引物各0.5 μL, 5 U/μLTaq酶(TaKaRa) 0.1 μL。PCR扩增程序: 94℃ 5min; 94℃ 30s, 退火 30s(各引物退火温度及序列见表1), 72℃ 30s, 30个循环; 72℃10min, 4℃保存。PCR产物采用6% (w/v)的聚丙烯酰胺凝胶垂直板电泳进行分离, 常规银染法检测[7]。

表1 华南鲤16个微卫星位点的引物序列及特征Tab. 1 Primer sequences and characteristics of 16 polymorphic microsatellite loci from Cyprinus carpio rubrofuscus used in the present study
1.3 数据分析
利用LabImage (Version 2.7.1)软件在胶图上确定等位基因条带的位置和等位基因的大小。采用Popgene1.31软件分析等位基因数(Na)、有效等位基因数(Ne)、期望杂合度(He)和观测杂合度(Ho)[8]以及世代间的遗传相似性系数、遗传距离。多态信息含量(Polymorphism information content,PIC)利用Cervus 3.0软件计算获得[9]。近交系数(Fis)和群体间的遗传分化指数(Fst)以及每个位点偏离哈-温平衡期望值的卡方检验由FSTAT 2.9.3.2分析软件统计获得[10]。4个世代的聚类分析图采用MEGA 5.0软件中的UPGMA方法构建[11]。
2 结果
2.1 不同世代的遗传多样性分析
在4个连续选育群体中, 16个微卫星位点都表现出较高的多态性, 且扩增条带清晰。4个选育世代共检测到99个不同的等位基因, 但每个世代检测到的等位基因数不等, 分别为91、79、77和73个,每个位点平均检测到的等位基因数为6.1875个。其中, Cca30和Cca72两个位点观察到的等位基因数最多(10个), 而Koi29和Koi57两个位点的等位基因数最少(3个)(表2)。本实验分析的4个选育群体的平均等位基因数(Na)、平均有效等位基因数(Ne)、平均观测杂合度(Ho)、平均期望杂合度(He)和平均多态信息含量(PIC)如表3所示。

表2 华南鲤4个世代在16个位点的遗传多样性参数值Tab. 2 Genetic variability of 4 generations of Cyprinus carpio rubrofuscus at 16 polymorphic microsatellite loci

续表2
2.2 世代间遗传变异及分化
F-检验的统计数据如表4所示, 在16个微卫星多态位点中, 有13个位点的近交系数(Fis)值均为负值, 另外3个位点为正值, 表明4个世代的近交程度较轻。研究数据显示, 4个选育世代都有一定程度的杂合子缺失, 其中F1—F4杂合子缺失的位点数分别为6、7、8和5个。但对于整个选育群体来说, 有3个群体-位点表现为杂合子缺失状态, 13个群体-位点杂合子处于过剩状态。在整个选育群体中, 微卫星位点的遗传分化(Fst)值最大为0.2410, 最小值为0.0219, 平均值为0.0681。其中, 表现为遗传分化程度较弱的位点有5个, 遗传分化程度中等的位点10个, 遗传分化程度较大的位点有1个(表4)。世代间遗传分化指数(Fst)配对比较结果显示, F1与F4的遗传分化指数值最大(0.081), F3与F4则最小(0.051);相邻世代间Fst值逐渐变小(F1与F2为0.062, F2与F3为0.058, F3与F4则为0.051), 各世代间配对Fst比较值处于0.05—0.15[12]。上述结果表明, 本选育群体在检测的16个多态位点上表现出一定的遗传分化,处于中等水平(表5)。
4个选育世代间的遗传距离和遗传相似性系数如表6所示, 选育群体F1和F4的Nei氏无偏遗传距离值最大(0.2181), 遗传相似性系数最小(0.8041); 选育群体F3和F4遗传距离最小(0.1258), 遗传相似性系数最大(0.8819); 相邻2个世代间的遗传距离逐代减小, 遗传相似性逐代增大。依据4个选育世代间的遗传距离值, 采用UPGMA法构建聚类图见图1, 选育世代F3首先与F4汇合成一支, 然后与F2汇成一簇,最后与F1汇在一起。

表3 华南鲤4个世代的遗传多样性统计结果Tab. 3 Statistical analysis results of genetic diversity belong to 4 generations of Cyprinus carpio rubrofuscus

表4 华南鲤4个选育世代16个微卫星位点的F-检验Tab. 4 F-statistics for 4 generations of Cyprinus carpio rubrofuscus at 16 microsatellite loci

表5 华南鲤4个世代间Fst值比较Tab. 5 Comparing pairwise values of Fst among 4 generations of Cyprinus carpio rubrofuscus
3 讨论
选择育种是水产优良品种培育的有效途径, 但同时人工选育也是育种群体遗传多样性降低的重要原因之一[13]。通常在人工选择育种的后期, 选育群体的数量会逐渐减少, 近交发生的机率增加, 从而导致选育群体的遗传多样性指数降低, 引起目标群体种质衰退, 对水域生态环境的适应性下降, 生长速度减慢, 抗逆能力差, 最终导致失去开发利用的经济价值。因此, 在水产良种培育过程中, 维持育种群体的遗传多样性, 是种质资源持续利用的前提条件。本研究中的华南鲤选育群体是采用人工选择育种和杂交育种结合的方法, 对基础育种群体经过连续多年的继代选育培育而成。目前选育品系已作为“禾花鲤”在广东省西部和北部地区稻田中进行试养, 与当地稻田养殖的“禾花鱼”相比, 生长速度和养殖成活率表现出明显的优势。因此, 了解人工选育过程中4个选育世代的遗传变异情况,有利于后续育种策略的制定以及优良华南鲤品种的培育。目前, 已有大口黑鲈Cropterus salmoides[14]、大黄鱼Pseudosciaena crocea[15]、易捕鲤Cyprinus carpio[16]、翘嘴鳜Siniperca chuatsi[17]、尼罗罗非鱼Orechromis niloticus[18]和团头鲂Megalobrama amblycephala[19]等以及凡纳滨对虾Litopenaeus vannamei[20]、中华绒螯蟹Eriocheir sinensis[21]、池蝶蚌Hyriopsis schlegeli[22]、大珠母贝Pinctada maxima[23]、合浦珠母贝Pinctada fucata[24]、中华鳖Trionyx sinensis[25]、刺参Apostichopus japonicus[26]等水生经济动物的选育群体遗传结构监测研究报道, 但华南鲤的育种研究方面尚未见类似的报道。有多项研究表明, 尽管人工选择压力在一定程度上会使得选育群体的遗传多样性降低, 引起各选育世代出现遗传分化, 但一些选育群体依然保持较高的遗传多样性水平[15,16,19,20]。在本研究中, 随着选育世代的增加,4个人工选育群体的遗传多样性逐渐下降, 他们的多态信息含量(PIC)值分别为0.6577、0.6007、0.5852和0.5834, 均比Bostein等[27]提出的衡量群体基因变异程度中等的标准值(多态信息含量指标值为0.5)高。因此, 本实验分析的华南鲤经过连续4代的选育, 群体的遗传多样性水平依然较高, 表明该选育群体仍具有较好的选育潜力。
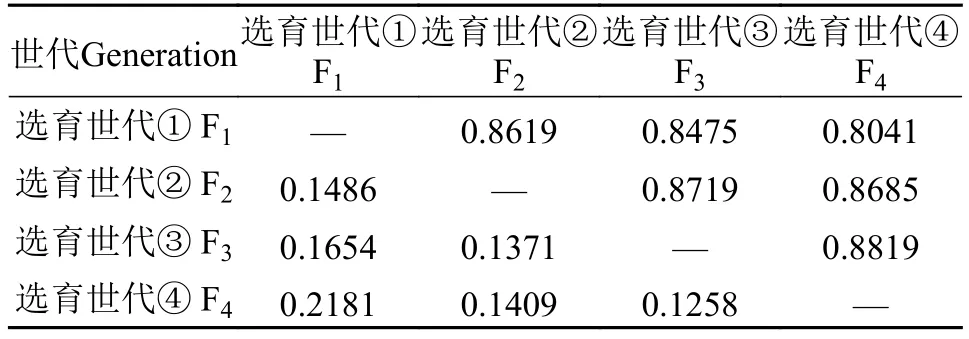
表6 华南鲤F1—F4群体的Nei氏遗传距离(下三角)及遗传相似性系数(上三角)Tab. 6 Nei’s standard genetic distance (below) and genetic identity(above) between F1—F4 generations

图1 基于Nei氏无偏遗传距离的UPGMA进化树Fig. 1 An unweighted pair group method with arithmetic mean(UPGMA) dendrogram for 4 generations of Cyprinus carpio rubrofuscus based on Nei’s unbiased genetic distance
遗传杂合度是评价群体遗传多样性水平的一个常用的指标, 表示2个等位基因在每个个体中处于杂合状态的概率。从本研究统计结果来看, 4个连续选育世代的杂合度呈现逐代降低的现象, 与不同世代多态信息含量PIC值的变化趋势相似, 也与大黄鱼[15]和易捕鲤[16]等选育群体遗传多样性变化趋势相一致, 表明连续多代的人工选择已经对华南鲤选育群体的遗传多样性造成了影响。在华南鲤选育过程中, 为了减少近交概率, 采取了一些措施保证选育群体较高的遗传多样性, 选育世代F1的观测杂合度(Ho)为0.7943, 到F4降为0.7135, 下降了11.32%, 研究结果与易捕鲤选育群体观测杂合度下降6.9%[16]以及中国对虾(Fenneropenaeus chinensis)[28]观测杂合度下降3.5%的微卫星检测结果相近, 表明华南鲤经过连续4代选育其群体还没有出现近交及瓶颈效应。F-检验的数据显示, 在16个微卫星多态位点中, 有3个位点的近交系数Fis值为正值, 另外的13个位点为负值, 表明4个选育世代的近交程度较轻, 说明了在华南鲤选育过程中采用的大规模群体继代选育的方法是行之有效的, 从而降低了近交概率, 选育群体的遗传多样性也保持在较高的水平。但在4个选育世代中, 依然存在3个群体-位点处于杂合度缺失状态, 表明这些位点上可能存在哑等位基因, 这在中国对虾[28]和南美白对虾Penaeus setiferus[29]选育群体中也得相似的研究结果, 有研究者认为造成位点杂合度缺失的主要原因之一是由微卫星座位中经常出现的无效等位基因引起的[30]。
遗传分化系数是评价群体间遗传相似性的指数, 表示群体间的遗传多态性水平差异程度。在本研究中, 16个多态位点在4个世代中有5个位点遗传分化程度较弱, 10个位点遗传分化程度中等, 1个位点遗传分化程度较大, 各位点的遗传分化(Fst)指数在0.0219—0.2410, 群体总遗传分化指数为0.0681(表4), 表明选育群体的遗传分化程度处于中等水平。通过世代群体间配对Fst值比较(表5), F1与F4之间Fst比值最大, 为0.081, 而F3与F4之间Fst比值最小, 为0.051, 随着选育世代的增加, 遗传分化系数在相邻世代之间相继减小, 与连续选育世代等位基因数、平均观测杂合度等均有所下降的变化趋势一致, 说明了选育后代的遗传相似度逐渐提高, 选育群体的遗传结构随着世代的增加而发生了改变。本研究数据显示, 华南鲤选育世代间的遗传分化指数配对比较值处于0.081—0.051, 依据Wright等[31]对遗传分化指数的界定标准, 本研究分析的选育群体的遗传分化水平处于中等, 这与“全红”瓯江彩鲤(Cyprinus carpiovar. color)[32]的不同选育世代之间出现较大分化(Fst在0.1588—0.2766)的结果相比, 通过4代连续人工选育导致华南鲤的遗传多样性降低的影响程度相对较弱。4个选育世代间的遗传距离和遗传相似性的统计结果显示, F1与F2、F3、F4的遗传距离逐渐增大(0.1486—0.2181), 遗传相似性逐渐缩小(0.8819—0.8041)(表6), 其中以世代F1和F4的遗传距离最大(0.2181), 世代F3和F4的遗传距离最小(0.1258), 而F3和F4的遗传相似性系数最大(0.8819), F1和F4的遗传相似性系数最小(0.8041),研究结果与Thorp[33]指出同种群体间遗传相似性在0.8—0.97, 遗传距离在0.03—0.2的结论相符, 也与尼罗罗非鱼(O. niloticus)“吉富”品系9代选育群体的遗传距离和遗传相似性指数分别为0.0581—0.0775和0.9254—0.9435的结果相似[34], 而与易捕鲤[16]选育4代的遗传距离和遗传相似性分析结果差异较大。经过UPGMA聚类分析构建的进化树直观地显示出了各选育世代之间的遗传相似性, 其中F3和F4的遗传距离最小, 遗传相似性最大, 首先汇聚在一起, 然后再相继与F2、F1聚集。上述结果表明,随着人工定向选育工作的推进, 华南鲤选育群体的遗传结构已出现了较为显著改变。这些研究结果与选育过程中目标性状逐渐趋向稳定的观测结果相一致, 即通过对华南鲤选育后代的表型值进行测量, 分析表明经过多代连续选育, 选育后代的体型逐渐趋于一致, 体重变异系数逐渐减小, 充分说明了人工选育方法对华南鲤种质提纯复壮和新品种培育的作用明显。
本研究通过利用16对多态性微卫星引物分析了4个连续人工选育华南鲤群体的遗传结构变化情况, 结果表明华南鲤经过4代选育后, 虽然遗传杂合度和遗传多样性存在下降的现象, 但遗传多样性水平依然较高, 依然具有进一步选育的潜力。因此,在后续的选育过程中, 可通过适当增加选育亲本的数量, 减少近交发生的概率以及采用较高的选择压力等手段, 培育出在生长、抗逆等优良经济性状方面具有明显优势的适合稻田养殖的新品系。
