异亮氨酸对鳜mTOR信号通路及氮代谢影响
2018-09-13梁旭方汤树林
黄 康 梁旭方 何 珊 李 姣 汤树林 张 真
(1. 华中农业大学水产学院, 华中农业大学鳜鱼研究中心, 武汉 430070; 2. 淡水水产健康养殖湖北省协同创新中心, 农业部淡水生物繁育重点实验室, 武汉 430070)
蛋白质是生命体的物质基础, 是生命活动的主要承担者, 在鱼体中, 蛋白质是鱼体的重要组成成分, 占鱼体干重的65%—75%[1]。蛋白质作为鱼类代谢的主要能源物质之一, 在鱼体中代谢的终产物是氨氮, 其中蛋白质的代谢水平可以通过氨氮排泄间接反映[2,3]。因此, 在鱼体内可以通过氨氮的变化间接反映鱼体内蛋白质的转化利用情况[4,5]。目前对于影响鱼类氨氮排泄因子的研究主要集中在温度[6]、摄食[7]、饥饿[8]、鱼体大小[9]等方面, 而且也有通过长期饲喂添加单种氨基酸的饲料来研究氨氮排泄。此外, 在对虹鳟(Oncorhynchus mykiss)的研究发现, 短期内氨基酸通过激活雷帕霉素靶蛋白(mTOR)信号通路从而影响蛋白质、脂肪和糖类三大营养物质的代谢[10,11]。因此, 氨基酸与鱼类氨氮排泄之间的关系值得进一步的探究。
异亮氨酸(Isoleucine, Ile)又称为α-氨基-β-甲基戊酸, 首先是Ehrlich从甜菜糖浆中分离提取出来的,后来通过蛋白质水解得到, 由于和亮氨酸的化学组成相同而理化性质不同, 故称为异亮氨酸。异亮氨酸是鱼类维持生命活动的必需氨基酸, 对鱼类生产性能具有一定的影响, 饲料中适宜水平的异亮氨酸可以降低饵料系数, 提高增重和蛋白沉积水平[12—15]。异亮氨酸可作为激素、酶类等物质的合成原料, 而且在调控蛋白质代谢上发挥重要的生理功能, 是维持机体正常生长发育不可缺少的营养素。
雷帕霉素靶蛋白(mTOR)是磷酸肌醇-3-激酶相关的激酶家族的一种大分子、多结构域的丝氨酸/苏氨酸激酶。首先是在芽殖酵母对真菌毒素和免疫抑制剂雷帕霉素(Rapamycin)的抗性突变中发现的[16]。在机体细胞中, mTOR信号通路通过影响蛋白合成、脂类代谢和能量代谢等来调控细胞的生长和增殖[17]。研究发现营养素可以激活mTOR信号通路来调控蛋白质的合成, 相关研究主要集中在氨基酸对mTOR信号通路的影响。氨基酸可以直接或者间接作用于mTOR信号通路, 从而介导蛋白质的代谢[18,19]。在支链氨基酸中, 亮氨酸研究较为集中, 在人、猪、鼠和鱼类等不同物种中都有报道亮氨酸对mTOR信号通路的作用最为明显, 但是异亮氨酸对mTOR通路的研究相对较少[20—23]。
鳜(Siniperca chuatsi)隶属于鲈形目Perciformes、鲈亚科Sinipercinae, 俗称桂花鱼、桂鱼。鳜肉丰厚坚实, 味鲜肥腴, 是我国特有的久享盛誉的名贵淡水鱼, 经济价值高[24]。鳜从开口吃食起终身以活鱼虾为食, 是典型的肉食性凶猛鱼类[25]。本研究以鳜为研究材料, 通过脑室注射异亮氨酸对鳜氨氮排泄、关键氮排泄基因表达及肝脏中mTOR信号通路的影响, 解析异亮氨酸对鱼类代谢的影响, 丰富肉食性鱼类的蛋白质代谢研究的基础资料, 为开发鳜人工饲料提供理论依据。
1 材料与方法
1.1 实验鱼和养殖条件
实验用鳜来自于湖北武汉华中农业大学鳜鱼研究中心。实验前鳜暂养于华中农业大学循环水系统7d, 每天饱食投喂饵料鱼麦鲮(Cirrhinus mrigala)。水温维持在(25±0.4)℃, pH 6.8—7.2, 溶氧为6.5—6.8 mg/L, 光照周期为自然光照周期。
1.2 实验设计
在正式实验前, 鳜饥饿24h, 实验用的每个圆柱形塑料桶初始水体积为100 L, 并测定初始水体环境的氨氮含量。挑选150尾体质健康, 规格整齐的鳜(20.29±0.61) g随机分成2个组, 每个组3个平行,每个平行25尾。其中对照组注射5 μL的磷酸盐缓冲盐水(PBS), 实验组注射5 μL溶解的20 μg的异亮氨酸(Sigma, 美国), 本研究中注射异亮氨酸的剂量基于以前研究确定[26,27]。注射前将鳜用MS222(浓度为200 mg/L)麻醉, 然后称重。脑室注射(ICV)具体参照Pedro的方法[28]。将微量注射器针头从鳜的额骨和顶骨的中部连接处插入, 在注射结束后, 创口处涂抹凡士林, 并将已经注射的鳜放入清水中,待其恢复平衡和正常的游动活力后立即转移到之前准备好的实验用的圆柱形塑料桶中。在实验实施过程中, 实验组注射完毕后投喂足量的饵料鱼麦鲮(0.59±0.01) g, 分别统计注射后0.5h、4h、12h和24h各个时刻的摄食量。在实验组实验结束后, 对照组与实验组相同时刻开始注射, 注射完毕后, 以实验组各时间段饵料鱼摄食量为依据, 分别在注射后0、0.5h、4h和12h投喂与实验组相同量饵料鱼,实验过程中发现, 对照组各缸在各个时刻均无饵料鱼剩余, 可以保证本次实验中实验组和对照组鳜摄食相同量的饵料鱼。另外, 为了排除饵料鱼对水体氨氮的影响, 准备3个圆柱形塑料桶, 初始水体积为100 L, 并测定初始水体环境的氨氮含量, 各缸分别只投放实验中相同数量饵料鱼, 投放时间与鳜注射完毕后时间一致, 测定24h后水体氨氮浓度。
1.3 样品收集
在注射后0、0.5h、4h、12h和24h各时间点每缸取水样检测氨氮浓度, 每缸随机取5尾鳜进行麻醉, 待麻醉后, 分别尾静脉取血测定血液血糖含量,并取鳜肝脏组织用于检测蛋白表达和基因表达分析、肌肉组织用于检测基因表达, 样品采集完后立即液氮速冻并保存于–80℃超低温冰箱。
1.4 氨氮含量和血糖含量测定
氨氮含量的检测采用纳氏试剂比色法, 在多功能酶标仪(BioTek)上测定, 血糖含量用血糖仪(Accu-Chek Performa, Roche)测量。
1.5 基因表达分析
荧光定量引物设计 用Premier 5.0 软件设计荧光定量引物并由生工生物工程(上海)股份有限公司合成, 其中谷氨酸脱氢酶基因(Glutamate dehydrogenase,GDH)、腺苷酸脱氢酶基因(Adenosine monophosphate deaminase,AMPD)、谷草转氨酶基因(Glutamic oxaloacetic transaminase,GOT)及内参基因(ribosomal protein L13a,RPL13A)的引物序列见表1。

表1 荧光定量PCR所用引物序列Tab. 1 Primers used for real-time polymerase chain reaction(Real-Time PCR)
RNA提取提取注射后0、0.5h、4h、12h和24h时间点肌肉和肝脏RNA, 提取方法主要参照RNAiso Plus(TaKaRa, 日本)说明书操作, 提取出来的总的RNA用多功能酶标仪(BioTek)测定其浓度, 并根据OD260/OD280比值在1.7—2.1值判断RNA的质量。
RT-qPCR根据测得的RNA浓度计算所需总RNA量, 用PrimeScriptRTreagent Kit (Takara, 日本) 试剂盒进行反转录, 合成cDNA第一链。然后用AceQ®qPCR SYBR®Green Master Mix(诺唯赞, 南京)试剂进行Real Time PCR扩增反应, 其中反应体系为: 10 μL AceQ®qPCR SYBR®Green Master Mix、1 μL cDNA、0.4 μL Forward Primer (10 mmol/L)、0.4 μL Reverse Primer (10 mmol/L)、8.2 μL ddH2O。反应液的配制在冰上进行, 反应程序为:95℃, 30s; 95℃, 5s; 40×cycles; 58℃, 30s; 溶解曲线:65— 95℃, 每上升0.5℃ 停留 5s。
1.6 Western - Blot
称取适量肝脏样品, 冰上匀浆, 使用Ripa裂解液提取肝脏组织蛋白, 提取后的蛋白用BCA试剂盒测定蛋白浓度。使用Ripa裂解液稀释所得蛋白, 并加入5×蛋白上样缓冲液, 煮沸、离心。配置聚丙烯酰胺凝胶(浓缩胶10%), 浓缩胶中以80 V电压电泳,分离胶中以200 V电压电泳。以200 mA恒流电转2h, 电转装置放于冰水中进行转膜。转膜结束后用5%脱脂奶粉TBST溶液中封闭, 洗膜。一抗: βactin为1∶15000, P-S6为1∶4000, 4℃共孵育过夜; 二抗: 羊抗兔为1∶4000, 室温孵育1h, 洗膜。用双色红外激光成像系统(Odyssey Clx, 美国)成像, 成像完毕后得到相应的条带, 用ImageJ软件对条带进行灰度值分析。
1.7 数据分析
实验数据用平均值±标准误的形式表示, 用SPSS 19.0软件进行数据的统计分析, 2个样本之间的比较使用独立样本t检验, 多个样本之间的比较使用单因素方差分析 (ANOVA)。若P<0.05, 则具有显著差异。基因表达水平以鳜RPL13A为内参基因, 应用2–ΔΔCt公式确定基因的相对表达量[29]。
2 结果
2.1 脑室注射异亮氨酸对鳜氨氮排泄的影响
在实验过程中, 鳜脑室注射异亮氨酸后水体氨氮的变化如图1所示。水体氨氮的含量在24h内随着时间推移逐渐升高, 在注射后0.5h、4h、12h和24h这4个时刻, 脑室注射异亮氨酸组水体的氨氮浓度显著性高于对照组(P<0.05)。另外, 在实验水体中, 麦鲮对水体氨氮浓度的影响如图2所示。结果表明, 饵料鱼麦鲮24h内氨氮排泄对水体氨氮浓度没有显著性差异(P>0.05)。
2.2 脑室注射异亮氨酸对鳜mTOR信号通路的影响
在脑室注射异亮氨酸后, 鳜肝脏中mTOR信号通路的下游分子核糖体S6蛋白磷酸化(P-S6)水平的影响如图3所示。在注射12h和24h后, 注射异亮氨酸组与对照组相比, 肝脏P-S6磷酸化水平显著性升高(P<0.05)。
2.3 脑室注射异亮氨酸对AMPD、GDH、GOT基因表达的影响
鳜脑室注射异亮氨酸后24h内的变化如图4所示。在注射0.5h、4h、12h和24h后, 注射异亮氨酸组肌肉中AMPD基因相对表达量显著性高于对照组(P<0.05)。在注射异亮氨酸后, 肝脏中GDH基因相对表达量在注射4h和12h后显著性高于对照组(P<0.05), 并且在注射4h后, 相对表达显著性升高,随后下降, 相反的是, 对照组肝脏中GDH基因相对表达量在注射24h后开始显著性升高(P<0.05)。另外, 在注射异亮氨酸后, 肝脏中GOT基因相对表达量在0.5h、4h和12h后显著性高于对照组(P<0.05)。
2.4 脑室注射异亮氨酸对鳜血糖的影响
鳜脑室注射异亮氨酸对鳜血糖的变化如图5所示。在注射0.5h后, 注射异亮氨酸后血糖含量显著性高于对照组(P<0.05), 但是在注射4h后, 血糖含量显著性低于对照组(P<0.05)。
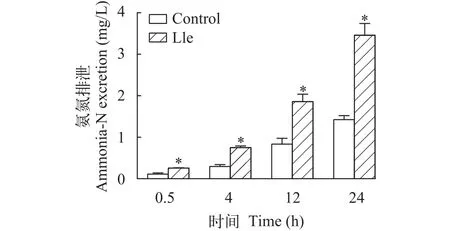
图1 脑室注射异亮氨酸对鳜氨氮排泄的影响Fig. 1 Effect of ICV injection of isoleucine on ammonia-N excretion of Chinese perch

图2 麦鲮氨氮排泄对水体氨氮浓度的影响Fig. 2 Effect of Cirrhinus mrigala on ammonia-N excretion on water (n=3)
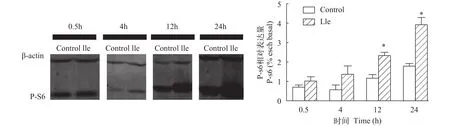
图3 脑室注射异亮氨酸对鳜肝脏P-S6蛋白表达分析Fig. 3 The expression of liver ribosomal protein S6 of Chinese perch after ICV injection of isoleucine

图4 脑室注射异亮氨酸对鳜AMPD、GDH和GOT基因表达的影响Fig. 4 The expression levels of AMPD, GDH and GOT of Chinese perch after ICV injection of isoleucine

图5 脑室注射异亮氨酸对鳜血糖的影响Fig. 5 Effect of ICV injection of isoleucine on glucose level of Chinese perch
3 讨论
鱼体内蛋白质代谢后产生最终的代谢废物氨氮, 主要通过鳃和尿液排出, 占淡水硬骨鱼类排泄总量的80%— 90%[30]。白小丽[31]从温度和摄食方面解析了鳜和草鱼氨氮排泄与蛋白质代谢之间的关系, 发现氨氮排泄随着蛋白质分解增加而增加。因此, 对鱼类氨氮排泄的研究可以更进一步理解鱼类蛋白质代谢的调节机制。在实验过程中通过检测发现饵料鱼麦鲮在24h内氨氮的排泄对水体氨氮浓度变化几乎没有影响(图2), 因此, 饵料鱼排泄的氨氮对水体氨氮没有影响。在本实验中, 水体氨氮的浓度可以在一定程度上反映鳜氨氮的排泄量。脑室注射异亮氨酸, 在24h内鳜氨氮排泄量显著性提高, 研究证明在鱼体中氨氮的排泄变化可以间接反映出氨基酸代谢变化[2,3], 因此, 异亮氨酸能够促进鳜氨氮排泄。该结果和涂永峰在鲫鱼的研究一致, 其结果表明异亮氨酸主要是通过影响鱼体蛋白质分解与合成的代谢水平从而促进鲫鱼氨氮的排泄[32]。
已有研究表明生物体内基因转录、蛋白质翻译和核糖体合成等生物过程都与mTOR信号通路密切相关[33]。在机体细胞中, mTOR信号通路能够响应细胞外营养素、生长因子等信号, 调节细胞的合成代谢和分解代谢[34]。大多数研究证明氨基酸作为重要的信号, 能够激活mTOR信号通路, 从而介导相应的生命活动[18,19]。在本研究中, 在注射异亮氨酸12h和24h后, 鳜肝脏mTOR信号通路下游PS6表达水平显著性升高, 表明异亮氨酸激活了鳜肝脏mTOR信号通路, 该结果与先前研究一致, 异亮氨酸能够激活mTOR信号通路[35,36]。mTOR信号通路下游分子通过调控机体中蛋白合成、脂类代谢和能量代谢的蛋白的合成来调节相应的生命活动。因此, 异亮氨酸激活鳜肝脏mTOR信号通路,促使其下游核糖体蛋白S6磷酸化, 调控机体相应的蛋白的合成, 从而影响了氨基酸代谢。
肝脏是鱼体代谢活动的主要器官, 在氨基酸代谢过程中发挥重要作用。谷氨酸脱氢酶(GDH)主要存在于肝脏中, 是氨基酸分解代谢关键酶, 在氨基酸分解代谢以及维持体内氨氮水平方面起着关键作用[37]。在哺乳动物和硬骨鱼类的肌肉中,AMPD活性较高, 主要参与调控嘌呤核苷酸循环和能量代谢[38,39]。天冬氨酸转氨酶(GOT)是碳水化合物和蛋白质代谢的纽带[40], 参与联合脱氨作用产生氨[41]。机体内氨基酸代谢过程中的转氨基和脱氨基作用起到主要作用的是谷氨酸脱氢酶和腺苷酸脱氨酶,另外辅助转氨基的主要关键酶有天冬氨酸转氨酶。在脑室注射异亮氨酸0.5h后,GOT和AMPD基因的相对表达量较对照组显著性升高, 而GDH基因变化不大, 表明肌肉中AMPD基因调控了嘌呤核苷酸循环[41], 氧化分解生氨活跃, 另外,GOT基因调控了谷氨酸与草酰乙酸反应生成天冬氨酸, 天冬氨酸参与联合脱氨基作用产生氨[41], 因此, 两者共同作用促进机体氨氮生成。在注射异亮氨酸4h和12h后,GDH、GOT和AMPD基因相对表达量显著性高于对照组, 三者共同促进氨基酸代谢, 从而促进机体产生氨。此外, 在注射异亮氨酸24h后, 肌肉中AMPD基因相对表达量显著性高于对照组, 而肝脏中GDH和GOT基因相对表达量较对照组没有显著性变化, 表明肌肉中嘌呤核苷酸循环, 氧化分解仍然活跃, 促进肌肉产生氨。通过注射异亮氨酸后比较鳜肝脏中GDH和GOT基因相对表达量随时间变化发现,GOT基因相对表达量随时间变化无明显差异, 而GDH基因相对表达量在4h显著性升高, 随后开始下降, 在24h降到最低, 相反的是对照组GDH基因相对表达量在24h显著性升高。因此, 肝脏中氨基酸分解代谢活动随时间变缓, 是由于在异亮氨酸的作用下, mTOR信号通路激活, 促使下游信号通路分子核糖体S6蛋白磷酸化, 蛋白合成增加, 影响到肝脏中氨基酸代谢, 氨基酸分解代谢减弱。先前类似研究发现, 支链氨基酸可以调节机体各种功能,很容易穿过血脑屏障, 在能量代谢和氮代谢中起到很重要的作用[42,43]。异亮氨酸作为支链氨基酸, 在大鼠的研究发现, 异亮氨酸可以调节GDH从而影响代谢活动[44]。在细胞上的研究也发现, 氨基酸作为信号, 促使mTOR信号通路下游信号分子磷酸化,进而通过氧化脱羧和激活GDH活性调节线粒体代谢, 从而精准的调控细胞生命活动[45,46]。氨基酸不仅是细胞信号分子, 而且是基因表达和蛋白磷酸化级联反应的调节因子[47], 可通过mTOR信号通路调节其下游分子的磷酸化, 进而从翻译水平调节基因表达[48]。在本实验中, 异亮氨酸作为信号分子, 促使肝脏mTOR信号通路下游核糖体蛋白S6磷酸化,调节了鳜氮排泄基因的表达, 从而影响了鳜氨氮排泄。
近年来研究发现, 氨基酸参与血糖的代谢调控,通过检测血液葡萄糖含量发现, 在脑室注射异亮氨酸后, 鳜血糖含量在0.5h显著性降低, 表明异亮氨酸有降低血糖含量作用。在对小鼠进行研究发现, 小鼠口服异亮氨酸, 在0.5h和1h后, 血糖含量显著性降低, 异亮氨酸主要是通过刺激肌糖原的合成和促进机体对葡萄糖的氧化, 从而降低血糖的水平[49], 并且这种作用机制主要是通过位于mTOR上游的PI3K(磷脂酰肌醇-3-激酶)信号传导通路介导完成的[50]。相关研究发现, 激素和生长因子可活化PI3K(磷脂酰肌醇3激酶), 通过相应的调节机制, 从而促使mTOR通路相关蛋白磷酸化[51]。此外, 在注射异亮氨酸4h后, 鳜血糖含量开始升高并且显著性高于对照组, 可能异亮氨酸降低血糖作用具有时效性, 在短期内异亮氨酸有降低血糖的作用。随着时间推移, 机体其他代谢作用加强从而血糖含量升高,具体作用途径有待进一步探究。
综上所述, 在本研究中, 脑室注射异亮氨酸后,激活鳜肝脏mTOR信号通路, 介导氨基酸代谢, 氮排泄基因转录水平升高, 鳜肝脏和肌肉中代谢活跃,促使鳜氨氮排泄。此外, 异亮氨酸能够短时间内降低血糖, 可能与PI3K(磷脂酰肌醇-3-激酶)信号传导通路相关, 异亮氨酸在mTOR信号传导通路与PI3K信号传导通路之间的联系仍需进一步的研究。
