蝴蝶兰2种病毒的同步检测及其CP融合反义表达载体构建
2018-09-11邓祖丽颖许申平
梁 芳, 邓祖丽颖, 许申平, 张 燕, 崔 波*
(1.郑州师范学院 生物工程研究所,河南 郑州 450044;2.郑州幼儿师范高等专科学校,河南 郑州 450000)
【研究意义】蝴蝶兰(Phalaenopsishybrid)是一类原产于热带亚热带地区的附生兰科植物,是世界花卉产业中最重要的经济作物之一。因其较长的花期、丰富的色彩、优美多样的花型及高雅的花姿而受到广大人民的喜爱[1]。市面上出售的蝴蝶兰多是采用组织培养方法繁殖,由于长期进行无性繁殖,使得蝴蝶兰病毒积累严重,这不仅使其观赏价值大大降低,相关企业也因此遭受大量的经济损失。因此,及时对蝴蝶兰瓶苗进行快速检测对防治病毒大范围扩散起着重要作用;同时,利用现代生物技术手段培育抗病毒品种也是育种工作的重要研究内容。【前人研究进展】据报道,可感染兰花病毒至少有20多种,其中建兰花叶病毒(Cymbidiummosaicvirus,CyMV)和齿兰环斑病毒(Odontoglossumringspotvirus,ORSV)是感染最普遍危害最严重的2种兰花病毒[2-3],这2种病毒在世界范围内广泛传播。CyMV属于马铃薯X病毒属(Potexvirus),基因组由6.3 kb(+)ssRNA组成,其基因结构与同属其他病毒具有很高的同源性[4]。感染CyMV的植株生长减缓,叶片出现黄色环斑或坏死斑,感病花朵褪色畸形[2]。ORSV隶属于烟草花叶病毒属(Tobamovirus),基因组为(+)ssRNA,其外壳蛋白基因的ORF长度为477 bp,编码158个氨基酸残基。病毒颗粒呈杆状,无包被,基因组与TMV(Tobacco mosaic virus)相似[1]。ORSV在盆栽基质中可存活很长时间[5],ORSV感染可导致植株叶片出现条纹花斑,受感染的花朵出现彩色环斑及褪色[2]。在生产中,二者常常复合感染,给兰花产业造成严重的后果,由CyMV及ORSV引起的病毒病现已成为影响我国蝴蝶兰产业健康发展的最主要病害。这些病毒主要通过在植株移栽及花卉采收过程中使用被污染的工具而传播[4,6]。研究表明,CyMV及ORSV的变异不具有地域特异性,其CP基因序列的高度保守性为兰花抗病毒育种提供了可信的途径[4, 7-8]。反义RNA是指能与靶RNA通过碱基互补原则进行配对的RNA分子。反义RNA使病毒基因在宿主细胞内的复制受到阻抑而无法表达,进而达到防御病虫害的作用。反义RNA技术在植物基因工程领域已得到广泛的应用,比如:控制果实成熟[9-10]、增强植物抗病性[11-13]、改变花卉颜色[14]等。【本研究切入点】利用反义RNA技术将病毒CP基因导入寄主植物提高抗病性的方法已有部分研究[15]。2004年,台湾Li-Jen Liao和Yuan-Li Chan等将CyMV的CP基因导入蝴蝶兰中,获得具有抗病性的蝴蝶兰植株[16-17]。Kamo等将BYMV(Bean yellow mosaic virus)的CP基因分别以正向和反向插入唐菖蒲基因组中,研究表明转基因植株均延迟了BYMV的感染[18]。【本文切入点】本研究首先利用RT-PCR法对12株蝴蝶兰样品进行病毒检测,然后利用反义RNA技术将克隆到CyMV和ORSV的CP基因反向插入到表达载体pCAMBIA1300中,通过农杆菌侵染蝴蝶兰原球茎,【拟解决的关键问题】以期培养出能对CyMV和ORSV具有抗性的蝴蝶兰新品种。
1 材料与方法
1.1 植物材料
本实验所用的12株蝴蝶兰来自郑州师范学院的人工智能温室,取新鲜叶片迅速投入液氮中速冻后放-80 ℃超低温冰箱中保存备用。
1.2 RNA的获得与cDNA第1链的合成
用Trizol法提取蝴蝶兰叶片总RNA,利用RevertAid First Strand cDNA Synthesis Kit试剂盒进行反转录合成cDNA第1链,作为PCR克隆的模板。
1.3 引物设计
根据NCBI上已登录的CyMV和ORSV的CP基因序列,以DNAMAN比对为基础,利用Primer Premier 6.0软件在两端保守区分别设计一对引物(CyMV-F1、CyMV-R1和ORSV-F1、ORSV-R1),运用RT-PCR扩增CP基因的方法进行病毒的检测;得到序列后再分别设计一对引物扩增CP基因小片段用于构建融合表达载体(CyMV-F2、CyMV-R2和ORSV-F2、ORSV-R2)。根据表达载体pCAMBIA1300上酶切位点的种类及位置,在CyMVCP基因小片段引物的两端添加SalI和PstI酶切位点,在 ORSVCP基因引物的两端添加PstI和XbalI酶切位点(表1下划线部分)。

表1 蝴蝶兰2种病毒CP基因引物设计
1.4 2种病毒的RT-PCR同步检测
以cDNA第1链为模板,利用引物CyMV-F1、CyMV-R1和ORSV-F1、ORSV-R1首先分别对目的基因进行扩增,反应体系如下:10×PCR buffer 2.0 μl、dNTPs(2.5 mmol/L) 1.6 μl、正反向引物各1.0 μl、cDNA模板1.0 μl、rTaqDNA聚合酶0.2 μl,ddH2O补充至20.0 μl。然后对目的片段进行同步克隆检测,方法同上,反应体系中同时加入2对引物。
PCR产物用1 %琼脂糖凝胶电泳检测,将正确片段进行回收纯化后与pGEM-T easy载体连接并转化大肠杆菌感受态细胞DH5α,经2次菌落PCR鉴定均为阳性者送出测序。
1.5 2种病毒CP反义融合表达载体的构建
1.5.1CP基因片段的克隆 2种病毒CP基因小片段的克隆方法同上,克隆产物用2 %的琼脂糖凝胶进行电泳检测,电压50 V,电泳80 min后染色照胶。将位置正确的片段进行凝胶回收纯化后,与克隆载体pGEM-T easy进行连接转化大肠杆菌DH5α。经2次菌落PCR检测均为阳性者送出测序。
1.5.2 CyMV-CP与pCAMBIA1300载体的连接 采用普通质粒小提试剂盒(天根)从阳性菌液中提取含CyMV-CP基因片段的质粒(命名为pGEM-CyMV),同时提取pCAMBIA1300质粒。将质粒pGEM-CyMV及载体pCAMBIA1300分别进行双酶切,酶切体系如下:10×H buffer 1.5 μl,0.1 % BSA 1.0 μl,SalI/PstI内切酶各0.5 μl,pGEM-CyMV或pCAMBIA1300 6.5 μl。37 ℃酶切4~5 h。电泳检测酶切产物是否正确,将pGEM-CyMV的酶切产物小片段及pCAMBIA1300酶切产物的大片段进行切胶回收,电泳检测位置及浓度。然后将回收的目的基因CyMV-CP与载体pCAMBIA1300的大片段进行连接转化,连接体系如下:10×T4 DNA Ligase buffer 2.5 μl,T4 DNA Ligase 1.0 μl,0.1 % BSA 1.0 μl,CyMV-CP8.0 μl,pCAMBIA1300 12.0 μl。16 ℃过夜连接。将连接产物转化入DH5α感受态细胞,单菌落经过2次PCR鉴定后,仍为阳性者提取质粒后进行SalI/PstI双酶切鉴定,酶切鉴定体系如下:10×H buffer 1.5 μl,0.1 % BSA 1.0 μl,SalI/PstI内切酶各0.5 μl,阳性质粒 6.5 μl。用凝胶电泳检测酶切产物的位置来判断双酶切鉴定的结果,酶切鉴定结果正确的菌液及质粒将其命名为pCAMBIA1300-CyMV。
1.5.3 ORSV-CP与pCAMBIA1300-CyMV的连接 将含ORSV-CP基因片段的质粒(命名为pGEM-ORSV)及构建好的pCAMBIA1300-CyMV质粒分别进行双酶切,酶切体系如下:10×M buffer 1.5 μl,0.1 %BSA 1.0 μl,PstI/XbalI内切酶各0.5 μl,pGEM-ORSV或pCAMBIA1300-CyMV 6.5 μl。对酶切产物进行电泳检测,将pGEM-ORSV酶切产物的小片段和pCAMBIA1300-CyMV酶切产物的大片段进行切胶回收。然后将回收的ORSV-CP基因片段与载体pCAMBIA1300-CyMV进行连接转化,连接体系如下:10×T4 DNA Ligase buffer 2.5 μl,T4 DNA Ligase 1.0 μl,0.1 % BSA 1.0 μl,ORSV-CP8.0 μl,pCAMBIA1300-CyMV 12.0 μl。
1.5.4 融合表达载体的鉴定 将ORSV-CP与载体pCAMBIA1300-CyMV的连接产物转化入DH5α感受态细胞,挑取单菌落,用CyMV-F2、CyMV-R2和ORSV-F2、ORSV-R2以及CyMV-F2、ORSV-R2 3对引物分别进行菌落PCR鉴定。对阳性菌液提取质粒,对所提质粒再进行XbalI/SalI双酶切鉴定,用于检测所构建的表达载体中外源基因的大小。酶切鉴定体系如下:10×T buffer 1.5 μl,0.1 % BSA 1.0 μl,XbalI/SalI内切酶各0.5 μl,阳性质粒6.5 μl。用凝胶电泳检测PCR产物及酶切产物的位置来判断鉴定结果,经PCR检测及酶切检测均正确的质粒命名为pCAMBIA1300-CyMV-ORSV。
2 结果与分析
2.1 蝴蝶兰2种病毒的同步检测
用RT-PCR克隆病毒外壳蛋白基因的方法检测12株蝴蝶兰样品,首先分别检测CyMV和ORSV病毒。CyMV检测结果如图1A所示,12个样品中,仅1号样品未克隆出目的条带,6号样品条带较淡,其他10个样品均出现明显的条带,与预期的689 bp基因片段位置相符;图1B所示为ORSV检测结果,仅4、5和10号克隆出目的条带,与预期的477 bp基因片段位置相符,其他样品未检测出目的条带。将克隆出的目的片段进行TA克隆,阳性转化子送出测序,测序结果经NCBI上分析比对,CyMV的基因序列与已登录的其他CyMV的CP基因序列同源性最高为99 %[19]。ORSV的测序结果与已登录的其他ORSV的CP基因序列同源性最高为100 %,与珠海分离物ZH2(KF836086)的序列完全相同,表明克隆出的目的条带正确,登录到GenBank上,登录号为KU873002。

M.DL2000 DNA marker;1~12.样品编号M.DL2000 DNA marker;1-12.Sample number图1 蝴蝶兰CyMV(A)及ORSV(B)的RT-PCR检测Fig.1 Detection of CyMV (A) and ORSV (B) from Phalaenopsis by RT-PCR method

M.DL2000 DNA marker;4,5,10.样品编号M.DL2000 DNA marker; 4,5,10.Sample number图2 蝴蝶兰CyMV和ORSV的同步检测Fig.2 Simultaneous detection of CyMV and ORSV from Phalaenopsis
由图1表明,4、5和10号有可能同时感染了CyMV和ORSV病毒。将CyMV和ORSVCP基因引物同时加入PCR反应体系中,以4、5和10号样品cDNA为模板同时检测2种病毒,结果如图2所示,在相应的位置均出现明亮且单一的条带。
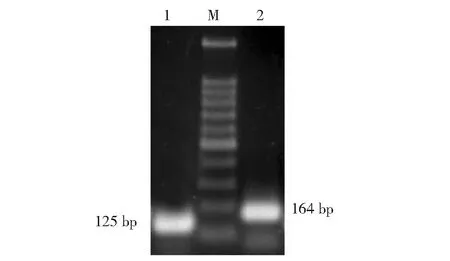
M.100 bp DNA ladder marker;1.CyMV CP基因克隆;2.ORSV CP基因克隆M.100 bp DNA ladder marker;1.CP gene cloning of CyMV;2.CP gene cloning of ORSV图3 CyMV及ORSV CP基因克隆Fig.3 CP genes cloning of CyMV and ORSV

1,3.pGEM-CyMV未切;2,4.pGEM-CyMV已切;5,7.pCAMBIA1300未切;6,8.pCAMBIA1300已切;M.DL15000 DNA marker1,3.Not be digested of pGEM-CyMV;2,4.Digested of pGEM-CyMV;5,7.Not be digested of pCAMBIA1300;6,8.Digested of pCAMBIA1300;M.DL15000 DNA marker图4 pGEM-CyMV及pCAMBIA1300双酶切图Fig.4 Double digestion of pGEM-CyMV and pCAMBIA1300
2.2 蝴蝶兰2种病毒CP基因片段的克隆
如图3所示,利用CyMV-F2、CyMV-R2和ORSV-F2、ORSV-R2 2对引物分别对目的基因进行PCR扩增。CyMV和ORSV的克隆产物分别在100~200 bp之间有一条明亮的条带,和预期的125和164 bp的目的片段大小相吻合。将PCR产物凝胶回收后进行TA克隆,通过对阳性菌液测序可知克隆的目的片段正确。
2.3 CyMV-CP基因与pCAMBIA1300载体的连接
将提取的pCAMBIA1300和含有CyMV-CP基因的质粒pGEM-CyMV用SalI/PstI双酶切。酶切如图4所示:pCAMBIA1300质粒酶切后,只有1个大条带,回收该大片段; pGEM-CyMV质粒酶切后,显示2个大小不同的条带,回收125 bp的小片段。将2个回收的片段连接转化后,进行菌落PCR鉴定,在125 bp的地方出现目的条带(图5),证明目的基因CyMV已经成功插入pCAMBIA1300载体之中。将阳性菌落扩摇后提取质粒,命名为pCAMBIA1300-CyMV。

M.DL2000 DNA marker;1,2,3.菌落PCR克隆产物M.DL2000 DNA marker; 1,2,3.PCR production of clones图5 pCAMBIA1300-CyMV菌落PCR鉴定Fig.5 Identification of pCAMBIA1300-CyMV clones

M.DL15 000 DNA marker;1.pCAMBIA1300-CyMV未切;2.pCAMBIA1300-CyMV已切;3.pGEM-ORSV未切;4.pGEM-ORSV已切M.DL15 000 DNA marker; 1.Not be digested of pCAMBIA1300-CyMV; 2.Digested of pCAMBIA1300-CyMV; 3.Not be digested of pGEM-ORSV; 4.Digested of pGEM-ORSV图6 pCAMBIA1300-CyMV及pGEM-ORSV双酶切图谱Fig.6 Double digestion of pCAMBIA1300-CyMV and pGEM-ORSV
2.4 ORSV和pCAMBIA1300-CyMV的连接及鉴定
将重组质粒pCAMBIA1300-CyMV和含有ORSV-CP基因的质粒pGEM-ORSV用XbalI/PstI双酶切,回收pCAMBIA1300-CyMV酶切后的大片段和pGEM-ORSV的164 bp小片段(图6)。用T4 DNA连接酶连接转化后,挑取单菌落,用CyMV-F2、CyMV-R2和ORSV-F2、ORSV-R2以及CyMV-F2、ORSV-R2 3对引物分别进行菌落PCR鉴定,如图7所示,分别在125、164和289 bp地方出现目的条带。挑斑扩摇后提取质粒,用SalI/XbalI进行双酶切,得到了约289 bp的小条带和1个大条带(图8),和预期结果一致。结果证明目的基因ORSV和CyMV的CP基因片段均已正确插入pCAMBIA1300载体之中,将鉴定正确的质粒命名为pCAMBIA1300-CyMV-ORSV。
3 讨 论
建兰花叶病毒和齿兰环斑病毒复合侵染兰科植物的现象非常普遍。同时检测两种或多种病毒的RT-PCR技术已有许多成功的报道[20-21]。该技术的关键在于设计合适的引物,在保证引物特异性的前提下,避免引物之间的互作干扰。本文鉴于病毒的变异性及多样性,在CP基因序列的高度保守区设计引物。实验结果证明,设计的引物通过PCR克隆产物条带单一,将两对不同引物加入同一个PCR反应体系中,克隆产物也很明亮无拖尾,且无多余条带,表明两对引物之间互不干扰,且能正确克隆出目的条带,此双重PCR检测方法并不需要特殊的实验条件,即可快速准确检测出兰花植株体内是否含有CyMV或ORSV病毒。本研究在蝴蝶兰温室大棚内挑选具有疑似病毒症状的12个植株作为检测对象,结果表明,几乎所有的植株均感染了CyMV病毒,其中25 %既感染了CyMV,同时感染了ORSV病毒。这些复合感染的植株往往症状较重,叶片环状腐烂,危害严重。

M.DL15 000 DNA marker;1.CyMV-CP基因扩增产物;2.ORSV-CP基因扩增产物;3.CyMV和ORSV 2个CP基因扩增产物M.DL15 000 DNA marker; 1.PCR production of CyMV-CP; 2.PCR production of ORSV-CP; 3.PCR production of CyMV-CP and ORSV-CP图7 pCAMBIA1300-CyMV-ORSV菌落PCR鉴定Fig.7 Identification of pCAMBIA1300-CyMV-ORSV clones
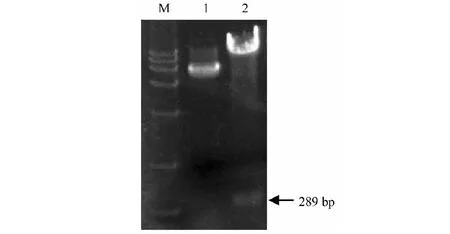
M.DL15 000 DNA marker;1.pCAMBIA1300-CyMV-ORSV未切;2.pCAMBIA1300-CyMV-ORSV已切M.DL15 000 DNA marker; 1.Not be digested of pCAMBIA1300-CyMV-ORSV; 2.Digested of pCAMBIA1300-CyMV-ORSV图8 pCAMBIA1300-CyMV-ORSV双酶切Fig.8 Double digestion of pCAMBIA1300-CyMV-ORSV
本次试验中,双酶切作为一个中间环节极为重要。特别是双酶切的时间需要很好的把握,时间过长,质粒易降解,电泳结果呈现弥散状态;时间过短不能将质粒充分酶切。而且不同的酶所需时间有所差异。本试验中,为了使酶切充分,一般可酶切过夜,对酶切产物无明显影响,但是PstI酶过夜导致产物电泳无可见单一条带,表明时间过长可能使质粒降解。因此,改为酶切4~5 h,则可得到单一明亮的条带。
本文采用改造过的pCAMBIA1300作为表达载体,在pCAMBIA1300的基础上,加上了一个超表达启动子Super promoter和GFP序列。启动子下游(5’→3’方向)分别为XbaI、PstI、SalI等酶切位点,通过分析发现在目的序列中均没有这3个酶切位点,故挑选这3个酶切位点进行外源基因的插入。根据反义RNA的设计原则,先将CyMV-CP基因反向插入到PstI和SalI位点,经2次菌落PCR检测均能克隆到明亮的125 bp的条带,表明CyMV-CP基因成功插入到表达载体pCAMBIA1300上。然后,再切开XbaI与PstI位点,将ORSV-CP基因反向插入到携带有CyMV-CP基因的pCAMBIA1300上,插入的外源基因经过双酶切鉴定,可得到约289 bp的片段,表明CyMV-CP与ORSV-CP基因均正确插入到pCAMBIA1300上。构建的反义融合表达载体pCAMBIA1300-CyMV-ORSV转化农杆菌后侵染蝴蝶兰原球茎,是否可有效增强蝴蝶兰植株对CyMV及ORSV病毒的抵抗力及减轻感染病毒症状还有待进一步验证。
4 结 论
所设计的2对特异性引物能够在同一PCR反应体系中快速高效地检测出CyMV和ORSV,克隆产物清晰明亮无非特异性条带,此方法可用于兰花病毒的快速检测。将克隆出的CyMV和ORSVCP基因小片段与载体pCAMBIA1300连接构建的融合反义表达载体pCAMBIA1300-CyMV-ORSV,经菌落PCR和酶切鉴定表明融合反义基因已成功插入到载体中。
