A/O型FMDV多抗原表位融合基因植物表达载体构建及转化柱花草的研究
2018-09-11肖旭倩胡正龙沈文涛王冬梅
肖旭倩,胡正龙,沈文涛,言 普,王冬梅,周 鹏*
(1.中国热带农业科学院 热带作物生物技术研究所 农业部热带作物生物技术重点实验室,海南 海口 571101; 2.万博科技职业学院生物与环境系,安徽合肥 230001;3.合肥市国正资产经营有限公司,安徽 合肥 230001;4.广西农业科学院,广西 南宁 530007 )
【研究意义】口蹄疫(Foot and Mouth Disease FMD)是由口蹄疫病毒(Foot-and-mouth disease virus FMDV)感染引起的偶蹄动物共患的急性、热性、高度接触性传染病,被国际兽医局列为头号A类传染病[1],由于口蹄疫爆发快、传播广,对当地畜牧业影响较大,经济损失严重,我国在《 国家中长期动物疫病防治规划(2012-2020年)》中将其列为一类优先防治动物疫病。目前防治口蹄疫的主要方法是接种疫苗,但其弊端也非常明显,如接种操作繁琐费用较高、疫苗易散毒、病毒毒力返强,因此寻找安全方便、成本低廉、抗多种病毒的基因工程疫苗成为研究热点。而转基因可饲性植物疫苗因免疫方式简单、成本低廉、储存方便等特点最具优势[2-5]。 【前人研究进展】目前对FMDV表位基因疫苗研究较多,而针对同型与异型口蹄疫病毒的不同多表位基因组合以及何种组合免疫效果最佳的研究报道较少[6-14]。【本研究切入点】本研究以A/O型FMDV多个B/T细胞抗原表位融合基因串联构建的中间载体为基础[15],构建不同组合的植物表达载体农杆菌工程菌株,侵染豆科牧草热研二号柱花草(Stylosanthesguianensiscv.ReyanⅡ),获得不同组合的转基因植株,【拟解决的关键问题】为研究同型与异型FMDV之间多表位基因的不同融合方式的免疫原性及免疫效果奠定基础。
1 材料与方法
1.1 供试材料
菌株、质粒与植物材料:常规克隆宿主菌DH5a、农杆菌EHA105及质粒pBI121为实验室保存;中间载体(pMD-xsB/pMD-xsT/pMD-xsBT/pMD-xsBTT )为实验室构建。热研2号柱花草种子由中国热带农业科学院热带品种资源研究所惠赠。
主要试剂及培养基[16]:Klenow酶、T4 DNA连接酶为TaKaRa产品;High Fidelity PCR Enzyme Mix、限制性内切酶为Fermentas产品;E.Z.N.A. Gel Extraction Kit, Plasmid Mini Kit为OMEGA产品。M1:MS固体培养基,种子发芽及继代培养基;M2:MS液体培养基,侵染液配制培养基;M3:M1+6-BA4.0 mg/L+ NAA1.0 mg/L,诱导子叶出愈伤组织和分化培养基;M4:M1+ NAA1.0 mg/L生根培养基。
引物:W1:5’-acTCTAGAATGTCCGGAACCGATGGCCCAAG-3’;W2:5’-cgGAGCTCTCATTATCCATTTGGAAGGGTTCTTG-3’;W3:5’-acTCTAGAATGTCCGGAGCAGCAATTGAGT-3’;W4:5’-cgGAGCTCTCATTATCCATTGCTGGTGGTATCG-3’;p1211:5’-GACGCACAATCCCACTATCC-3’(距离目的基因5’端约80bp);p1212:5’-GTAAAACGACGGCCAGTG-3’(距离目的基因3’端约280bp)。为便于后期载体构建引入XbaⅠ(下划线所示)和SacⅠ(波浪线所示)酶切位点,所有基因合成及测序由宝生物(大连)公司完成。
1.2 试验方法
1.2.1 重组农杆菌工程菌株的构建 用限制性内切酶XbaI和SacI酶切去除植物表达载体pBI121和中间载体pMD-xsB/ pMD-xsT/pMD-xsBT/pMD-xsBTT,分别回收相应片段连接转化DH5a后,在Kanamycin(卡那霉素,Kan )50 μg/mL的LB平板上培养筛选,提取质粒做双酶切鉴定,4种阳性克隆送公司测序。采用直接转化法[17]分别将4种重组植物表达载体转化农杆菌EHA105感受态,在含Rifampicin(利福平,Rif)25 μg/mL,Streptomycin(链霉素,Str )25 μg/mL,Kan 50 μg/mL的平板上筛选,提取质粒后进行PCR鉴定(引物对p1211-p1212 )及XbaI、SacI酶切鉴定。
1.2.2 热研2号柱花草的遗传转化 ①柱花草外植体的获得及预处理。按照文献[16]的方法处理培养柱花草种子,待无菌苗抽出2片真叶,剪下子叶切成0.5 cm2见方的小块作为外植体材料。将切好的外植体材料放在M3平板上黑暗预培养2 d。②柱花草抗性敏感试验。将柱花草外植体和柱花草无根单株分别接种在含Kan的M3和M4培养基平板中,Kan的浓度分别为0、10、20、30、40、50、60 mg/L。根据出芽、生根和死亡情况来确定最佳选择压力。③农杆菌侵染液的制备及转化。挑取重组农杆菌单菌落,接种于10 mL附加有Kan 50 mg/L、Rif 25 mg/L、Str 25 mg/L的LB液体培养基中,28 ℃,200 r/min摇床振荡培养(培养条件同下)至OD600=1.0时,吸取200 μl菌液加到10 mL 液体LB培养基中培养至OD600=0.4~0.6左右时,吸取1 mL菌液注入1.5 mL离心管中,5000 r/min离心2 min,弃去上清,用等体积M2重悬菌体细胞后,再将重悬后的菌液稀释至OD600约0.1,即为转化用的侵染液。将经预培养的外植体投入装有20 mL侵染液的三角瓶中,轻摇浸泡3 min,倒掉菌液,侵染后的叶盘放到铺有滤纸的M3培养基平板上,28 ℃黑暗共培养2 d后转移到含有Kan和Carbenicillin(羧苄青霉素,Carb)400 mg/L的M3培养基平板上。转接2~3次,逐渐去除培养基中的Carb,选择生长健壮的芽进行继代及Kan的抗性筛选。将经3次继代抗性筛选仍然生长正常的株系接种在含有Kan的M4培养基平板中,诱导根的形成及进一步的抗性筛选。④柱花草转化植株的筛选检测。A.特异引物PCR检测。提取抗性植株基因组DNA进行PCR检测。引物对W1-W2扩增转pBI-xsB的抗性植株基因组DNA,W3-W4扩增转pBI-xsT的抗性植株基因组DNA,W1-W4扩增转pBI-xsBT和pBI-xsBTT的抗性植株基因组DNA。B.转基因检测引物PCR扩增。分析测试中心提供的转基因植物检测引物35SF1在启动子35S 3’端,引物NOSR1在终止子NOS的5’端,实验构建的4种重组植物表达载体中目的片段位于CaMV35S启动子和NOS终止子之间,用该引物对上述检测为阳性的植株DNA再次进行PCR扩增,最大限度降低初步筛选的假阳性。C.RT-PCR检测。采用Promega公司产品核酸自动提取纯化仪MaxwellTM16和配套试剂盒MaxwellTM16 Total RNA Purification Kit,提取上述实验中PCR都为阳性的转化株材料RNA,再通过反转录试剂盒TaKaRa RNA Kit(AMV) Ver.3.0进行RT-PCR,PCR产物进行1.2 %凝胶电泳分析。

Lane M: DL2000 DNA marker; Lane M1: DL15 000 DNA marker; Lane 1: The plasmid pMD-xsB digested by Xba I and Sac I; Lane 2: The plasmid pMD-xsT digested by Xba I and Sac I; Lane 3: The plasmid pMD-xsBT digested by Xba I and SacI; Lane 4: The plasmid pMD-xsBTT digested by Xba I and Sac I; Lane 5: The plasmid pBI121 digested by Xba I and Sac I图1 中间载体质粒pMD-xsB、pMD-xsT、pMD-xsBT、pMD-xsBTT和pBI121双酶切Fig.1 pMD-xsB / pMD-xsT/ pMD-xsBT / pMD-xsBTT and pBI121 double digested by Xba I and Sac I
2 结果与分析
2.1 重组植物表达载体的构建
利用限制性内切酶XbaI和SacI酶切切除植物表达载体pBI121上约2.1 kb的GUS基因(图1泳道5),电泳后回收pBI121载体大片段,同时酶切质粒pMD-xsB/pMD-xsT/ pMD-xsBT/pMD-xsBTT,酶切产物电泳后出现约186、357、528、870 bp目的片段。将各目的片段与载体大片段连接转化后用载体引物p1211-p1212 PCR鉴定重组植物表达载体,凝胶电泳后出现约550、720、890和1230 bp目的带(图2),送测结果表明此重组植物表达载体构建正确,成功获得pBI-xsB/pBI-xsT/pBI-xsBT/pBI-xsBTT 4个不同组合重组植物表达载体。
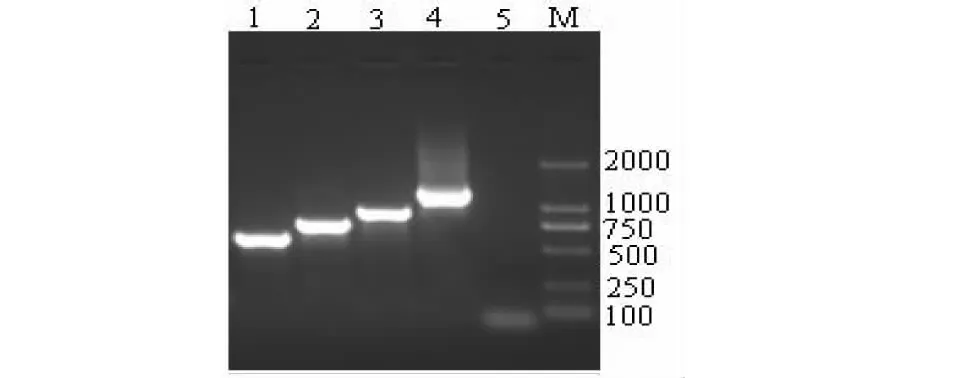
Lane M: DL2000 DNA marker; Lane 1: pBI-xsB;Lane 2: pBI-xsT; Lane 3: pBI-xsBT; Lane 4: pBI-xsBTT; Lane 5: The negative control图2 PCR鉴定植物表达载体Fig.2 Identification of the plant expression vectors by PCR in E.coli DH5α
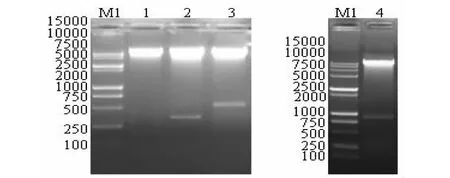
Lane M1:DL15000 DNA marker; Lane 1: pBI-xsB digested by Xba I and Sac I; Lane 2: pBI -xsT digested by Xba I and Sac I; Lane 3: pBI-xsBT digested by Xba I and Sac I; Lane 4: pBI-xsBTT digested by Xba I and Sac I图3 酶切鉴定植物表达载体Fig.3 Identification of the plant expression vectors by enzymes digestion
2.2 农杆菌工程菌株的构建
采用直接转化法将重组植物表达载体质粒转化农杆菌株EHA105,提取转化重组的农杆菌质粒进行XbaI和SacI双酶切鉴定,能切下相应片段(图3)。从结果分析,成功获得了4种含重组植物表达载体的农杆菌工程菌株。
2.3 柱花草Kan抗性敏感试验
培养15 d后,不同Kan浓度对柱花草子叶叶盘出愈、分化和无根单株生根有不同的抑制作用。在对照组培养基上叶盘被诱导出大量愈伤组织并分化出芽,随Kan浓度的增加,出愈率和分化率逐渐下降,Kan为60 mg/L的培养基上叶盘萎缩变黄,最终褐化,死亡,所以选择50 mg/L的Kan浓度作为转化叶盘出愈和分化选择压力(图4);培养15 d后,对照组中无根苗根系发达,生长良好,在Kan为30mg/L时植株中有少数侧根,但生长缓慢;当Kan增至50 mg/L时植株不生根,且叶片黄化;继续增加Kan浓度至60 mg/L,叶片及整株植株黄化死亡(图5)。因此选择50 mg/L的Kan浓度作为转基因植株生根选择压力。

1-6: Different concentration Kan, 10, 20, 30, 40, 50,60 mg/L, respectively图4 热研2号柱花草子叶出愈伤和分化的Kan梯度试验Fig.4 Different concentration Kan effect on forming callus and sprout

1-6:The different concentration Kan, 10, 20, 30, 40, 50, 60 mg/L, respectively图5 热研2号柱花草生根的Kan梯度试验Fig.5 Different concentration Kan effect on rooting

图6 抗性愈伤筛选Fig.6 Anti-Kan concentration choice of callus
2.4 柱花草转化植株的筛选和移栽
经过Kan对转化叶盘愈伤组织诱导与芽的分化和再生苗的生根筛选,最终共得到60株再生苗,39株能在抗性生根培养基上正常生根(图6~8)。将抗性植株移入温室大棚,以备检测。

图7 诱导愈伤组织分化芽Fig.7 Inducing callus different sprout

图8 诱导转化株生根Fig.8 Inducing transformations rooting
2.5 柱花草抗性转化植株分子检测
2.5.1 特异引物PCR检测 对抗性所筛选得到能够正常生根的36株抗性植株进行特异引物PCR分析,其中20株抗性植株(转pBI-xsB抗性植株7株,转pBI-xsT抗性植株6,转pBI-xsBT抗性植株4株,转pBI-xsBTT抗性植株3株)能扩增出与阳性对照相同大小的条带(图9)。

Lane M: DL 2000 DNA markers; Lane 1: The positive control(the pBI-xsB plasmid); Lane 2,14,28 and 38: The negative control(non-transgenic Stylosanthes spp.); Lane 3-12: Independent transgenic plants; Lane 13: The positive control(the pBI-xsT plasmid); Lane 15-26: Independent transgenic plants; Lane 27:The positive control(the pBI-xsBT plasmid); Lane 29 and37: Independent transgenic plants; Lane 39: The positive control(the pBI-xsBT plasmid); Lane 40-44: Independent transgenic plants图9 特异引物PCR分别鉴定转pBI-xsB、pBI-xsT、pBI-xsBT和pBI-xsBTT的柱花草转化株Fig.9 PCR assay of Stylosanthes spp. Transformants
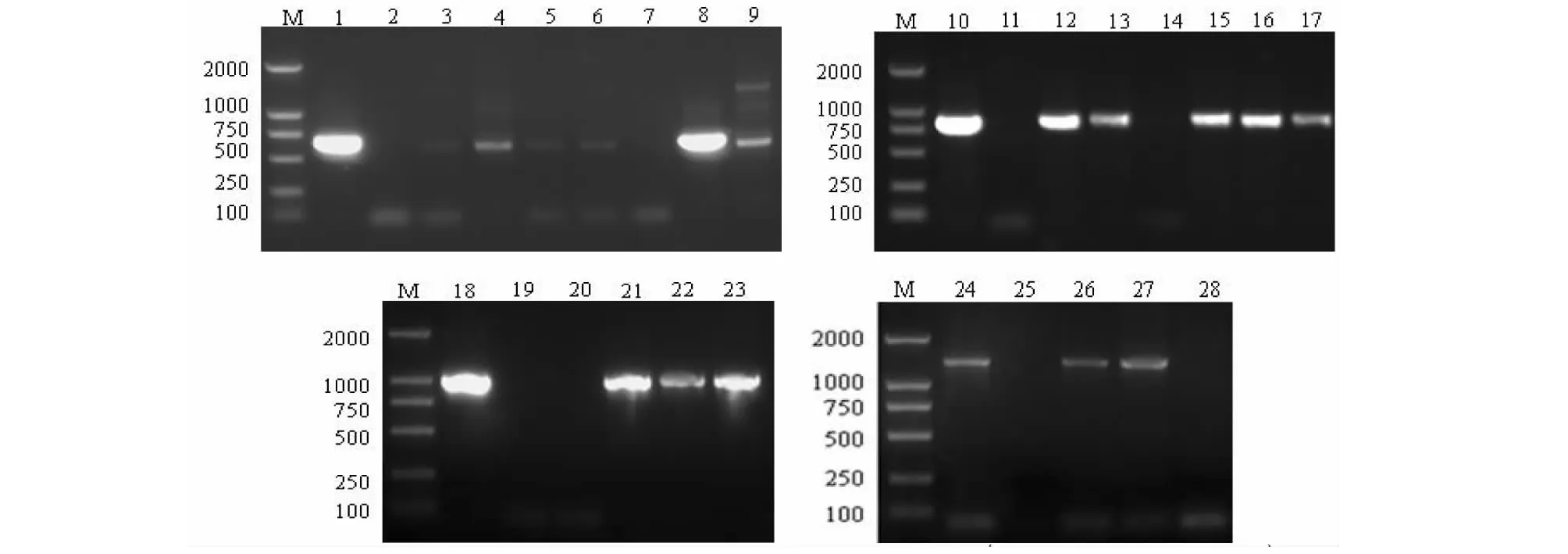
Lane M:DL 2000 DNA markers; Lane 1: The positive control(the pBI-xsB plasmid); Lane 2, 11,19 and 25: The negative control(non-transgenic Stylosanthes spp.); Lane 3-9:Independent transgenic plants Lane 10: The positive control(the pBI-xsT plasmid); Lane 12-17: Independent transgenic plants; Lane 18: The positive control(the pBI-xsBT plasmid); Lane 20-23:Independent transgenic plants; Lane 24:The positive control(the pBI-xsBTT plasmid); Lane 26-28:Independent transgenic plants图10 转基因检测引物PCR分别鉴定转pBI-xsB、转pBI-xsT、pBI-xsBT、pBI-xsBTT的柱花草转化株Fig.10 PCR assay of Stylosanthes spp. Transformants
2.5.2 转基因检测引物PCR扩增 利用转基因检测引物,对2.5.1试验中检测为阳性20抗性株的DNA进行PCR分析,结果有16株(转pBI-xsB抗性植株6株,转pBI-xsT抗性植株5株,转pBI-xsBT抗性植株3株,转pBI-xsBTT抗性植株2株)能扩增出目的带(图10)。
2.5.3 RT-PCR检测 对检测均为阳性的16株植株提取RNA进行RT-PCR分析,经1%凝胶电泳后,16株中的11株(转pBI-xsB抗性植株4株,转pBI-xsT抗性植株3株,转pBI-xsBT抗性植株3株,转pBI-xsBTT抗性植株1株)扩增出相应目的条带如图11。RT-PCR分析表明在35S启动子控制下的11株转化株中,目的基因在转录水平上表达。
3 讨 论
在诱导柱花草子叶外植体出愈伤和分化芽的抗性培养基M3(Kan 50 mg/L、Carb 400 mg/L)中经过30~45 d可诱导愈伤分化及芽的形成,切下单芽在生根培养基M4(50 mg/L Kan)上经25~35 d可以诱导生根。生根配方与文献[16,18]报道生根培养基有差异,但不影响植株正常生根。实验中获得36株经卡那霉素筛选抗性植株,再通过特异引物和转基因植物检测引物2次PCR检测,有效降低了转化株的假阳性,为后续实验提供更真实的植物材料。RT-PCR分析结果表明,11株转化株的目的基因在转录水平上获得了表达,5株出现转录水平的基因沉默,可能是启动子DNA序列发生甲基化,或导入的基因发生异染色质化以及位置效应引起。
Lane M: DL 2000 DNA markers; Lane 1: The positive control(the pBI-xsB plasmid); Lane 2, 10,17and 22: The negative control(non-transgenic Stylosanthes spp.); Lane 3-8: Independent transgenic plants; Lane 9: The positive control(the pBI-xsT plasmid); Lane 11-15: Independent transgenic plants; Lane 16:The positive control(the pBI-xBT plasmid); Lane 18-20: Independent transgenic plants; Lane 21: The positive control(the pBI-xBTT plasmid); Lane 23-24:Independent transgenic plants图11 RT-PCR检测转pBI-xsB、pBI-xsT、pBI-xsBT和pBI-xsBTT的柱花草转化株Fig.11 RT-PCR assay of Stylosanthes spp. Transformants
4 小 结
本研究初步获得了4种转FMDV多抗原表位融合基因的柱花草,为进一步揭示同型与异型FMDV之间多表位基因及其不同融合方式的免疫效果和研制口蹄疫可饲植物疫苗奠定了研究的基础。
