葛根素对大鼠背根神经节神经病理性疼痛的镇痛作用
2018-09-11吴越周祖华闻庆平苗壮
吴越,周祖华,闻庆平,苗壮
(1. 大连医科大学附属第一医院麻醉科,辽宁 大连 116011; 2. 辽宁省军区大连第十六离职干部休养所门诊部,辽宁 大连 116041)
神经病理性疼痛 (neuropathic pain,NP) 是躯体感觉系统损伤或疾病所引起的疼痛,典型症状包括自发性痛、痛觉过敏和痛觉异常[1]。神经损伤后,小胶质细胞释放大量炎性细胞因子 (IL-1 β、IL-6等)[2-4],NP与炎症反应有关,如果能早期抑制炎性细胞因子释放,则可能阻止NP产生。
葛根素是从葛根中提取的一种异黄酮类化合物,化学名8-D-葡萄吡喃糖-4’,7-二羟基异黄酮[5-6]。葛根素对于治疗脑血管疾病具有一定效果,能够改善微循环,可用于治疗脑缺血再灌注引起的脑损伤,对神经元细胞和星型胶质细胞损伤都具有保护作用[7]。相关研究[8]表明,葛根素能够缓解NP,作用半衰期长,需要的剂量小。本研究探讨葛根素对大鼠背根神经节 (dorsal root ganglion,DRG) NP的镇痛作用及其对DRG中炎性细胞因子表达的影响。
1 材料与方法
1.1 实验材料及分组
选用24只雄性SD大鼠 (大连医科大学附属第一医院实验动物中心提供) ,体质量200~220 g。随机均分为3组 (n = 8) :脊神经结扎 (spinal nerve ligation,SNL ) 组 (SNL组,仅行脊神经结扎手术) 、 Pue组 (行SNL手术并鞘内注射葛根素 (10 μ g/mL) ]、假手术组(Sham组,不结扎脊神经,其他手术步骤同SNL组) 。所用动物实验操作均符合大连医科大学动物保护协会和使用委员会的要求。葛根素 (美国Sigma Aldrich公司,CAS编号:3681-99-0) 溶于生理盐水配置成10 μ g/mL浓度溶液供鞘内注射应用。
1.2 方法
1.2.1 鞘内置管:水合氯醛腹腔注射麻醉大鼠后,手术分离暴露右侧L5椎板,将PE-10导管经L4和L5椎间隙向上置入,深度为2 cm,固定于皮下筋膜处,从颈部将导管远端引出,留约2 cm再固定。术后第5天经导管注射20 μ L2%利多卡因,大鼠在随后的30 s内如果出现双腿麻痹则证明鞘内置管成功,随后单笼饲养。
1.2.2 SNL模型制备:将鞘内置管成功的大鼠随机分为3组,水合氯醛腹腔注射麻醉大鼠后,用电动剃刀将腰背部鼠毛清理干净,对皮肤进行消毒处理,切开手术区域皮肤暴露出脊椎,用咬骨钳咬断右侧L5横突,用手术丝线结扎L5和L6神经,最后缝合肌肉与皮肤。 Sham组大鼠的手术操作步骤与SNL手术相同,但只暴露脊神经而不结扎。Pue组大鼠进行SNL手术同时,鞘内注射10 μ L葛根素 (10 μ g/mL) 。1.2.3 大鼠机械缩足反应阈值 (mechanical withdrawal thresholds,MWT) 测定:使用电子 von-Frey测痛仪 (美国IITC Life Science公司) 直径为200 μ m的Von Frey丝刺激大鼠的右侧后足,观察大鼠后足的缩腿反应,用MWT (g) 表示大鼠对机械刺激反应的疼痛程度。 将大鼠置于1个四面透明无底的有机玻璃架 (10 cm×10 cm×15 cm) 中,在有机玻璃架下面放一个金属网架子,实验开始前让大鼠在有机玻璃盒中适应30 min,穿过金属网眼将Von Frey 丝垂直刺向大鼠足底,当大鼠后足出现抬足或舔足行为视为阳性反应,每次刺激间隔时间为5 min,重复测量6次后取平均值。
1.2.4 大鼠热缩足潜伏期 (thermal withdrawal lantency,TWL) 测定:通过检测大鼠后足底对热刺激产生的TWL (s) 来衡量热痛阈值。把待检测大鼠单独放置于透明玻璃笼 (20 cm×20 cm×40 cm) 中,适应环境30 min后,使用热辐射疼痛刺激器 (BME-410C,天津伯尔尼科技有限公司) 在玻璃笼下方固定距离聚焦大鼠后足底,当大鼠产生缩足或舔足停止照射,记录照射起止时间。每次刺激的间隔时间为10 min,每只大鼠重复测量5次后取平均值,设置最高阈值为20 s。
1.2.5 Western blotting 检测DRG神经元中IL-1 β和IL-6表达:SNL手术后,大鼠术侧足术后1~10 d痛阈值呈现稳步下降趋势[9]。实验所用蛋白取自术后7 d每组4只实验大鼠L5和L6的DRG,保存在液氮中。每个样品总蛋白25 μ g,配置5%的积成胶和10%的分离胶;先80 V电压电泳30 min,然后换电压为120 V电泳1 h;在4 ℃冰盒中进行转膜1 h到PVDF膜上,用TBST洗膜,共洗3次,每次5 min;然后用5%脱脂牛奶的TBST室温封闭1 h,接着用一抗IL-1 β (美国Cell Signaling Technology公司,#12242) 和IL-6抗体 (美国Cell Signaling Technology公司,#12912) ,抗体稀释浓度为1∶1 000,4 ℃孵育过夜,次日用TBST洗3次,每次5 min,之后应用二抗 (1∶3 000) 室温孵育1 h,使用发光试剂盒 (中国天能公司) 检测发光信号。所有实验均使用等量蛋白进行GAPDH抗体 (1∶3 000) 检测。蛋白条带灰度值用Image J软件进行分析。
1.2.6 ELISA检测DRG中IL-1 β和IL-6表达:将每组4只大鼠麻醉后,迅速取L5和L6背根神经节 (DRG)[9]。将DRG用玻璃匀浆器制成匀浆,用BCA法进行蛋白浓度测定,将浓度统一为1 μ g/μ L。按照ELISA试剂盒说明书测定炎性细胞因子IL-1 β以及IL-6含量。先用洗涤液 (300 μ L/孔) 清洗酶标孔中,重复5次。每孔加入100 μ L标准品、样品;室温下孵育2 h。洗板5次。加入提前配好的抗体工作液 (100 μ L /孔) ,室温下用摇床 (100 r/min) 孵育1 h。洗板5次。随后加入提前配好的酶结合物工作液 (100 μ L/孔) ,室温下用摇床(100 r/min) 孵育0.5 h。洗板5次。加显色剂 (TMB,100 μ L/孔) ,室温下反应,避光显色15 min,颜色为蓝色。加终止液 (100 μ L/孔) ,轻轻混匀呈黄色,在5 min内用酶标仪进行双波长检测 (450 nm为主波长,570 nm或630 nm为参考波长) 。
1.3 统计学分析
2 结果
2.1 各组大鼠MWT比较
结果显示,大鼠在SNL手术前对机械刺激缩腿反应的基础阈值是20.5 g。与Sham组比较,SNL组大鼠MWT明显降低 (P < 0.01) ,并表现为时间依赖性,手术后1、3、5、7 d后持续降低。与SNL组比较,Pue组大鼠除第1天外,其他时间点MWT明显升高 (P <0.05) ,见表1。
2.2 各组大鼠TWL比较
各组大鼠术前1 d时TWL比较差异均无统计学意义( P > 0.05) 。与Sham组比较,SNL组、Pue组术后5、7 d TWL均降低( P < 0.05) ,与SNL组比较,术后5、7 d Pue组TWL升高( P < 0.05) ,见表2。
2.3 Western blotting检测各组大鼠DRG中IL-1 β、IL-6蛋白表达
表1 各组大鼠术后不同时间MWT比较 (g,)Tab.1 Comparison of mechanical withdrawal thresholds in three groups of rats after surgery (g,)
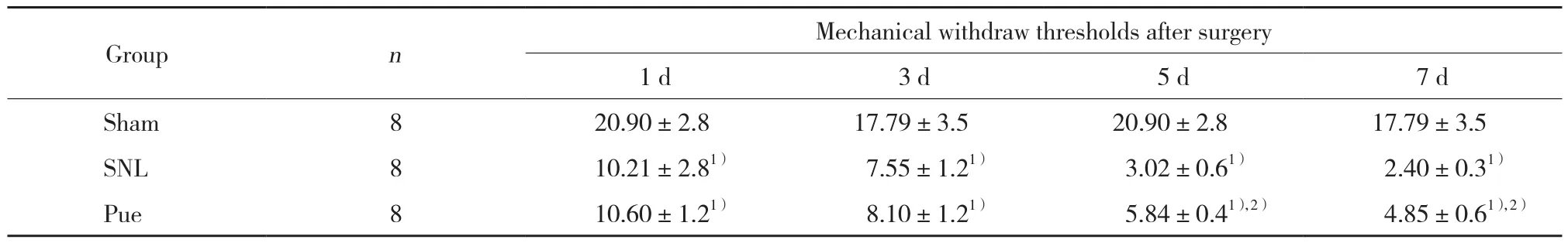
表1 各组大鼠术后不同时间MWT比较 (g,)Tab.1 Comparison of mechanical withdrawal thresholds in three groups of rats after surgery (g,)
1) P < 0.05 vs Sham group;2) P < 0.05 vs SNL group.
Group n Mechanical withdraw thresholds after surgery 1 d 3 d 5 d 7 d Sham 8 20.90±2.8 17.79±3.5 20.90±2.8 17.79±3.5 SNL 8 10.21±2.81) 7.55±1.21) 3.02±0.61) 2.40±0.31)Pue 8 10.60±1.21) 8.10±1.21) 5.84±0.41),2) 4.85±0.61),2)
表2 术后各组大鼠不同时间TWL比较 (s,)Tab.2 Comparison of thermal withdrawal latencies in three groups of rats after surgery (s,)
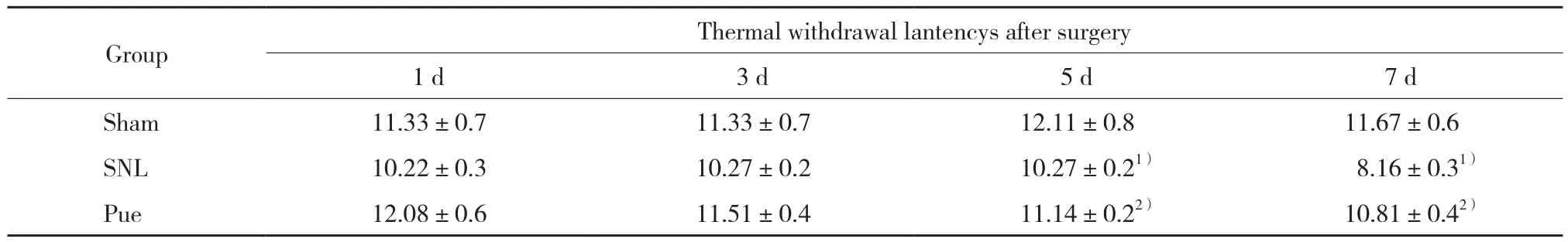
表2 术后各组大鼠不同时间TWL比较 (s,)Tab.2 Comparison of thermal withdrawal latencies in three groups of rats after surgery (s,)
1) P < 0.05 vs Sham group;2) P < 0.05 vs SNL group.
Group Thermal withdrawal lantencys after surgery 1 d 3 d 5 d 7 d Sham 11.33±0.7 11.33±0.7 12.11±0.8 11.67±0.6 SNL 10.22±0.3 10.27±0.2 10.27±0.21) 8.16±0.31)Pue 12.08±0.6 11.51±0.4 11.14±0.22) 10.81±0.42)
结果显示,Sham组大鼠DRG组织中IL-1 β和IL-6表达很低。与Sham组比较,SNL组 IL-1 β和IL-6表达明显增加 (P < 0.01) ;Pue组与SNL组比较IL-1 β和IL-6明显降低 (P < 0.05) ,见图1。
2.4 ELISA检测各组大鼠DRG中IL-1 β、IL-6水平比较

图1 术后7 d各组大鼠DRG中IL-1 β、IL-6蛋白表达Fig.1 Expression of IL-1 β and IL-6 proteins in the dorsal root ganglion of rats,7 days after surgery in each group
结果显示,与Sham组比较,SNL组IL-1 β、IL-6表达升高 (P < 0.05) ;与SNL组比较,Pue组IL-1 β、IL-6表达降低 (P < 0.05) 。
表3 术后7 d各组大鼠DRG中IL-1 β、IL-6蛋白表达比较 (,pg/mg)Tab.3 Expression of IL-1 β and IL-6 protein in the dorsal root ganglion of rats,7 days after surgery in each group(,pg/mg)

表3 术后7 d各组大鼠DRG中IL-1 β、IL-6蛋白表达比较 (,pg/mg)Tab.3 Expression of IL-1 β and IL-6 protein in the dorsal root ganglion of rats,7 days after surgery in each group(,pg/mg)
1) P < 0.05 vs Sham group;2) P < 0.05 vs SNL group.
Group IL-1 β protein IL-6 protein Sham 128.30±15.4 112.58±25.8 SNL 335.24±21.61) 452.28±46.51)Pue 178.58±16.82) 230.28±36.62)
3 讨论
有研究[10]发现,葛根素能够阻断Na+通道,通过抑制TTX-R钠电流的激活进而减少大鼠DRG神经元细胞钠离子电流。葛根素能够抑制大鼠DRG神经元细胞P2X3的表达,对急性烧伤疼痛大鼠模型发挥镇痛作用[11]。本实验所采用的SNL模型是NP发病机制研究的常用动物模型,研究结果表明模型制备成功,手术后大鼠出现了显著的机械性痛觉超敏和热痛觉过敏;SNL大鼠持续注射葛根素可减轻因神经损伤所引起的机械性痛觉超敏和热痛觉过敏,并在第7天停药后镇痛作用持续存在。与Sham组比较SNL大鼠术后DRG炎性细胞因子表达明显升高,在持续鞘内注射葛根素7 d后炎性细胞因子明显下降,表明葛根素可抑制NP所引起的炎性细胞因子表达,进而产生镇痛作用。在CFA诱导的慢性炎症动物模型中,葛根素通过抑制前炎性细胞因子来缓解炎症痛[12]。在大鼠慢性压迫损伤模型中,葛根素通过抑制脊髓的神经炎症缓解神经病理性疼痛[13],与本研究结果一致。
综上所述,鞘内注射葛根素可缓解大鼠SNL所致NP,并通过下调DRG中炎性细胞因子IL-1 β以及IL-6的表达,抑制炎症反应,对NP具有镇痛作用。本研究未对葛根素抑制炎性细胞因子的机制进行探讨,推测葛根素抗NP的作用可能与其抑制胶质细胞的活化进而减少炎性细胞因子表达有关,其具体作用机制还需要进一步探讨。
