广西北部湾地区猪圆环病毒2型检测及其ORF2遗传变异分析
2018-09-10吕其壮曹伟伟李佩伦莫昭展
吕其壮,刘 娟,陈 艳,刘 畅,颜 秋,曹伟伟,李佩伦,莫昭展
(1.玉林师范学院生物与制药学院,玉林 537000;2.广西农产资源化学与生物技术重点实验,玉林 537000;3.玉林师范学院商学院,玉林 537000;4.河南省动物疫病预防控制中心,郑州450000;5.玉林市动物疫病预防控制中心,玉林537000)
猪圆环病毒病(porcine circovirus associated disease,PCVAD)是由猪圆环病毒2型(Porcine circovirus type 2,PCV2)引起的一种猪传染病或猪相关疾病的综合征,主要包括断奶仔猪多系统衰竭综合征、仔猪先天性震颤、成年猪皮炎肾炎综合征、增生性坏死性肺炎、肠炎、繁殖障碍和呼吸道疾病综合征[1]。该病于1991年首次发现于加拿大,现已呈全世界流行,死亡率介于10%~30%,个别猪场在暴发本病时死淘率高达40%左右[2]。我国于2000年首次报道该病的发生,迄今已经在我国猪群中普遍存在,严重阻碍了我国养猪业的发展[3,4]。
PCV2属于圆环病毒科(Circoviridae)圆环病毒属(Circovirus),其基因组是一条共价结合形成的闭合环状的单链DNA,大小为1766~1768 bp,编码11个潜在开放阅读框(open reading frame,ORF)[3]。PCV2各毒株的核苷酸序列同源性都在90%以上,分为PCV2a、PCV2b、PCV2c、PCV2d和PCV2e 5种基因亚型,其中PCV2b是目前PCV2最主要的流行毒株[5]。PCV2 ORF2 基因序列较短且拥有较少的labor-extensive序列,其编码的Cap蛋白不仅是病毒主要结构蛋白或衣壳蛋白,而且是PCV2全基因组中变异程度最高的蛋白,Cap的多态性既在病毒吸附过程中起重要作用,又影响病毒装配动力学和结构稳定性,因此ORF2基因经常被认为是引起PCV2整个基因组变异的主要靶基因[3,6]。
本研究采用PCR方法对2016年采自广西北部湾地区疑似PCV2感染的猪病料样品进行PCV2检测并对分离株的ORF2基因进行扩增、克隆、测序和序列进化分析,以探讨该区域近期PCV2的分子流行病学变异趋势和变异规律,进而为PCVAD的分子诊断和免疫预防等研究提供一定的理论依据。
1 材料与方法
1.1 病料采集 采自2016年广西玉林(兴业、陆川、博白、北流)、北海(铁山港、合浦)、钦州(浦北、灵山)、防城港(港口、东兴、上思)、崇左(凭祥、龙州、大新、天等)、南宁(青秀、宾阳、马山、上林、横县)等地区疑似PCV2感染的猪血液、脾脏、肺脏和淋巴结等样品,保存于-40℃冰箱备用。
1.2 主要试剂 病毒基因组RNA/DNA提取试剂盒(MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0)、内切酶EcoRI和XhoI、T4连接酶、DNA Marker DL2000、pGEX-6p-1载体均购自TaKaRa公司;2×Taq PCR MasterMix和胶回收试剂盒均购自康为世纪生物科技有限公司;Trans 2K plus DNA Marker购自全式金生物技术有限公司;DH5α购自天根生化科技有限公司。
1.3 病毒核酸的提取 无菌条件下,取疑似感染PCV2猪的脾脏、肺脏和淋巴结等样品10 mg置于陶瓷研钵中并加入适量液氮研磨,然后向研磨后的组织中加入200 μL RNase-free ddH2O混匀并按试剂盒说明书进行病毒DNA的抽提。其中,阴性对照用RNasefree ddH2O代替病毒核酸,阳性对照pSK-W质粒由西北农林科技大学动物医学院馈赠。
1.4 引物设计与合成 利用汤智慧等[7]设计的P1/P2引物对病料样品进行PCV2检测,并根据GenBank中登录的PCV2 杭州分离株(GenBank登录号:AY188355)的全基因组序列进行ORF2基因扩增引物的设计与合成P3/P4,并在上、下游引物两端分别添EcoRI和XhoI。P3:5'-CGGGATCCATGACGTA TCCAAGGAGGC-3'和P4:5'- CCGCTCGAGTTA AGGGTTAAGTGGGGGGTC-3',由华大基因公司合成。
1.5 样品PCR检测 用上述提取的病毒DNA作为模板,以P1/P2为引物,采用 PCR方法检测样品中PCV2。反应体系:上游引物1.0 μL、下游引物1.0 μL、2×Taq PCR MasterMix 10.0 μL、样品DNA模板1.0 μL、补足ddH2O 至20 μL。反应条件参照汤智慧等[7]方法进行,最后12℃ 终止反应。
1.6 ORF2基因的扩增、克隆及测序 对于PCV2阳性的病料,随机选取其中4份DNA作为模板,用P3/P4作为扩增引物,扩增样品中PCV2 ORF2基因,反应体系同上,反应条件:95℃预变性5 min;94℃变性30 s,53℃退火40 s,72℃延伸40 s,35个循环;72℃延伸10 min;12℃ 终止反应。
1.7 ORF2基因序列分析 利用生物软件Lasergene将测序的4株PCV2 ORF2基因与GenBank 中登录的 34 株国内外 PCV2 参考株ORF2序列进行核苷酸和氨基酸序列的比对分析,并对已比对的序列使用MEGA 7.0软件构建Neighbor-joining系统进化树,以分析广西北部湾地区PCV2 ORF2基因的遗传变异情况。
2 结果
2.1 样品中PCV2的检测 采集的306份病料经P1/P2特异性引物扩增后,129份样品得到332 bp的特异性条带,条带大小与预期结果相符(图1),说明样品中PCV2检出阳性率为42.16% (129/306)。
2.2 ORF2基因扩增与测序 利用P3/P4引物,扩增阳性病料中的PCV2 ORF2基因,获得4个大小约为702 bp的目的片段,与预期结果相符(图2)。将上述目的片段纯化,经双酶切、胶回收、连接和再次双酶切验证后,送至华大基因公司测序,测序无误的4个ORF2基因序列所对应的PCV2分离株分别命名为BBW-1(玉林)、BBW-2(北海)、BBW-3(防城港)和BBW-4(南宁)。
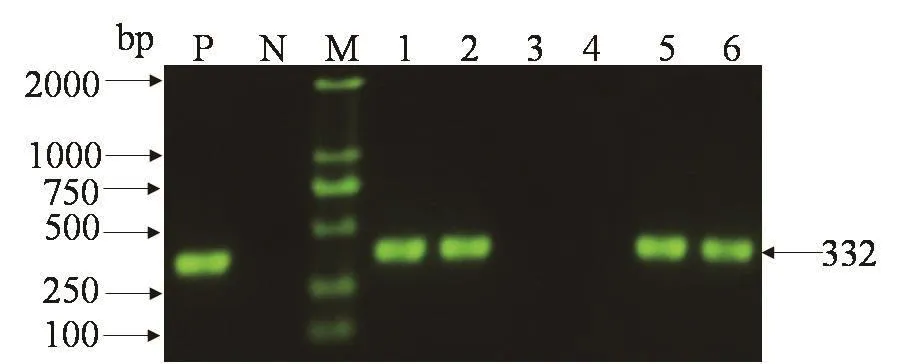
图1 部分样品中PCV2的PCR检测结果Fig.1 The PCR products of PCV2 in partial samples
2.3 ORF2基因的序列分析 应用生物软件Lasergene,对获得的4个PCV2分离株的ORF2基因序列与国内外已发表的34株参考毒株的ORF2基因序列进行核苷酸和氨基酸序列的同源性分析,参考毒株的信息见表1。结果表明4株PCV2 ORF2基因的核苷酸同源性为98.9%~99.5%,其相对应的氨基酸同源性为93.9%~95.4%。其中BBW-1和BBW-2分离株与欧洲Fd3株(AY321984)同源性最高,分别达到99.4%和99.7%;BBW-3与欧洲Fd3株(AY321984)、375株(AY256460)和NL_PMWS_3株(AY484415)同源性最高,达到99.7%;BBW-4分离株与欧洲NL_PMWS_3株(AY484415)同源性最高,达到99.0%。
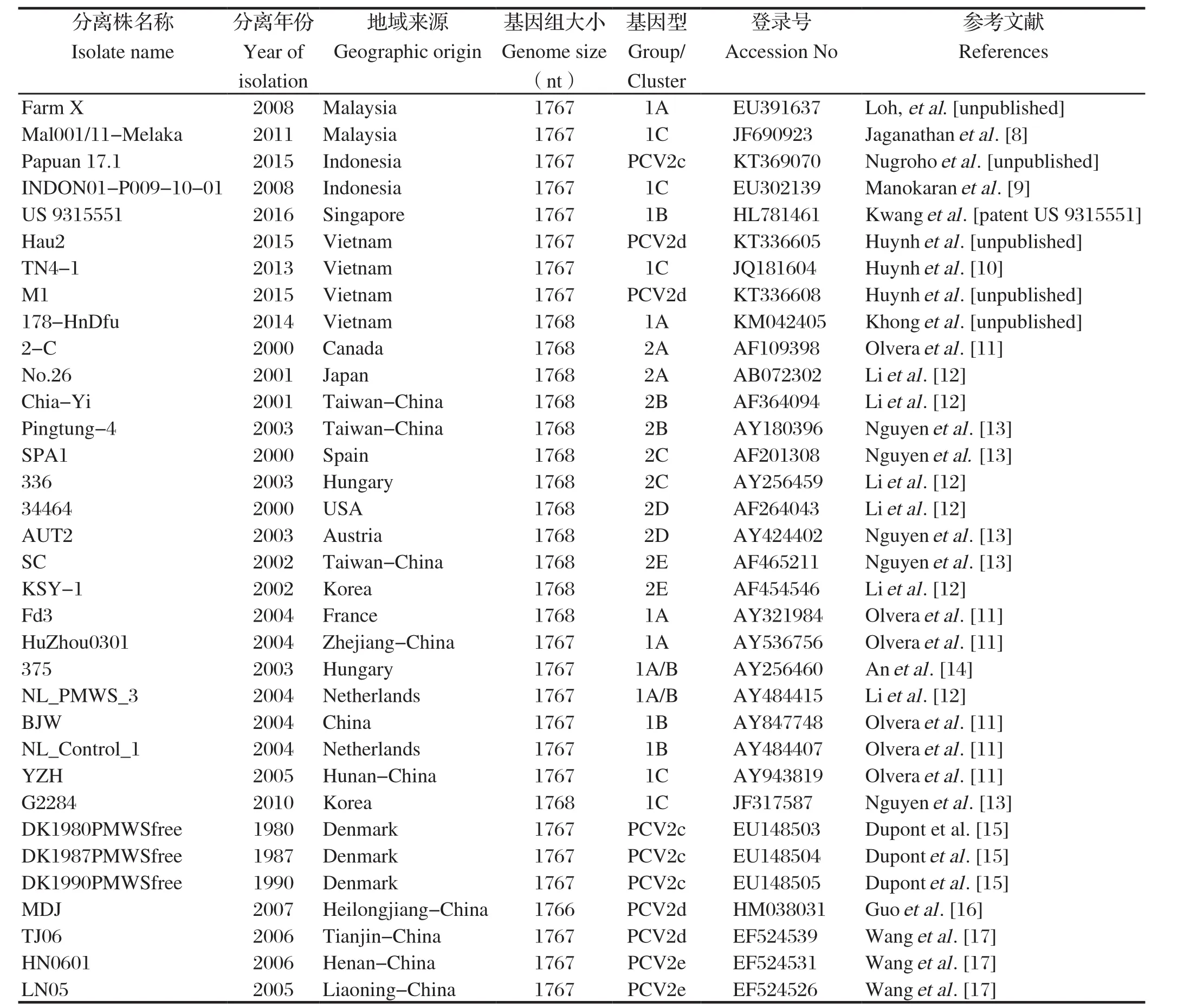
表1 PCV2遗传进化分析的参考毒株Table 1 Representative PCV2 isolates used in the genetic variation and phylogenetic analyses
2.4 PCV2各分离株ORF2基因的遗传进化树分析 应用生物软件MEGA 7.0对获得的4株PCV2分离株ORF2基因的核苷酸序列进行分析,绘制了遗传进化树(图3)。结果表明,4株PCV2分离株均属于Group 1(PCV2b),因其序列的差异可分为2个基因亚型,即1A和1B[8-17]。其中BBW-1和BBW-2分离株的ORF2基因与法国流行毒株Fd3株的亲缘关系较近,属于1A分支;BBW-3和BBW-4分离株的ORF2基因与国内流行毒株BJW株的亲缘关系较近,属于1B分支。
2.5 PCV2各分离株ORF2基因编码氨基酸序列的遗传变异分析 应用生物软件Lasergene将测定的4株PCV2分离株的ORF2基因的核苷酸序列推导出相应的Cap蛋白氨基酸序列,并与国内外已发表的34株参考毒株的Cap蛋白氨基酸序列进行了比对分析(图4)。结果表明,分离的4株PCV2分离株的Cap蛋白氨基酸序列存在多处突变,尤其存在1个变异度较高的主要区域,即57~63 aa。其中BBW-1 分离株与Fd3株(AY321984/France)同源性最高,BBW-2 分离株与NL_PMWS_3株(AY484415/Netherlands)同源性最高,BBW-4 分离株与HuZhou0301株(AY536756/Zhejiang-China)和NL_Control_1株(AY484407/Netherlands)同源性最高,然而却并未发现与BBW-3分离株一致的参考毒株,只是BBW-3与BBW-2、BBW-4分离株都比较相似。
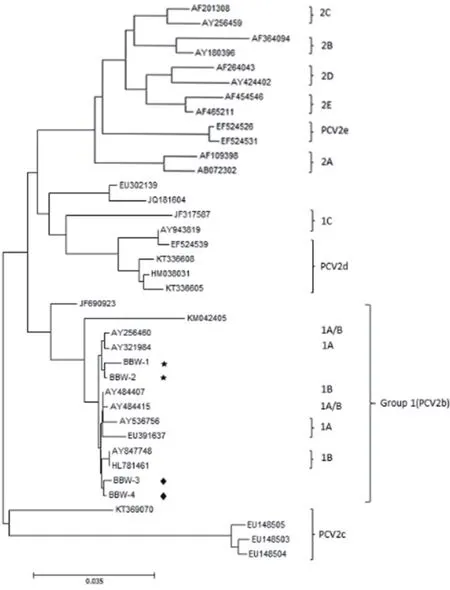
图3 PCV2 ORF2基因系统进化树Fig.3 Phylogenetic evolutionary tree of ORF2 gene of PCV2 isolates
3 讨论
北部湾经济区地处广西西南部,是中国与东盟国家之间贸易往来的窗口,更是海上丝绸之路的起点。由于气候适宜,地域优势明显,适合发展养猪业,俨然成为全国生猪养殖优势区域。然而,随着养猪产业的大力发展和外来种猪(如加系、美系和皮特兰种猪等)的广泛引入,越来越多的传染病在地区暴发或流行,并在一定程度上阻碍了北部湾地区养猪业的进一步发展。PCV2是危害世界养猪业的主要传染病之一,目前已呈全球性流行,尽管疫苗的使用和采用捕杀等方式在猪圆环病毒病的控制中发挥了巨大作用,但猪圆环病毒病时有发生,而且多数猪广泛带毒,尤其是PCV2隐性感染和继发感染现象严重,再加上PCV2遗传变异频率居高不下,PCV2感染所带来的危害和造成的重大经济损失已引起世界动物卫生组织(OIE)的高度重视[3]。
鉴于此,本研究着重对广西北部湾地区规模猪场和农村散养户的疑似PCV2感染猪的肺脏、脾脏、淋巴结和血液等样品进行了PCV2病原体的检测,同时基于PCV2分离株ORF2基因的核苷酸和氨基酸序列对该区域PCV2流行毒株的分子流行病学特点和遗传变异情况进行了分析。结果显示:目前广西北部湾地区猪群中普遍存在PCV2感染,PCV2阳性率高达42.16%,这一结果略高于刘翠权等[18]针对2007~2009年广西规模场猪群中PCV2的调查结果(34.52%),但是显著高于胡帅等[19]与针对2013~2014年广西部分地区猪群中PCV2的调查结果(18.54%),说明几年来PCV2感染有显著上升的趋势,尤其是在“一带一路”大背景下的频繁贸易往来可能会加速PCV2的遗传漂变和传播。通过对获得的4株PCV2分离株的ORF2基因序列分析表明,4株PCV2分离株均属于PCV2b基因亚型,且彼此之间的核苷酸序列同源性也都在90%以上,其中BBW-1和BBW-2分离株与欧洲代表株Fd3的同源性较高,而且在进化树上的关系也比较接近,因此把它们划归为1A分支。同样的情况,我们把BBW-3和BBW-4分离株划归为1B分支。通过对4株PCV2分离株与东盟各国PCV2代表毒株的比对分析显示,广西北部湾地区PCV2流行毒株与马来西亚株Mal001/11-Melaka(JF690923)和Farm X (EU391637)、越南株178-HnDfu (KM042405)和新加坡株US 9315551(HL781461)亲缘关系较近(图4),由此推断,本研究获得的4株PCV2分离株很可能来自东盟国家,进一步反映了当前广西北部湾地区PCV2疫情防控的复杂性。
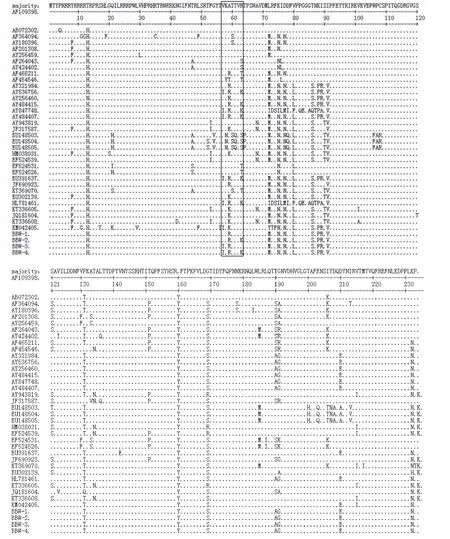
图4 PCV2毒株间的Cap序列的比对分析Fig.4 Comparison analysis of Cap amino acid sequence of PCV2 isolates
PCV2 ORF2基因较短,而且相对PCV2全长基因组而言又拥有较少的labor-extensive序列,因此学者在对PCV2进行分子流行病学调查或者遗传进化分析时常把ORF2基因作为主要靶基因[3,6]。ORF2基因编码的Cap蛋白是PCV2的主要抗原,其所拥有的3个主要抗原位点(分别位于47~63 aa、165~200 aa和230~233 aa)也是最容易发生变异的区域,因此也就成为了PCV2遗传变异分析的结构之一。本研究结果表明,虽然获得的4株PCV2分离株的Cap蛋白之间的氨基酸同源性较高,但是仍然存在多处氨基酸突变,尤其是在57~63 aa区域变异更为明显,而该区域刚好位于Cap蛋白的高突变区域之一,即47~63 aa,因此其结果可能影响中和抗体与相应抗原位点的结合,导致现行PCV2疫苗免疫失败。因此,为有效防控PCV2,今后应加强对该区域PCV2的分子流行病学调查和遗传进化分析。
